细胞外囊泡作为肾细胞癌诊疗标志物的研究进展*
2023-06-04张钰王成汪俊军南京大学医学院附属金陵医院东部战区总医院检验科南京210002
张钰,王成,汪俊军(南京大学医学院附属金陵医院&东部战区总医院检验科,南京 210002)
肾细胞癌(renal cell carcinoma,RCC)是起源于肾小管上皮的泌尿系统恶性肿瘤,约占成人恶性肿瘤的3%,早期缺乏特异性症状,诊断主要依靠影像学检查,约17%的患者在初诊时存在远处转移[1],5年生存率仅为12%[2],因此早期诊断、转移风险的预测、药物靶点的研发对于RCC患者诊治及预后至关重要。细胞外囊泡(extracellular vesicles,EVs)是一种由细胞释放的脂质双层膜包裹的纳米级囊泡,内含蛋白质、脂质、细胞因子、DNA、RNA及代谢产物等多种生物分子,可被特定的受体细胞摄取并发挥生理功能。EVs主要分为凋亡小体、外泌体和微囊泡3种亚群,这3种亚群直径大小、表面标志蛋白存在重叠,尚缺乏明确区分标准[3]。大量研究证实,肿瘤患者EVs可携带特定生物分子,作为细胞间信号网络的重要通信介质,参与细胞功能调节、肿瘤发生发展以及机体免疫反应等多种过程[4-5]。本文简要介绍了RCC患者EVs特定分子的变化及其在RCC发生、发展中的作用,探讨EVs对于RCC诊断、治疗的临床应用价值及挑战。
1 EVs及其内容物作为RCC新型分子标志物
EVs由细胞释放,可反映起始细胞的类型,携带特定信息转移到邻近或远处细胞发挥功能,诱导受体细胞表型改变[2]。研究显示,EVs在不同来源及生理病理条件下的内容物成分、含量具有的特异性、物种间的保守性、稳定性、高丰度都赋予其理想的肿瘤液体活检标志物的潜力[6]。目前,国内外已有部分EVs及其内容物作为RCC分子标志物的研究,具体内容见表1。
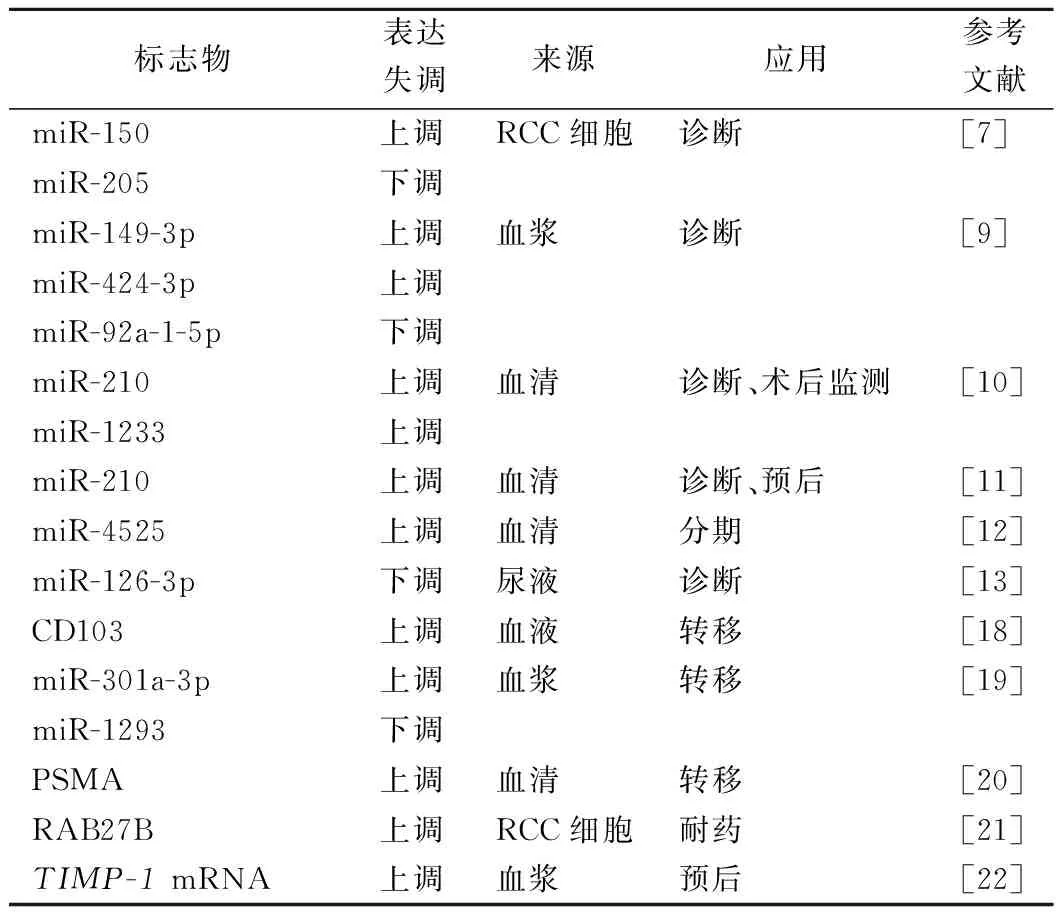
表1 EVs及其内容物作为RCC分子标志物
1.1EVs作为RCC诊断和分期的标志物 研究发现[7],与对照细胞系(HK-2)相比,RCC细胞系(786-O)分泌的EVs中miR-150的表达水平上调了5.2倍,而miR-205则下调了10 000倍,提示EVs中miR-205、miR-150可作为RCC诊断的新型标志物。同时,Zieren等[8]对不同RCC细胞系来源的EVs中的肿瘤相关蛋白质和mRNA进行多组学分析,确定了多个候选分子标志物,并证实其不但可以区分RCC和良性病变,还可以辅助判断RCC亚型,临床转化潜力巨大。
然而,体外细胞模型并不能完全和实时反映肿瘤状况,临床标本的筛查及验证仍必不可少。有报道称[9],与健康人对照相比,肾癌患者血浆EVs中miR-149-3p和miR-424-3p水平上调,而miR-92a-1-5p明显下调,可以辅助诊断RCC。Zhang等[10]分析发现,透明细胞性肾细胞癌(clear cell renal cell carcinoma,ccRCC)患者血清EVs中miR-210和miR-1233的表达水平明显高于对照组,且肿瘤切除术后其表达水平均显著降低,对于RCC诊断和手术效果监测具有重要价值。
此外,RCC患者血清EVs中miR-210水平还与患者的临床预后相关,且对于早期患者的诊断性能优于血清miR-210[11]。同样地,血清EVs miR-4525可作为晚期RCC患者潜在的诊断指标[12]。除血液外,其他体液来源的EVs同样具备RCC诊断潜能。Butz等[13]发现尿液EVs miR-126-3p与miR-449a或miR-34b-5p联合应用可显著区分ccRCC患者和健康人对照。目前,尽管EVs内容物作为RCC分子标志物的研究大部分聚焦于miRNA,但也要认识到EVs中的其他特定分子(蛋白质、mRNA、DNA等)亦可用于RCC的辅助诊断[14-16]。上述研究均证实EVs及其内容物有望成为RCC诊断及分期标志物。
1.2EVs作为RCC转移监测的标志物 RCC具有高度转移倾向,已有学者通过细胞和动物实验证实,RCC细胞系(786-O)释放的EVs可通过转运长链非编码RNA(long non-coding RNA,LncRNA)人肺腺癌转移相关转录因子1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)进入相邻非转移倾向RCC细胞,提高非转移RCC细胞生长、侵袭和转移能力[17]。同时,ccRCC患者肿瘤干细胞(cancer stem cell, CSC)中分离的CD103+EVs通过转运miR-19b-3p至ccRCC细胞,靶向与细胞迁移密切相关的第 10号染色体磷酸酶和张力蛋白同源缺失性基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)的蛋白质表达,CD103还能够引导肿瘤干细胞EVs靶向癌细胞和器官,使得ccRCC具备更高的肺转移能力[18]。另外,RCC转移患者血浆EVs中miR-301a-3p表达增加、miR-1293表达减少,可作为RCC转移潜在指标[19]。
EVs蛋白亦可监测RCC转移。Kawakami等[20]建立了夹心ELISA法以检测血清EVs中的前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)水平,结果发现转移性RCC患者的血清EVs PMSA水平显著高于非转移患者,并可反映肿瘤原发灶及转移灶血管新生情况,能实时监测转移性RCC。此外,EVs表面或内容物可为肿瘤的转移提供靶向识别位点,并为研发预测RCC转移标志物和靶向治疗策略提供理论依据。
1.3EVs作为RCC耐药、预后判断的标志物 RCC患者预后与肿瘤的分期、分级、转移及患者对治疗药物的敏感性等密切相关。评估患者对于药物的敏感性,可以指导临床合理化、个体化、精准化用药。Ras相关蛋白Rab-27B(ras-related protein Rab-27B,RAB27B)是参与EVs分泌的主要蛋白质之一,已有研究[21]证实,该蛋白质高表达与肝细胞癌、结直肠癌和卵巢癌的不良预后有关,在舒尼替尼耐药的肾癌细胞系中也发现RAB27B呈显著高表达。Dias等[22]发现与非转移性原位ccRCC患者相比,转移性患者血浆EVs中基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase1,TIMP-1) mRNA水平更高,总生存率更低,提示EVs来源的TIMP-1mRNA是ccRCC潜在的预后标志物。另外,Zhang等[23]还发现,经冷冻消融治疗1 d后,小鼠血清来源的EVs中miR-126-3p、miR-17-5p和miR-21-3p迅速下降,反映活跃肿瘤数量,可用于评价肿瘤清除效果及动态监测肿瘤负荷。
2 EVs在RCC发生、发展中的作用机制
多项研究证实[24-26],在病理情况下,EVs释放及其内容物的量和质都会发生改变,参与RCC发生、发展及TME的调节,在细胞增殖、迁移、耐药、血管生成、免疫抑制等方面发挥重要作用。
2.1EVs参与调节肿瘤细胞表型 对于肿瘤本身,TME中不同细胞分泌的EVs内容物通过改变RCC细胞表型以支持肿瘤生长。肾癌细胞来源的EVs中miR-9-5p可通过靶向SOCS4mRNA并抑制其表达,促进两面神激酶—信号传导及转录激活蛋白(janus kinase-signal transducer and activator of transcription,JAK-STAT)途径中JAK和STAT因子的磷酸化,从而激活转录,促进RCC的增殖、侵袭[27]。
缺氧是RCC-TME的显著特征之一,85%的ccRCC患者中存在由染色体丢失引起的Von Hippel-Lindau(VHL)基因失活,为最常见的基因改变[28]。EVs的释放可由多种因素诱导,包括缺氧、pH变化、损伤、辐射、血小板激活和应激状态等。一项体外细胞水平研究[29]发现,急性缺氧可诱导肿瘤细胞释放更多的EVs。不仅如此,另有文献报道[30]缺氧诱导RCC细胞来源的EVs miR-155表达增加,能显著抑制叉头框蛋白O3(FOXO3)的激活,减轻细胞凋亡,促进肿瘤增殖和迁移。可见,缺氧条件下,肾癌细胞释放EVs的量和内容物均会发生改变,调节受体细胞表型,推动RCC进程。然而,目前关于缺氧如何调节EVs产生、释放、调控的机制仍未阐明。
肿瘤细胞对于化疗药物的固有或获得性耐药是RCC晚期患者预后不良的重要原因。研究[31]发现,与舒尼替尼抵抗相关的LncRNA(lncRNA activated in RCC with sunitinib resistance,LncARSR)是舒尼替尼耐药的ccRCC细胞中高丰度的基因,可通过EVs包裹和传递,被受体细胞摄取后通过竞争性结合miR-34和miR-449以提高AXL受体酪氨酸激酶和细胞间质上皮转换因子的表达,将受体细胞的表型从舒尼替尼敏感转为耐药。此外,索拉非尼耐药细胞系的EVs可被敏感细胞摄取,EVs内miR-31-5p靶向抑制MutL同源物1(MutL homolog 1,MLH1)的表达,从而传递耐药信息[32]。
2.2EVs参与调控TME EVs不仅可以靶向肿瘤本身,其介导的肿瘤细胞和肿瘤相关细胞之间的通讯重塑了TME,为癌症的进展和转移创造了有利的条件[33]。
代谢重编程和血管新生是RCC 2个重要表型,肿瘤新生血管运输氧气和营养物质,维持TME稳态。研究发现,缺氧导致更多数量的高表达碳酸酐酶Ⅸ(carbonic anhydrase Ⅸ,CAⅨ)的EVs从低氧肾癌细胞中释放,可增加人脐静脉上皮细胞中基质金属蛋白酶2的表达,促进微环境中血管生成[34]。同时,RCC细胞分泌的miR-150、miR-23a、miR-210、miR-135b、miR-494、miR-1246和miR-9等可通过EVs传递到内皮细胞,促进血管内皮生长因子(vascular endothelial growth factor,VEGF)分泌[13,35]。
不仅是肿瘤细胞本身,TME内非肿瘤细胞来源的EVs也能够调节肿瘤表型。Qin等[2]研究发现,肾间充质干细胞来源的EVs可促进RCC细胞移植瘤小鼠肿瘤生长和血管生成。此外,EVs也参与了TME中的免疫抑制。CD105+CSC来源的EVs干扰T细胞的活化、阻滞单核细胞向树突状细胞的分化[2]。从人肾癌细胞中分离的EVs表面高表达凋亡相关因子配体,可以诱导T淋巴细胞凋亡[35],使得机体免疫系统不能有效激活、识别并清除肿瘤细胞。总之,EVs在RCC的发生及进展中意义重大,对于其在 RCC中病理、生理机制的探索,能进一步拓宽EVs应用于临床RCC的早期诊断、治疗的新思路。
3 EVs介导RCC的治疗前景
EVs作为细胞间信号调控网络的重要媒介,在肿瘤的诊断、治疗及预后等方面有着极大的应用前景[36]。已有临床研究[37]将EVs作为肺癌、肾癌、胃癌、乳腺癌、直肠癌、胆囊癌、胰腺癌及前列腺癌等疾病的新兴治疗手段。
3.1EVs在RCC中的治疗靶点 首先,直接抑制EVs的释放可以阻断EVs的促肿瘤作用[37],但鉴于EVs的释放非肿瘤细胞独有,正常细胞亦可分泌EVs并发挥生理功能。因此,如何在不影响生理EVs分泌的情况下特异性阻断肿瘤细胞EVs生物发生及释放值得研究。
其次,EVs对于肿瘤存在正向与负向调控,故而通过特异性抗肿瘤内容物的转移和诱导来抑制RCC进程是EVs应用于肿瘤治疗的另一途径。例如,间充质干细胞来源的EVs可携带miR-182,抑制VEGF-A表达,促进T细胞增殖和激活,抑制ccRCC的进展和体内转移[38]。
基于EVs本身的生物学特性和其在RCC发生、发展进程中的肿瘤功能性行为,EVs可用于RCC单独或联合治疗,现今主要从以下方面进行研究:(1)使用药物抑制促肿瘤进展的EVs的释放;(2)靶向内吞体分选转运复合体等内容物分选通路,调节EVs内货物的装载;(3)阻止受体细胞摄取促肿瘤的EVs;(4)表达治疗性药物的EVs抑制肿瘤进展相关通路[36]等,对于EVs的认识及应用尚且粗浅,需要更多的临床研究来验证其可行性。
3.2EVs作为天然药物载体 EVs的生理功能可以作为RCC分子标志物和治疗干预靶点,更重要的是,其本身的固有特性也被认为是向特定细胞运送miRNA、药物及其他分子的天然载体。EVs的膜结构可有效地保护内容物不被降解,由内源性细胞产生、分泌,能够跨越各种生物屏障,安全低毒、低免疫原性、生物相容性高,且表面蛋白具有靶向性[39],能够装载多种癌症的药物和免疫治疗疫苗[37]。
除治疗作用外,基于EVs的分子成像修饰技术也被用于监测和评估EVs在体内的生物分布,包括生物发光、荧光标记、放射性粒子及磁共振成像技术等[40],使肿瘤在体内全程可视化。
3.3EVs应用技术现况 尽管理论依据充分,但由于EVs具有纳米级体积、群体异质性大等固有属性,研究技术、模型尚存在不足,基于EVs的RCC治疗从实验室研究到临床应用转化之间尚存在较大差距,大规模生产及分离纯化EVs、适当的储存条件、鉴定最佳疗效和运输效率、安全性、减少脱靶效应及提高EVs肿瘤靶向性和药物负载效率等问题尤待解决[26]。
笔者着重讨论 EVs的分离纯化技术,高回收率和高纯度分离是基础实验和下游应用的先决条件。目前常规用于分离EVs的方法,主要是基于沉降系数、尺寸大小、免疫亲和捕获和化学沉淀等原理。国际囊泡协会推荐差速离心法进行EVs的分离,产物纯度高,但对设备要求高,回收率低、耗时长、操作繁琐,且高速离心可能损害EVs结构及内容物完整性,影响后续实验[41];尺寸排除色谱法根据不同粒径的分子在色谱固定相中不同的保留时间而分离富集EVs,该方法操作相对简易且成本较低,但纯度较低;免疫亲和捕获主要是利用EVs表面特异性标志物与对应抗体结合,进而分离捕获目标。此法产物纯度很高,但特异性抗体成本较高,不利于临床大规模检测;基于聚乙二醇竞争性结合的聚合物沉淀法被广泛应用于商品化试剂盒的开发,具有快速简单、设备要求低等优点,但产物特异性差,很难排除复杂体液中密度、大小相似的杂质蛋白的干扰[42]。近年来,集EVs 的分离、表征和检测于一体的微流控分离平台已成为发展的主流趋势,此方法产率及自动化程度高,但技术尚未成熟[43]。
现阶段研究分离EVs方法的选择主要依据下游应用,其纯度不可避免受其他颗粒的影响,不同亚型EVs独特的表达模式被平均化。随着研究技术的进步,针对肾细胞癌来源的单一亚型,尤其是单个EV的蛋白质组、基因组及代谢组等多组学特征进行分析[36],更有利于理解EVs的生物学特性及功能。
4 总结与展望
综上所述,针对肿瘤来源的EVs内容物相较于传统的循环肿瘤标志物,可更加直接、准确反映病变部位的病理状况,在RCC的诊断分期、转移监测、耐药及预后的评估方面具有广阔的应用前景。但现阶段相关研究仍有待完善,包括:(1)分离、纯化EVs方法未标准化,结果间一致性较差;(2)现有EVs作为RCC分子标志物的研究主要集中于ccRCC这一病理类型,缺乏其他病理类型的探讨,结果相对片面;(3)部分研究仅在细胞实验层面展开,缺少动物模型、临床样本的验证,实际应用价值存疑;(4)研究多为回顾性分析,入组病例数偏少,人群相对单一,缺少多中心、多种族、大数据的高质量前瞻性研究;(5)TME复杂,EVs来源不明,无法精准分离循环体液中特定细胞来源的EVs,其生物发生、细胞外空间动态、受体细胞摄取及EVs货物分子功能的传递机制有待探索。
EVs的生物发生受到细胞内调节与细胞外环境刺激的共同影响,不同亚型发生、分选、释放机制是否存在一致性和可比性尚不明确。同时,EVs与周围、细胞外基质的交互作用,如何跨越生物屏障,体内分布及代谢情况,如何避免被降解,有无细胞、器官的选择性亦有待进一步阐明;此外,EVs被受体细胞识别、摄取的分子机制、受体细胞膜的组成在EVs与细胞靶向方面的正向和负向调控;不同亚型或内化方式,内容物进入细胞后发挥的功能和最终结局是否不同[44],这些问题都是今后研究的方向。
现有的研究模型主要为体外细胞模型,忽略了EVs与周围细胞、细胞外基质的交流,未来应尝试模拟整体的3D生理背景,考虑其空间、结构安排及潜在的物理、化学等微环境参数。除此之外,更高的时间和空间分辨率的EVs可视化手段能够帮助重现体内实况,更透彻地理解RCC-TME中EVs的生物学功能,指导临床转化。
