膜芯片法快速筛查即食果蔬中常见致病微生物方法的建立及应用
2023-05-31邹雨虹杨丹妮张晓金
邹雨虹 杨丹妮 张晓金

摘 要:建立膜芯片法检测即食果蔬中的常见致病微生物,实现快速、简便、同步筛检6种细菌和病毒。利用反向斑点杂交技术将待测靶标基因中的特异性序列作为探针固定在尼龙膜上,利用多对带生物素标记的引物对待测靶标基因进行扩增,并通过酶-底物显色,产生肉眼可辨的信号。单次反应即可得出多种指标结果,同时结合多重PCR技术以双重反应体系来确保检测结果的准确性。结果表明,该方法具備特异性强及灵敏度高的优势,且检测结果准确,为食品中致病微生物的快速检测提供了新思路。
关键词:即食果蔬;致病微生物;快速检测;膜芯片
Abstract: Establish a membrane chip method to detect common pathogenic microorganisms in ready-to-eat fruits and vegetables, achieving rapid, simple, and synchronous screening of six bacteria and viruses. Using the reverse dot blot technique, the specific sequence of the target gene was fixed on the nylon membrane as a probe. At the same time, multiple pairs of biotin-labeled primers were used to amplify the target gene. Through enzyme-substrate color development, visible signals were generated. Combined with multiple PCR technology, the dual reaction system ensures the accuracy of test results, and a single reaction can simultaneously screen multiple indicators.:The results show that this method has the advantages of strong specificity and high sensitivity, and the detection results are accurate, which provides a new idea for the rapid detection of pathogenic microorganisms in food.
Keywords: ready-to-eat fruits and vegetables; pathogenic microorganism; rapid detection; membrane chip
水果和蔬菜富含各类营养物质,有益于预防慢性疾病以及提高免疫力[1]。即食果蔬是指以新鲜水果和蔬菜为主要原料,经过加工处理后,通过冷藏或低温运输并进入冷柜销售的即食或即用的果蔬制
品[2-3]。即食果蔬在流入市场前一般没有经过高温加工等灭菌步骤,人们可以直接鲜切、凉拌食用,容易出现交叉污染继而引发食源性疾病[4],危害到人们的健康。其中,大肠埃希氏菌、单增李斯特菌、沙门氏菌、金黄色葡萄球菌等致病微生物均在黄瓜、莴笋、苦苣、番茄、菠菜、瓜类、苹果和梨等即食果蔬中检出[5-6]。
目前针对即食果蔬中致病菌检测的方法主要有传统分离培养及生化鉴定、酶联免疫吸附、聚合酶链式反应(主要为荧光定量PCR法)、基因芯片法等[7],常规的分离培养基及生化鉴定检测方法仍是我国食品中常见致病菌检测的主要方式[8]。但此方法耗时长且步骤烦琐,一般需要5~7 d得出结果。考虑到果蔬保质期极短的特殊性,检测周期过长会严重影响果蔬产品的快速流通,很大程度上加重了即食果蔬生产企业在储藏及质量管理上的负担。
近年来出现的PCR技术逐渐被应用在食品中致病微生物的检测中,该技术缩短了检测时间,提高了检测灵敏度及检测效率[9],但无法利用一次实验操作同时对多种致病菌进行检测,对于目前生鲜果蔬流通不畅的问题仍无法提供解决思路。因此,利用膜芯片检测工作平台开发一种针对多种致病菌同步快速检测的方法,对于即食果蔬行业的发展具有重要的现实意义。
膜芯片技术基于反向斑点杂交原理开发,利用反向斑点杂交技术(Reverse Dot Blot,RDB)将待测基因中的特异性序列作为探针固定在尼龙膜上,并采用生物素标记的引物进行基因的扩增,同时将扩增产物与固定在尼龙膜上的探针进行杂交,经化学显色后可在杂交点上形成肉眼可见的信号,单次反应即可同时筛查多种靶标[10]。该方法的特别之处在于将多重PCR技术与反向斑点杂交(RDB)技术相结合形成检测体系,可以同时提取细菌和病毒中的DNA和RNA,同步扩增特异性基因片段,在膜芯片上形成肉眼可见的检测靶点,从而实现所有靶标的共同检测。本文主要针对的即食果蔬中金黄色葡萄球菌、单核细胞增生李斯特氏菌、大肠埃希氏菌O157、沙门氏菌、诺如病毒和轮状病毒这6种常见致病菌进行研究。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 样品来源
本实验所用的样本(即食生菜、即食黄瓜、鲜切牛油果、鲜切火龙果、苹果、胡萝卜、金橘、苦苣、鲜切菠萝和鲜切羊角蜜)购自各市场中。
1.1.2 标准菌株
细菌采用实验保存的阳性菌株:沙门氏菌(CICC号21513)、大肠埃希氏菌O157:H7(CICC号21530)、金黄色葡萄球菌(CICC号10384)、单核细胞增生李斯特氏菌(CICC号21633),在实验室进行菌株复苏备用。病毒样本采用购买标准质控品的形式进行。
1.1.3 仪器与试剂
MFS-24基因膜芯片检测工作站(四川华汉三创生物科技有限公司);Fresco17高速冷冻离心机(赛默飞世尔科技有限公司);膜芯片检测试剂盒(货号:HT114B,四川华汉三创生物科技有限公司);细菌DNA提取试剂盒(货号:DP302,天根生化科技有限公司);病毒DNA/RNA提取试剂盒(货号:DP315,天根生化科技有限公司)
1.2 实验方法
1.2.1 引物及探针设计
通过查看文献并结合实际结果,最终选取以下基因序列。引物和探针的设计由Primer Premier 5.0软件完成,具体对应的特异性基因详细信息见表1。
1.2.2 样本前处理
样本的前处理阶段选用致病菌共增菌培养基,将待测样品与6种阳性标准菌株进行前增菌。取共增菌培养基干粉5.96 g,加入蒸馏水至完全溶解,调节pH值至7.2±0.2并定容到100 mL,将灭菌锅条件设置为121 ℃、20 min,灭菌后冷却备用。无菌称取10 g待检样品,加入至100 mL的增菌培养基中,设置恒温振荡培养箱参数为35 ℃和150 r·min-1,过夜培养。最后从共增菌液中取1~5 mL,提取DNA后进行PCR反应。
1.2.3 样品核酸制备
采用多重PCR技术扩增待检靶标,以高纯度的基因组DNA为模板,核酸样品纯度A260/A280在1.8~2.0可保证多重PCR反应的扩增效率;DNA样品模板加入量≥200 ng以保证检测效果。使用细菌DNA提取试剂盒或病毒基因组DNA/RNA提取试剂盒分别进行提取。
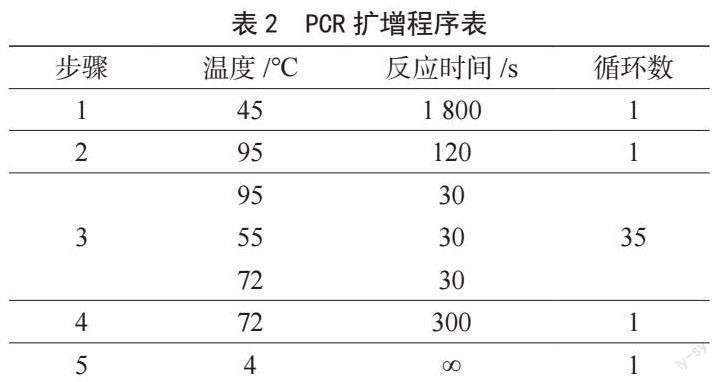
1.2.4 多重PCR扩增
(1)样本核酸扩增PCR反应体系为2×Multiplex PCR Master Mix 10 μL,OneStep EnzymeMix 0.45 μL,Hela cell total RNA 1 μL,样品DNA 20~400 ng,最后用无核酸酶灭菌水补足20 μL。
(2)PCR扩增程序、温度及反应时间如表2所示。
1.2.5 膜芯片杂交
产物变性阶段:将上述实验产物在95 ℃变性5 min使其解链后立即置于冰上备用;杂交仪设置:杂交仪在开机前检查瓶中的蒸馏水水位达到水位线,打开基因膜芯片检测工作站的电源和开关,观察废液瓶是否空置,随后打开软件,等待工作站显示自检成功后,点击确定按钮;使用耗材和试剂的准备工作:使用前分别检查试剂瓶BCDE中的液体,如果存在结晶,则置于36 ℃水浴锅中溶解至结晶消失后使用;将杂交试剂进行分装,准备相应数量的杂交管并将200 μL B液加入至每个杂交管中;芯片和样品的加载:将准备好的C~J试剂瓶开盖,取已加入样品的杂交管及膜芯片放入工作站指定位置并确保一一对应,随后关闭试剂盘和反应盘的盖板及仪器仓门,并再次检查芯片与杂交管是否放置正确;运行程序:加载“基因膜芯片检测工作站标准杂交流程”,根据检测样品放置的位置选中相应的按钮,点击“运行”开始实验。
1.2.6 结果判读
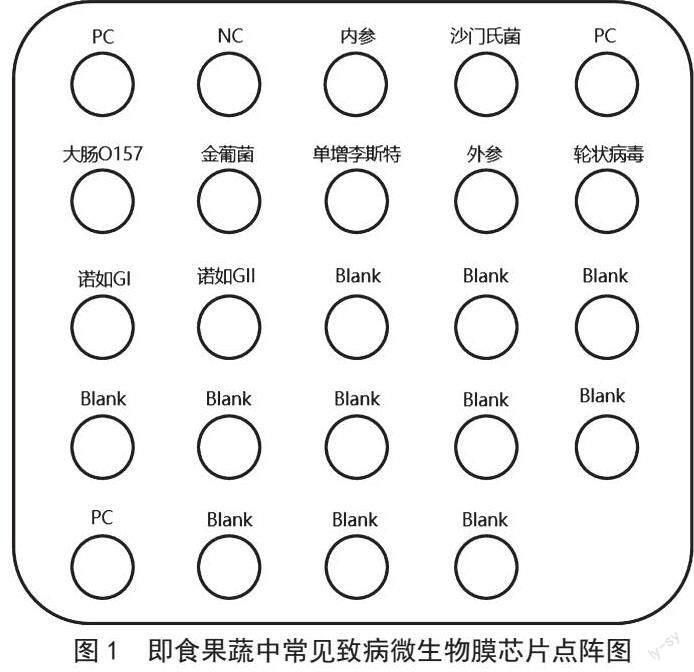
实验结果有效的前提是膜芯片上PC点显色,NC点不显色。反应结果可用肉眼进行判读,也可参照膜芯片核酸分子杂交仪成像分析系统得出的结果。膜芯片点阵图及多重PCR阳性质控反应结果如图1和图2所示。
2 市售样本检测结果与分析
对市场中购买的10个即食果蔬样本,提取其核酸,采用建立的膜芯片法进行检测鉴定,结果芯片图如图3所示,灰色点表示该点位阳性,无圆点则表示该点位阴性,同时还应结合膜芯片点阵图的基因序列进行肉眼判读。
在3份样本(即食生菜、即食黄瓜、金橘)中检出了金黄色葡萄球菌,而单核细胞增生李斯特氏菌、大肠埃希氏菌O157、沙门氏菌及诺如病毒、轮状病毒未检出;另外7份样本均未检出此6种致病微生物。结果表明,市场中售卖的即食果蔬存在被致病微生物感染的风险,通过建立的膜芯片法能够达到多种致病菌的同步检测。
3 讨论
本项目将多重PCR技术与反向斑点杂交(RDB)技术相结合形成检测体系,同时提取6种致病微生物提取的DNA和RNA,并同步擴增特异性基因片段,在膜芯片上显示直观的检测靶点,从而实现对多种致病菌的同步检测。本文建立的多重反应体系中,利用特异性引物,可以在一次PCR反应体系中同时鉴别出金黄色葡萄球菌、沙门氏菌、大肠埃希氏菌O157、单核细胞增生李斯特氏菌,以及诺如病毒、轮状病毒这6种致病菌,并且在48 h内能得出准确结果。此方法快捷便利,检测条件限制不多,能满足PCR实验环境的实验室均可进行检测,并可实现一次操作同步检测多种致病微生物,大大提高了检测效率。
膜芯片法作为一种具备优势的检测新方法,应用于食品的致病菌快速筛查中,可以提供更为快速且准确的实验结果,且无需耗费大量人力资源。此方法有效解决了传统分离培养基法耗时过长的问题,有利于保障即食果蔬产品的顺畅流通;有利于其他食品企业有效控制微生物污染风险,防止食源性疾病造成食品安全问题;有利于食品安全监管抽检工作高效地进行,为食品安全监管工作提供了强有力的技术支撑。随着基因膜芯片研究的不断深入,相信膜芯片技术也会不断发展,在食品致病性微生物的检测中能得到更加广泛的应用。
参考文献
[1]肖兴宁,王珍,蔡铮,等.浙江省即食生鲜果蔬病原微生物污染调查分析[J].浙江农业科学,2020,61(3):528-530.
[2]张慜,马良.对我国鲜切果蔬微加工行业及安全性的思考[J].江南大学学报(人文社会科学版),2016,15(5):110-114.
[3]华雪兰.鲜切果蔬加工工艺与保鲜技术分析[J].农业开发与装备,2022(9):210-212.
[4]李晓凤,秦宇龙,刘姜汝,等.即食果蔬中食源性致病菌风险评估的研究进展[J].食品与发酵工业,2022,48(18):322-328.
[5]VANDAMM J P,LI D,HARRIS L J,et al.Fate of Escherichia coli O157:H7, Listeria monocytogenes, and Salmonella on fresh-cut celery[J].Food Microbiol,2013,34(1):151-157.
[6]秦晓杰,李嘉铭,孙天妹,等.2021年上海市部分即食果蔬中食源性致病菌暴露风险监测[J/OL].上海预防医学:1-7[2023-01-10].http://kns.cnki.net/kcms/detail/31.1635.R.20221119.1525.002.html.
[7]武侠均.食品与饲料中致病微生物检测技术及展望[J].中国饲料,2022(21):109-117.
[8]WAN J J,LU Z X,BIE X M,et al.Improvement of a new selective enrichment broth for culturing Salmonella in ready-to-eat fruits and vegetables[J].Journal of Food Safety,2020,40(5):e12817.
[9]WAN J J,ZHENG L P,KONG L Y,et al.Development of a rapid detection method for real-time fluorescent quantitative PCR of Salmonella spp. and Salmonella Enteritidis in ready-to-eat fruits and vegetables[J].LWT,2021,149:111837.
[10]任易婕,霍胜楠,翟清燕,等.膜芯片技术对牛、羊、牦牛、驴肉源食品的掺伪鉴别[J].肉类研究,2019,33(6):33-38.
