低强度脉冲超声增效脂肪间充质干细胞源性外泌体修复糖尿病小鼠皮肤创面的实验研究
2023-05-31钟方璐刘珺碧蒋日月
钟方璐 刘珺碧 蒋日月 桂 斌 王 浩 姜 楠 曹 省 周 青 邓 倾
材料与方法
一、实验动物、主要实验材料及仪器
1.实验动物:SPF 级C57BL/6 雄性小鼠36 只,4 周龄,体质量12.0~17.0 g,平均(15.0±0.5)g;雄性SD 大鼠5 只,4 周龄,体质量80.0~130.0 g,平均(110.0±3.0)g。以上动物均由武汉大学人民医院动物实验中心提供,本实验经我院实验动物伦理委员会批准[WDRM 动(福)第20210506号]。
2.主要实验材料:CD9、Tsg101、GAPDH、Calnexin单克隆抗体(美国Proteintech 公司);链脲佐菌素(德国Sigma-Aldrich 公司);异氟烷(深圳市瑞沃德生命科技有限公司;TBST 缓冲液(10X,pH 值7.4,北京兰杰柯科技有限公司);DiI 及DiR 荧光标记试剂盒(美国Invitrogen 公司);抗荧光淬灭封片剂(含DAPI)、HE 及Masson 染色试剂盒(上海碧云天生物技术有限公司);人脐静脉内皮细胞(HUVECs,武汉普诺赛生命科技有限公司);澳大利亚胎牛血清、低糖培养基DMEM(美国Hyclone 公司);透明防水敷料(美国3M 公司);小鼠CD31、α-SMA 抗体试剂盒、4%多聚甲醛组织固定液(武汉塞维尔生物科技有限公司)。
3.主要实验仪器:正置荧光显微镜(BX53,日本Olympus 公司);激光共聚焦显微镜(FV1200,日本Olympus 公司);小动物成像系统(IVIS,美国Perkin Elmer 公司);多通道超声辐照仪(重庆医科大学超声影像学研究所);纳米颗粒跟踪分析仪(ZetaView 30,德国Particle Metrix 公司);透射电子显微镜(HT7700,日本HITACHI 公司);动物血糖仪(VQpetTMH,杭州微策生物技术股份有限公司)。
二、实验方法
(一)ADSCs-Exos的提取及鉴定
从雄性SD 大鼠双侧腹股沟脂肪中提取脂肪间充质干细胞(adipose mesenchymal stem cells,ADSCs),传代培养后通过形态学及流式细胞术鉴定ADSCs。采用超速离心法从ADSCs 培养液中提取ADSCs-Exos,透射电子显微镜下观察其形态;纳米颗粒跟踪分析仪检测其粒径;Western Blot检测外泌体标志蛋白CD9和Tsg101的表达[5]。
(二)体外实验检测HUVECs摄取ADSCs-Exos情况
采用含10%胎牛血清的低糖DMEM 培养液在37℃、5%CO2条件下培养HUVECs,待细胞形态饱满后以每孔30 000个细胞铺入24 孔板,过夜待细胞贴壁延展后将其分为Exos 组和LIPUS+Exos 组,每组12 个复孔。预先采用红色荧光染料DiI 对ADSCs-Exos 进行染色,将DiI 标记的ADSCs-Exos 加入24 孔板与HUVECs 共同孵育,其中LIPUS+Exos 组先在无菌条件下LIPUS 辐照30 min再共同孵育,辐照参数:工作频率1.5 MHz,调制频率1.0 kHz,占空比20%,声强0.03 W/cm²。共同孵育6 h后去掉培养液并使用PBS多次冲洗,加入4%多聚甲醛固定15 min,再次使用PBS冲洗后滴加抗荧光淬灭封片剂(含DAPI),激光共聚焦显微镜下观察LIPUS+Exos 组和Exos 组荧光标记情况,分析LIPUS 对HUVECs摄取ADSCs-Exos的影响。
对136例观察目标实施单排螺旋CT检查,以CT/e扫描机(美国GE)为检查仪器,协助患者保持仰卧位,告知其将双下肢屈曲,扫描模式为轴位扫描,设置参数:层间距、层厚、螺旋因子、扫描间隔时间、管电流、管电压分别为 3mm、3mm、0.75、1.5s、300mA、120kV。对患者L3~S1椎间盘(常规平扫)、L5~S1、L4~5、L3~4(均为轴扫描)实施扫描,并注意勿漏掉邻近椎体上下缘位置。由年资长且经验丰富的1名诊断医师执行阅片,确定疾病类型与程度。
(三)糖尿病小鼠皮肤创面模型构建及分组
所有C57BL/6 雄性小鼠均进行高脂肪饲料喂养2 周,然后腹腔注射链脲佐菌素(50 mg/kg),每2 日采集小鼠血液样本,使用动物血糖仪测量血糖水平,小鼠血糖水平>16.7 mmol/L 且持续1 周以上即糖尿病模型构建成功[6]。使用异氟烷麻醉小鼠后,除净小鼠背部毛发,无菌条件下剪出直径约10 mm 的圆形全层真皮缺损,构建糖尿病小鼠皮肤创面模型。将其随机分为对照组、Exos 治疗组及LIPUS+Exos 治疗组,每组各12 只。对照组于小鼠伤口周围进行多点皮下注射总体积为100 μl PBS;Exos 治疗组和LIPUS+Exos 治疗组则注射含70 μg ADSCs-Exos(经DiI 标记)的PBS 混悬液100 μl,注射后立即使用透明防水敷料封闭伤口;LIPUS+Exos治疗组小鼠封闭伤口后立即行LIPUS辐照30 min,辐照参数:工作频率1.5 MHz,调制频率1.0 kHz,占空比20%,声强0.3 W/cm²。操作完成后将小鼠饲养于SPF级屏障环境中备用。
(四)活体成像观察ADSCs-Exos的分布及作用时间
将Exos 治疗组和LIPUS+Exos 治疗组小鼠于异氟烷麻醉下进行活体成像,观察ADSCs-Exos治疗后1 h、6 h、36 h 创面区域经DiR 标记的ADSCs-Exos 的分布情况,使用仪器配套软件(Living Image 4.0)分析其荧光强度。
(五)冰冻切片观察ADSCs-Exos 在糖尿病小鼠皮肤组织中的分布
ADSCs-Exos 治疗后48 h将Exos治疗组及LIPUS+Exos 治疗组小鼠伤口及周围皮肤组织制作冰冻切片,激光共聚焦显微镜下观察经DiI 标记的ADSCs-Exos的分布,并使用ImageJ软件自动计算其阳性细胞率。
(六)各组小鼠皮肤创面治疗效果评估
1.观察各组小鼠皮肤创面修复情况:分别于治疗后0 d、3 d、7 d、10 d、14 d 肉眼观察小鼠创面区域情况并拍照,并计算创面闭合率,公式为:创面闭合率=(0 d创面面积-实时创面面积)/0 d创面面积×100%。
2.各组小鼠皮肤创面组织学检测:于治疗后14 d将各组小鼠脱毛处理,在其背部以瘢痕部位为中心剪出面积约1 cm2的正方形全层皮肤组织,生理盐水漂洗后立即放入4%多聚甲醛组织固定液中进行固定,将固定好的样品进行脱水处理,石蜡包埋切片后进行HE 染色和Masson 染色,正置荧光显微镜下观察各组胶原成熟度,并测量瘢痕长度;使用ImageJ 软件自动计算胶原容积分数。同时对切片进行免疫荧光染色处理,将切片封闭后加入一抗稀释液4℃孵育过夜,复温后用TBST 缓冲液洗涤,放入二抗稀释液中避光室温孵育1 h,再次TBST缓冲液洗涤,滴加抗荧光淬灭封片剂(含DAPI),正置荧光显微镜下观察血管内皮细胞CD31 及平滑肌肌动蛋白α-SMA 的表达情况,使用ImageJ软件自动计算新生血管面积。
三、统计学处理
结 果
一、ADSCs-Exos的鉴定
透射电子显微镜显示,ADSCs-Exos呈双层膜结构的茶托样囊泡;Western Blot 检测ADSCs-Exos 可表达CD9、Tsg101。见图1。纳米颗粒跟踪分析仪检测其平均粒径为(133.0±11.0)nm。
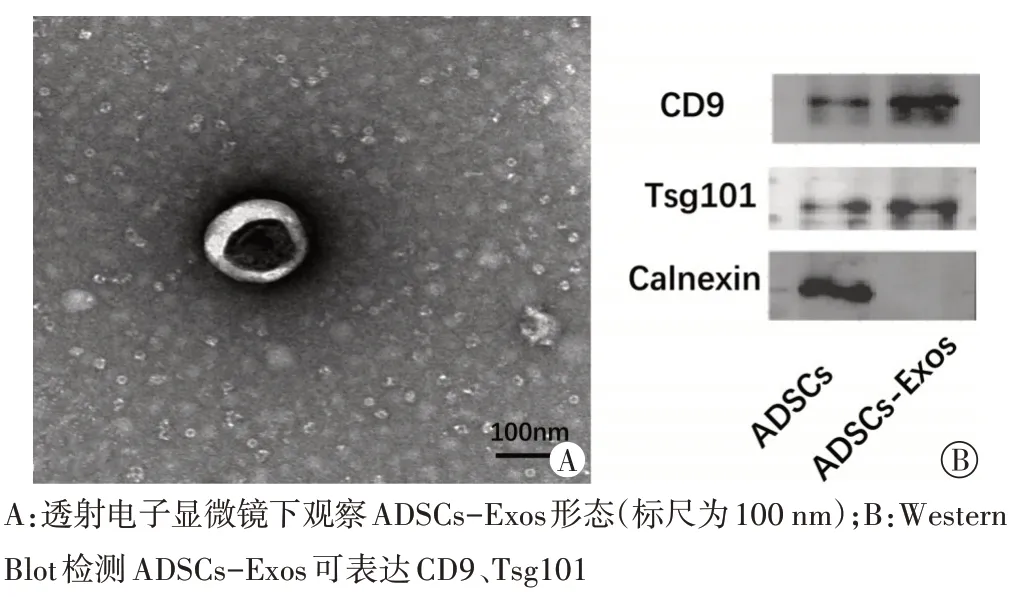
图1 ADSCs-Exos形态及标志蛋白表达检测
二、LIPUS对HUVECs摄取ADSCs-Exos的影响
LIPUS+Exos 组HUVECs 摄 取 的 经DiI 标 记 的ADSCs-Exos荧光强度为2.98×105,较Exos组(0.31×105)显著增加,差异有统计学意义(P<0.01)。见图2。

图2 激光共聚焦显微镜下观察HUVECs 摄取ADSCs-Exos 情况(标尺为50 μm)
三、活体成像观察ADSCs-Exos的分布及作用时间
LIPUS 辐照能有效改善皮下注射后ADSCs-Exos的分布,促进其聚集于创面及周围组织,延长外泌体的作用时间;LIPUS+Exos治疗组治疗后1 h、6 h、36 h创面区域ADSCs-Exos 的荧光强度分别为24.14×109、146.93×109、26.59×109,均高于Exos 治疗组(15.23×109、52.38×109、10.72×109),差异均有统计学意义(均P<0.05)。见图3。
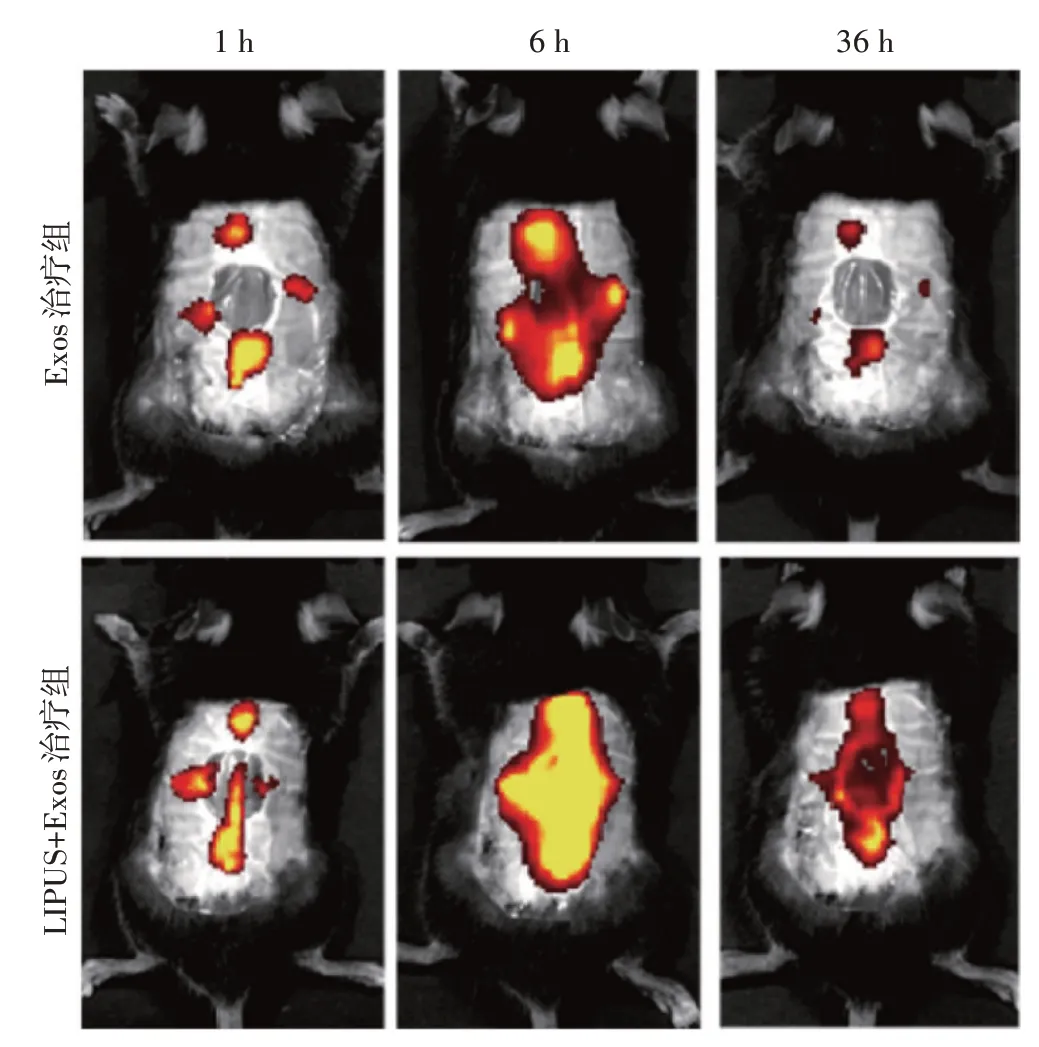
图3 活体成像观察两治疗组小鼠皮肤创面摄取ADSCs-Exos情况
四、冰冻切片观察ADSCs-Exos在糖尿病小鼠皮肤组织中的分布情况
LIPUS辐照后可明显促进创面及周围组织细胞摄取ADSCs-Exos,其中LIPUS+Exos 治疗组ADSCs-Exos 阳性细胞率为(41.20±1.10)%,明显高于Exos 治疗组[(23.16±1.16)%],差异有统计学意义(P<0.01)。
五、各组小鼠皮肤创面治疗效果
1.各组小鼠皮肤创面修复情况:LIPUS+Exos 治疗组小鼠治疗后3 d、7 d、10 d、14 d 创面闭合率均高于其余两组,差异均有统计学意义(均P<0.05);14 d时各组小鼠创面闭合率均>80%,其中LIPUS+Exos 治疗组最高,达[(98.52±1.14)%],创面几乎完全被表皮所覆盖。见表1和图4A。
表1 各组小鼠治疗后3 d、7 d、10 d、14 d创面闭合率比较(±s) %
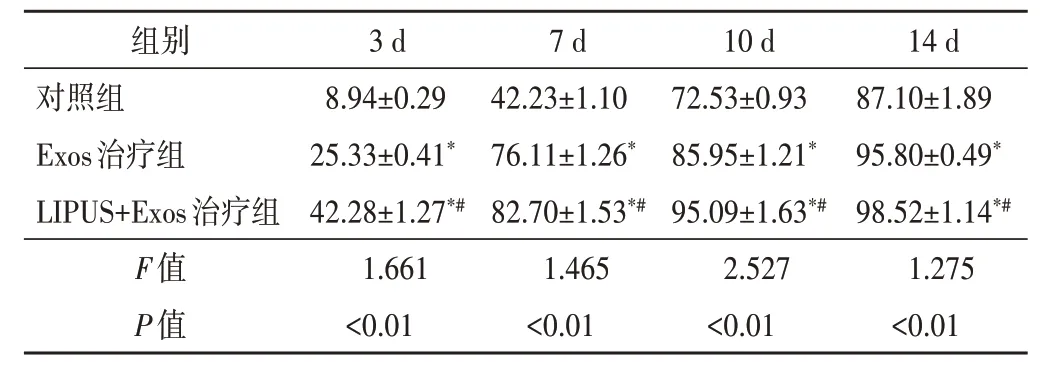
表1 各组小鼠治疗后3 d、7 d、10 d、14 d创面闭合率比较(±s) %
与对照组比较,*P<0.05;与Exos治疗组比较,#P<0.05
组别对照组Exos治疗组LIPUS+Exos治疗组F值P值3 d 8.94±0.29 25.33±0.41*42.28±1.27*#1.661<0.01 7 d 42.23±1.10 76.11±1.26*82.70±1.53*#1.465<0.01 10 d 72.53±0.93 85.95±1.21*95.09±1.63*#2.527<0.01 14 d 87.10±1.89 95.80±0.49*98.52±1.14*#1.275<0.01

图4 各组小鼠皮肤创面修复情况
2.各组小鼠皮肤创面组织学检测情况:①HE 染色显示各组小鼠皮肤创面瘢痕组织情况见图4B;LIPUS+Exos 治疗组瘢痕长度明显短于Exos 治疗组和对照组,差异均有统计学意义(均P<0.05),且其新生组织最接近正常皮肤;②Masson 染色显示,LIPUS+Exos 治疗组胶原纤维粗大,排布较规则;各组胶原容积分数比较差异有统计学意义(P<0.001);③LIPUS+Exos 治疗组新生血管面积显著高于对照组和Exos 治疗组,差异均有统计学意义(均P<0.05)。见表2。正置荧光显微镜下观见图5。
表2 各组小鼠皮肤创面组织学检测情况(±s)

表2 各组小鼠皮肤创面组织学检测情况(±s)
与对照组比较,*P<0.05,**P<0.01;与Exos 治疗组比较,#P<0.05,##P<0.01
组别对照组Exos治疗组LIPUS+Exos治疗组F值P值瘢痕长度(mm)6.11±0.47 2.53±0.32**1.20±0.20**##0.337<0.001胶原容积分数(%)20.33±1.28 43.93±1.43*62.35±1.72*#1.923<0.001新生血管面积(mm2)9.41±0.98 20.25±1.44*35.12±1.93*#0.961<0.001
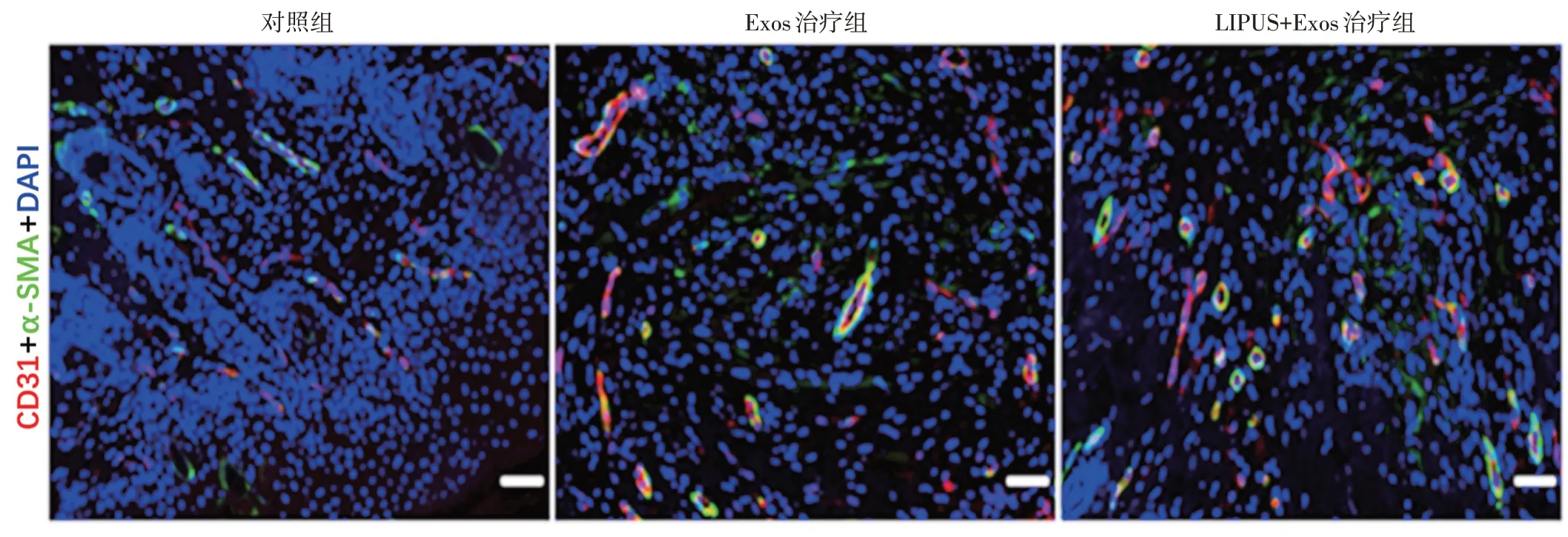
图5 正置荧光显微镜下观察各组小鼠皮肤创面区域血管新生情况(标尺为200 μm)
讨 论
糖尿病皮肤溃疡创面是糖尿病严重的并发症之一。血管新生障碍是糖尿病患者创面迁延不愈的重要原因[7]。目前已知的治疗方法包括各种敷料、高压氧、组织工程皮肤替代品和生长因子等,均被用于促进糖尿病创面的血管新生,然而治疗效果并不理想。研究[8-9]证实ADSCs-Exos具有与干细胞相似的治疗功效,能够促进血管新生,抑制局部的慢性炎症反应,加速皮肤创面的修复,且不存在干细胞植入机体后存活率较低及免疫排斥反应等问题,在糖尿病皮肤创面治疗中具有很好的应用前景。尽管外泌体具有很好的治疗潜力,但是其提取过程繁琐,产量低,体内半衰期较短、生物利用率低,导致其治疗成本较高,从而限制了其在临床上的应用。在干细胞外泌体产量无法显著提升的情况下,尽量提高其生物利用率是目前亟需解决的问题。LIPUS 是一种强度远低于传统超声(<3 W/cm2)的温和物理能量,可对细胞提供非侵入性的局部机械刺激,具有多种治疗效应[10]。目前,LIPUS 已应用于骨折、软骨及肌腱组织再生、神经系统疾病等的临床治疗且疗效尚佳[11]。然而其能否促进靶组织对干细胞外泌体的内吞,从而提高外泌体在体内的生物利用率,进而增强干细胞外泌体的治疗效果目前尚不清楚。因此,本实验通过体外细胞实验和动物实验两方面探讨LIPUS 对干细胞外泌体内吞的影响,以及促进外泌体内吞对修复糖尿病小鼠皮肤创面的增效作用。
本实验经体外细胞实验结果显示,声强0.03 W/cm²的LIPUS 辐照30 min,可显著增加HUVECs 对ADSCs-Exos 的摄取,获得更多的生物活性成分。前期实验[5]也证实外泌体联合LIPUS 辐照可促使HUVECs 的增殖、迁移和小管形成能力提高,表明LIPUS辐照可提高外泌体的体外生物利用率,促进血管生成。随后进行的动物实验中,活体成像结果显示,LIPUS+Exos治疗组治疗后1 h、6 h、36 h创面区域ADSCs-Exos的荧光强度均高于Exos治疗组,差异均有统计学意义(均P<0.05)。表明声强0.3 W/cm²的LIPUS辐照能显著促进外泌体向损伤部位的扩散,增加创面周围细胞对外泌体的摄取,降低体内的代谢清除率,延长外泌体的作用时间,提高其生物利用率。冰冻切片也显示,LIPUS+Exos 治疗组创面及周围组织ADSCs-Exos阳性细胞率[(41.20±1.10)%]明显高于Exos 治疗组[(23.16±1.16)%],差异有统计学意义(P<0.01),从微观角度提示LIPUS 辐照可提高外泌体的生物利用率。本实验各组小鼠皮肤创面修复情况显示,LIPUS+Exos 治疗组小鼠治疗后3 d、7 d、10 d、14 d 创面闭合率均高于其余两组,差异均有统计学意义(均P<0.05);14 d 时各组小鼠创面闭合率均>80%,以LIPUS+Exos 治疗组最高,达(98.52±1.14)%,创面几乎完全被表皮所覆盖。表明LIPUS 联合外泌体治疗可有效促进组织的再生修复,从而加速小鼠皮肤创面的闭合。本实验正置荧光显微镜显示,LIPUS+Exos 治疗组新生血管面积显著大于对照组和Exos 治疗组,差异均有统计学意义(均P<0.05)。表明LIPUS 联合外泌体可使新生组织的血管生成明显增多,提高供血以利于创面的再上皮化。本实验HE 染色及Masson染色显示,LIPUS+Exos治疗组瘢痕长度明显短于Exos 治疗组和对照组,差异均有统计学意义(均P<0.05);LIPUS+Exos 治疗组胶原纤维粗大,排布较规则,各组胶原容积分数比较差异有统计学意义(P<0.001)。提示LIPUS 联合外泌体可使新生组织得到更好的重塑。由此可见,LIPUS 辐照能显著增加机体细胞和组织对ADSCs-Exos 的摄取,提高外泌体的生物利用率,放大外泌体的生物效应,促进血管新生,从而加速糖尿病皮肤创面的修复。
LIPUS 增强靶细胞对ADSCs-Exos 摄取的机制可能与以下原因有关:①LIPUS 辐照在靶区产生稳定的空化效应,使微气泡作为液体环境中的气核不断膨胀和收缩,从而形成微流[12]。一方面,微流可以使外泌体向不同方向扩散,扩大其在创面区域的分布。本实验中,LIPUS+Exos 治疗组LIPUS 辐照后,ADSCs-Exos向不同方向扩散,进而覆盖整个创面,而Exos 治疗组和对照组中,荧光主要局限于注射部位;另一方面,稳定的空化效应可以促进外泌体与靶细胞的接触,增加细胞膜的通透性,从而显著改善靶细胞的内吞作用。快速的扩散和内吞作用显著增加了外泌体的摄取,降低了机体代谢清除,从而提高了外泌体的生物利用率。本实验中,活体成像显示LIPUS 辐照后36 h,LIPUS+Exos 治疗组仍能观察到大量覆盖创面的荧光,而Exos治疗组仅能观察到微弱的点状荧光。②LIPUS是一种非侵入性的局部机械刺激,具有多种治疗性生物物理效应,虽然LIPUS作用的分子机制尚未明确,但越来越多的证据表明,LIPUS“按摩”细胞,并可以通过能量传递激活多种信号通路[13]。由于LIPUS可以激活细胞信号通路,而外泌体是细胞间通讯的重要分子,因此LIPUS也可能通过细胞通讯的作用促进外泌体的摄取,甚至二者产生协同效应,增强细胞间通讯,更好地发挥生物功能。这种可能的协同作用有待今后研究的进一步探讨。
综上所述,LIPUS 辐照能有效促进细胞对ADSCs-Exos 的摄取,提高其生物利用率,增强血管新生,加速糖尿病小鼠皮肤创面的修复;二者的联合效应有助于增强干细胞外泌体治疗的疗效并降低干细胞外泌体治疗的成本,具有较好的临床应用前景。
