温法干预对HBV相关慢加急性肝衰竭阳黄证患者外周血树突细胞功能的影响*
2023-05-31孙克伟
马 远 唐 丹 孙克伟
湖南中医药大学第一附属医院肝病科 (湖南 长沙, 410208)
慢加急性肝衰竭(ACLF)是在慢性肝病基础上发生的、以急剧肝功能失代偿、器官功能衰竭和高短期死亡率为特征的临床症候群[1]。HBV相关ACLF(HBV-ACLF)是我国肝衰竭最常见的类型,占所有肝衰竭的80%以上[2]。肝移植被认为是目前最有效的治疗手段,但肝源紧张,治疗费用高昂,无法有效地开展应用[3]。HBV-ACLF发病机制复杂,多数学者认为免疫损伤和炎症反应在其发病过程中发挥关键作用。树突状细胞(DC)是连接固有免疫和适应性免疫的桥梁,是唯一能激活初始T淋巴细胞的抗原提呈细胞,在机体的免疫应答中发挥重要作用。以DCs-T淋巴细胞轴为中心的细胞免疫功能低下是 HBV持续感染、引发肝炎重症化的重要原因[4]。
中医药治疗HBV-ACLF多从黄疸辨证,传统观点认为阳黄证禁用温法。课题组前期研究发现HBV-ACLF患者多有肝硬化的基础、病程长、苦寒药应用多,从病机到临床均有脾虚表现,因此提出ACLF阴黄化的倾向和早期温法干预理论[5,6]。温阳解毒化瘀方是我院协定处方,治疗肝衰竭疗效确切[7,8]。本研究拟运用HBV-ACLF阳黄证患者DCs体外培养的细胞模型和中药血清药理实验方法,比较温法(温阳解毒化瘀)方含药血清和去温法(温阳解毒化瘀减白术、附片方)含药血清对HBV-ACLF阳黄证患者DCs功能的影响,为温法早期临床应用提供实验依据。
1 材料与方法
1.1 动物 SPF级SD大鼠42只,雌雄各半,8~9周龄,体质量180~200 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004,饲养于湖南中医药大学动物实验中心。动物实验设计严格经过湖南中医药大学伦理委员会审查,动物伦理审批编号LLBH-202010220001。
1.2 药物与试剂 中药饮片茵陈、丹参、赤芍、薏苡仁、附片、白术购自湖南中医药大学第一附属医院,由邓桂明副主任药师鉴定符合2020年版《中华人民共和国药典》要求。胎牛血清(FBS,美国Gibco公司),RPMI 1640培养基(美国Gibco公司),人外周血淋巴细胞分离液(天津灏洋公司),CD14磁珠(德国Miltenyi Biotec公司),人粒细胞-巨噬细胞集落刺激因子(hGM-CSF)、人白细胞介素(hIL-4)(美国Pepro Tech公司),CD11C、HLA-DR、CD80、CD83、CD86抗体(美国BD公司),聚肌苷酸-聚胞苷酸(Poly(I∶C)(美国sigma公司),丝裂霉素C(Biovision公司),人IL-12、IL-6、IL-10酶联免疫吸附测定法(ELISA)检测试剂盒 (上海酶联生物科技有限公司)。
1.3 仪器 生物安全柜及二氧化碳培养箱(美国Thermo Electron公司);5810R冷冻离心机(德国Eppendorf公司);XD-202型倒置生物显微镜(南京江南永新光学有限公司);全自动酶标仪(美国伯腾仪器有限公司);磁珠分选仪(德国Miltenyi Biotec公司);流式细胞仪(美国BD公司)。
1.4 方法
1.4.1 DCs细胞分离、培养及纯度鉴定 选择2020年9月至2021年5月我院住院的HBV-ACLF阳黄证患者8例,男7例,女1例,平均年龄(34.8±9.6)岁。西医诊断标准参照《肝衰竭诊治指南(2018年版)》[9]。中医诊断标准参照中华人民共和国国家诊断标准《中医临床诊疗术语》及王永炎主编《中医内科学》中有关黄疸阳黄证的中医辨证标准,阳黄证:主症:①身目俱黄,黄色鲜明;②舌质红或红绛,或兼见瘀斑瘀点,舌苔黄腻;③脉实有力或滑数。次症:①口干口苦,或见恶心呕吐;②大便秘结;③鼻齿衄血,或皮肤瘀斑;④小便短少黄赤。辨证要求为符合主证3项,或主证2项加次证2项。本研究获医院伦理委员会审批,所有患者均签署知情同意书。另选取8名健康对照者,男7例,女1例,平均年龄(32.8±8.1)岁。依照文献方法分离培养DCs,无菌采集患者及健康对照者外周血20 ml,分离后获得外周血单个核细胞(PBMC),洗涤离心后,按1×107个细胞用80 μl磁珠Buffer和20 μl CD14免疫磁珠重悬细胞,4℃孵育15 min,经磁珠分选仪分选出CD14单核细胞,按5×105/ml置于24孔板中,用含10% FBS、hGM-CSF 1 000 U/ml、hIL-4 500 U/ml的RPMI 1640完全培养基培养细胞,置于37℃,5% CO2培养箱中,隔天半量换液,并补足细胞因子(初始剂量的1/2),培养第5天加入50 μg/ml Poly(I∶C)培养48 h,获得成熟的树突细胞(mDC)。观察细胞形态变化,同时用流式管收集DCs,加入FITC-抗人CD11C、APC-Cy7-抗人HLA-DR在4℃冰箱孵育30 min,予以PBS洗涤1遍,加入100 μl PBS重悬后置于流式细胞仪上进行细胞鉴定。
1.4.2 含药血清的制备 将温阳解毒化瘀方:茵陈、丹参、白术、薏苡仁各30 g,赤芍60 g,附片10 g(温法)与温阳解毒化瘀方减附子、白术方:茵陈 、丹参 、薏苡仁各30 g,赤芍 60 g(去温法)分别加10倍量纯水浸泡30 min,加热煮沸,文火煎煮1 h,趁热滤过;再按同法再煎煮1次,合并2次滤液,并分别浓缩两方提取液。将42只SD大鼠随机分为6组:空白组,生理盐水组,温法高、低剂量组及去温法高、低剂量组,每组7只。〗根据人大鼠体表面积比值折算本次实验动物正常灌胃剂量为人体服用剂量的6.3倍,温法低剂量组大鼠给药量为17.1 g·kg-1·d-1;温法高剂量组大鼠给药量为34.2 g·Kg-1·d-1;去温法低剂量组大鼠给药量为13.5 g·kg-1·d-1,去温法高剂量组大鼠给药量为27.0 g·Kg-1·d-1;空白组大鼠不进行灌胃;生理盐水组大鼠灌胃等体积生理盐水,给药量为10 ml·kg-1,2次/d,连续5 d,末次给药1 h后,水合氯醛麻醉,腹主动脉采血,4℃ 3 000 r/min离心15 min分离血清,56℃水浴灭活30 min,0.22 μm微孔滤膜过滤除菌分装,-80℃冰箱保存备用。
1.4.3 最佳含药血清浓度的确定 收集培养成熟的DCs细胞,用完全培养基配制成单细胞悬液,以6×105/ml接种96孔培养板,每孔100 μl,细胞贴壁过夜后,将原培养基吸出,加入5%、10%、20%含药血清及空白血清,每一浓度设5个复孔,5% CO2、37℃培养24、48、72 h后,每孔加入10 μl CCK-8继续培养2 h,酶标仪在450 nm下测定吸光度(A)。
1.5 DCs细胞分组 根据CCK-8筛选最佳含药血清结果,将两组人员的DCs细胞分为5组,正常组(10%FBS 1640培养基+健康对照组人员DCs)、模型组(10% FBS 1640培养基+HBV-ACLF阳黄证患者DCs)、温法干预组(10%温法高剂量含药血清1640培养基+HBV-ACLF阳黄证患者DCs)、去温法干预组(10%去温法高剂量含药血清1640培养基+HBV-ACLF阳黄证患者DCs )、空白组(空白血清 1640培养基+HBV-ACLF阳黄证患者DCs)。
1.6 流式细胞术检测DCs表面HLA-DR、CD80、CD86、CD83表达及平均荧光强度(MFI) 将各组DCs分别加入标记APC-Cy7-抗人HLA-DR,PE-Cy7抗人CD80,APC-抗人CD86,PE-抗人CD83的荧光抗体,避光30 min。用含有1% FBS的PBS洗涤,上流式细胞仪检测。
1.7 ELISA检测DCs分泌IL-12、IL-6、IL-10水平 收集各组DCs上清液,按照人IL-12、IL-6、IL-10检测试剂盒说明加样,于450 nm处检测A值,以标准物的浓度为横坐标,A为纵坐标,绘制标准曲线,根据标准曲线的直线回归方程计算IL-12、IL-6、IL-10含量。
1.8 混合淋巴细胞反应(MLR) 无菌条件下采集对照组人员外周血10 ml,分离PBMC,经磁珠分选系统阴选后获得T细胞,以完全培养基悬浮,调整细胞浓度为2×105/ml,注入96孔板,每孔100 μl,同时收集各组干预后的DCs用50 μg/ml的丝裂霉素C 37℃处理45 min后,PBS洗涤2次,悬浮于完全RPMI 1640培养基中,分别以1∶10、1∶20的比例加入96孔培养板,终体积200 μl/孔,每组各3个复孔,对照孔不加DCs,在37℃、5% CO2培养箱中培养96 h后,离心去上清液,每孔加入100 μl完全培养基,10 μl CCK-8继续培养2 h,酶标仪450 nm检测各孔A值。
2 结果
2.1 DCs体外培养形态学观察及细胞鉴定 磁珠分选CD14+细胞,加入hGM-CSF、hIL-4刺激,培养第1天,细胞未见明显突起,第3天可见细胞增殖集落形成,少数细胞出现少许突起,第5天,可见大量细胞悬浮或半悬浮,细胞呈不规则形态,第7天细胞突出更加明显,呈典型的树突状形态,见图1。选择CD11C、HLA-DR作为DCs的标记,流式细胞仪检测DC的纯度达96.4%,见图2。

图1 倒置显微镜下DCs形态特征 (×200) A、B、C、D代表培养第1、3、5、7天DCs形态

图2 流式细胞仪鉴定DCs及纯度分析 A:去粘连;B:标死活;C:DC纯度
2.2 最佳含药血清浓度筛选 与空白组DCs同期比较,温法高剂量组DCs与去温法高剂量组DCs吸光度(A)24 h、48 h明显升高,72 h下降,表明温法高剂量药物血清与去温法高剂量药物血清在24 h、48 h对DCs有促增殖作用,72 h增殖作用减弱,24 h差异有统计学意义(P>0.05),各质量浓度含药血清对DCs的增殖作用在培养48 h时最强,见表1。结合文献和课题组前期研究[10],故本实验选择温法、去温法高剂量含药血清作为最佳的含药血清浓度,最佳作用时间选择48 h。
表1 不同质量浓度含药血清在不同时间点对DCs增殖的影响
2.3 不同剂量含药血清对DCs表面CD80、CD86、CD83、HLA-DR表达的影响 与正常组比较,模型组DCs的CD80、CD86、CD83、HLA-DR表达率明显降低(P<0.01);与模型组比较,温法干预组DCs的CD80、CD86、CD83、HLA-DR表达率明显升高(P<0.05),其中CD83,HLA-DR变化显著(P<0.01);空白组较模型组DCs的CD83,HLA-DR表达率稍增高,但差异无统计学意义(P>0.05);去温法干预组DCs的CD80、CD86、CD83、HLA-DR表达率较模型组升高,但CD80、CD86、CD83表达率差异无统计学意义(P>0.05),HLA-DR升高具有统计学意义(P<0.05)。见图3和表2。
表2 各组DCs的CD80、CD86、CD83、HLA-DR表达率比较
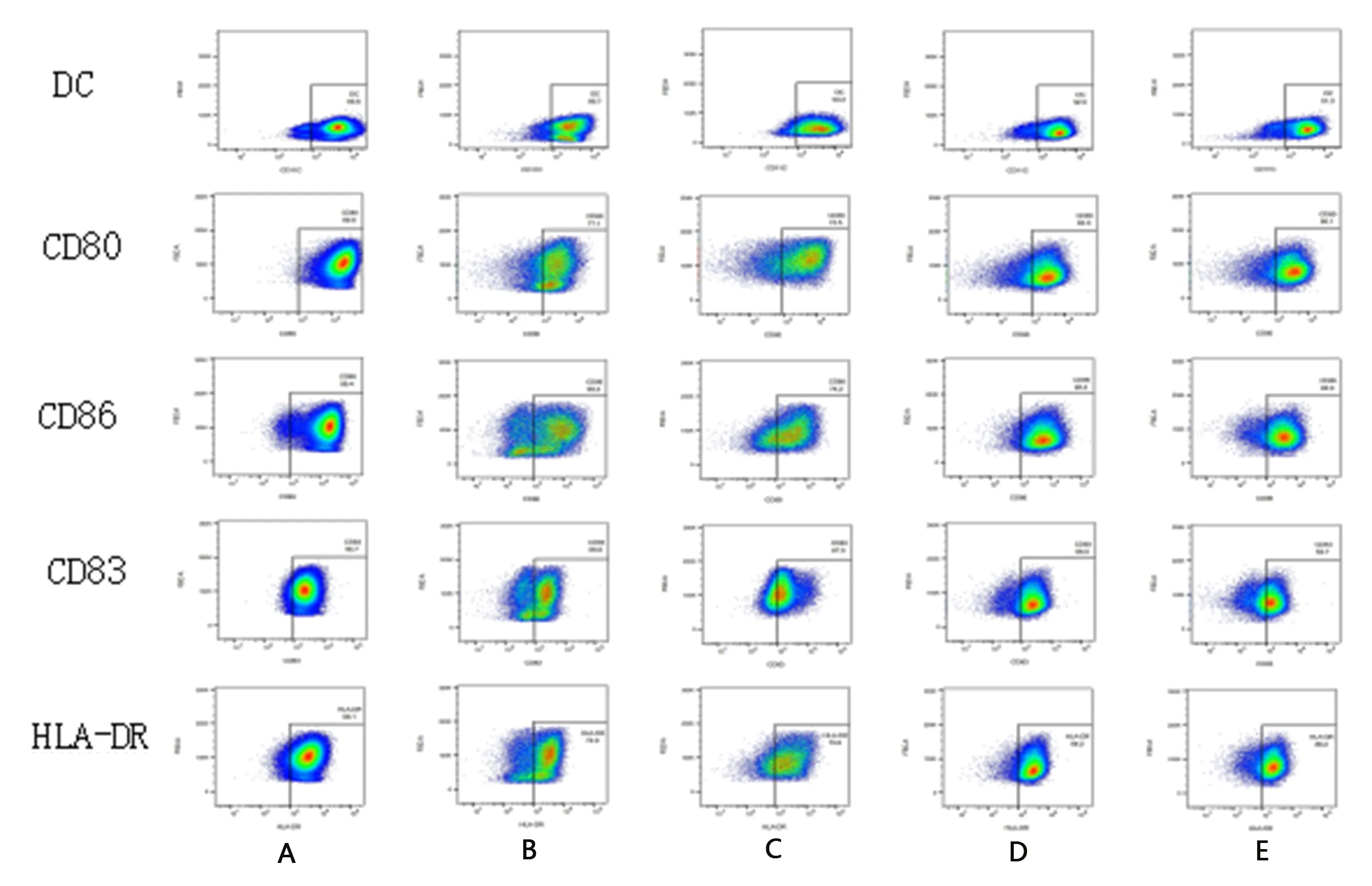
图3 流式细胞仪检测各组DC表达CD80、CD86、CD83、HLA-DR图 A:正常组;B:模型组;C:空白组;D:温法干预组;E:去温法干预组
各组DCs的CD80、CD86、CD83、HLA-DR平均荧光强度(MFI)结果:与正常组比较,模型组DCs的CD80、CD86、CD83,HLA-DR MFI明显降低(P<0.01);与模型组比较,温法干预组DCs的CD80、CD86、CD83、HLA-DR MFI明显升高(P<0.01);空白组与模型组DCs的CD80、CD86、CD83、HLA-DR MFI比较无统计学差异(P>0.05);去温法干预组DCs的CD80、CD86、CD83 MFI值较模型组升高,但差异无统计学意义(P>0.05),HLA-DR MFI升高具有统计学差异(P<0.05),见表3。
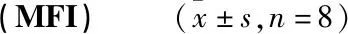
表3 各组DCs的CD80、CD86、CD83、HLA-DR平均荧光强度
2.4 各组DCs分泌细胞因子 IL-12、IL-6、IL-10情况 与正常组比较,模型组DCs分泌细胞因子 IL-12、IL-10明显降低(P<0.01),IL-6明显升高(P<0.01);与模型组比较,温法干预组DCs 分泌细胞因子 IL-12、IL-10明显升高(P<0.01),IL-6明显降低(P<0.01);去温法干预组DCs 分泌细胞因子 IL-12、IL-10升高,但差异无统计学意义(P>0.05),IL-6明显降低(P<0.01)。见表4。
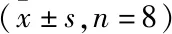
表4 各组DCs分泌细胞因子IL-12、IL-6、IL-10水平比较
2.5 各组DCs对T淋巴细胞增殖的影响 与正常组比较,模型组DCs与T淋巴细胞在1∶10、1∶20共培养水平下,均出现T淋巴细胞增殖能力降低(P<0.01);与模型组比较,温法干预组DCs促T淋巴细胞增殖能力显著提高(P<0.01),空白组与去温法干预组DCs促T淋巴细胞增殖能力稍升高,但差异无统计学意义(P>0.05)。见表5。
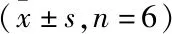
表5 各组DCs促T淋巴细胞增殖反应比较
3 讨论
HBV-ACLF多发生于慢性乙型肝炎、肝硬化基础上,因病毒复制导致的免疫功能损伤是始动因素,免疫损伤直接或间接导致肝细胞坏死,介导局部炎症,进一步加重肝损伤,导致肝脏代谢功能紊乱,诱发或加重肝外多脏器功能衰竭。免疫系统介导的肝功能损伤是HBV-ACLF发病的首要机制,DCs作为最强大的抗原提呈细胞,在先天免疫和获得性免疫中发挥关键性作用,它的免疫状态直接影响机体的免疫应答。相关研究发现HBV-ACLF患者外周血DCs数量明显减少,存活组患者DCs绝对数明显高于死亡组,DCs可作为影响患者预后的预测指标[11]。前期研究发现HBV相关肝衰竭不同证型、不同阶段的患者均存在DCs功能低下,疾病进展与DCs功能低下呈正相关,因此调控DCs在HBV-ACLF治疗中有重要意义。
中医药治疗HBV-ACLF疗效确切,多从黄疸辨证论治,分为阳黄与阴黄,传统观念认为阳黄禁用温法,以防温阳化火而加重黄疸。前期研究发现 ACLF发病过程中始终存在湿热、瘀热、脾虚3个因素,在疾病的不同阶段,各因素表现主次可不同,但脾虚始终存在,ACLF黄疸辨证论治可早期加温药干预[12]。温阳解毒化瘀方是我院协定处方,由附子、赤芍、白术、薏苡仁、茵陈、丹参等六味药组成,具有清热利湿、温阳健脾、活血化瘀的作用,治疗肝衰竭疗效显著。本研究通过比较温阳解毒化瘀方(温法)含药血清与温阳解毒化瘀方减附片、白术方(去温法)含药血清对HBV-ACLF阳黄证患者DCs功能的影响,不仅有利于进一步明确HBV-ACLF阴黄化的发病机制,同时也为早期温法治疗HBV-ACLF的临床应用提供实验数据。
因DCs仅占PBMC 的0.1%~1%,不利于功能研究,因此本实验采用单核细胞衍生的DCs体外模型进行研究[13],利用磁珠分选方法,从PBMC中分离CD14+单核细胞,诱导培养成成熟DCs后经流式细胞仪鉴定和纯度分析[14],采用CD11C和HLA-DR分子作为鉴定指标,经鉴定细胞纯度在80%以上,可进行后续实验。CD83是DCs成熟的相对特异性标志。DCs成熟后高表达HLA-Ⅱ类分子和共刺激分子(CD80、CD86),协同作用,激活初始T淋巴细胞。去温法干预组DCs的HLA-DR升高,但CD80,CD86升高不明显,不能有效激活T细胞。成熟的DC分泌IL-12,促进Th0细胞向Th1细胞分化,有助于提高机体的细胞免疫功能,有效清除HBV病毒。IL-6和IL-10是机体炎症反应的重要介质,活化的DC分泌IL-6,联合转化生长因子(TGF-β),促进Th0细胞向Th17分化;而IL-10联合TGF-β促进Th0细胞向Treg分化,前期研究发现HBV-ACLF患者存在Th17/Treg失衡[15],可能与DCs功能低下相关,进一步实验验证温阳解毒化瘀方可调控Th17/Treg失衡[16],与本实验研究结果相符。
温法干预可明显提高HBV-ACLF阳黄证患者外周血DCs功能,有利于HBV病毒的清除和免疫功能紊乱的恢复,可能是温法作用的潜在机制,为温法的早期临床应用提供一定的实验依据。因HBV-ACLF发病机制复杂,机体存在严重免疫细胞功能紊乱和促炎、抑炎因子分泌失衡,DCs功能在疾病不同时期会受到不同程度的影响。因本实验样本量有限,所得到的结果可能未能全面地反应疾病整个病程,有待今后进一步扩大样本量进行研究。
