基于超高效液相色谱-三重四级杆串联质谱法的花椒中氨基酸和核苷类成分分析与评价
2023-05-30马芮萍苏阿龙朱艳
马芮萍 苏阿龙 朱艳


摘要:建立了UPLC-MS/MS法同時测定花椒中17种氨基酸和6种核苷的分析方法,并对不同产地的花椒样品进行主成分分析和聚类分析。样品经水提取后用超高效液相色谱-三重四级杆串联质谱仪测定,采用电喷雾电离源,多反应监测(MRM)模式检测,外标法定量。结果表明,17种氨基酸和6种核苷在各自的线性范围内线性良好,检出限为0.001 3~0.087 8 μg/g,定量限为0.004 5~0.292 7 μg/g;加标回收率为60.4%~120.4%,相对标准偏差(RSD)为0.6%~13.4%,操作方法简便快速,灵敏度和稳定性较好;14批次花椒样品中TAA在333.5~569.9 mg/kg之间,平均含量为451.3 mg/kg,其中S4氨基酸总量最高;氨基酸中精氨酸含量最高,平均含量为172.7 mg/kg,占TAA的38.3%;核苷总量在14.4~38.5 mg/kg之间,平均含量为27.7 mg/kg,其中S3核苷总量最高;核苷中尿苷含量最高,平均含量为21.6 mg/kg,占核苷总量的77.9%;通过主成分分析和聚类分析发现来自甘肃省陇南市西和县、甘肃省陇南市武都区、甘肃省天水市秦安区的花椒综合品质较高,位列该次测定的第一梯队,测定的数据可为甘肃地方特色产业的开发利用提供数据支持。
关键词:超高效液相色谱-质谱/质谱联用法(UPLC-MS/MS);花椒;氨基酸;核苷;主成分分析
中图分类号:TS264.2 文献标志码:A 文章编号:1000-9973(2023)04-0187-07
Abstract: UPLC-MS/MS method is established for the simultaneous determination of 17 amino acids and 6 nucleosides in Zanthoxylum bungeanum, and principal component analysis (PCA) and clustering analysis are conducted on Zanthoxylum bungeanum samples from different places of origin. After water extraction, the samples are determined by ultra-high performance liquid chromatography-triple quadrupole tandem mass spectrometry, detected by electrospray ionization source in multiple reaction monitoring (MRM) mode, and quantified by external standard method. The results show that 17 amino acids and 6 nucleosides both have good linearity within their respective linear ranges, with the detection limit ranging from 0.001 3 μg/g to 0.087 8 μg/g and the quantification limit ranging from 0.004 5 μg/g to 0.292 7 μg/g. The spiked recovery rates are 60.4%~120.4%, and the relative standard deviations (RSDs) are 0.6%~13.4%. The method is simple and rapid, with good sensitivity and stability. The TAA in 14 batches of Zanthoxylum bungeanum samples ranges from 333.5 mg/kg to 569.9 mg/kg, with the average content of 451.3 mg/kg, among which, the total amount of amino acids in S4 is the highest; among the amino acids, arginine content is the highest, with the average content of 172.7 mg/kg, accounting for 38.3% of TAA. The total amount of nucleosides ranges from 14.4 mg/kg to 38.5 mg/kg, with the average content of 27.7 mg/kg, among which, the total amount of nucleosides in S3 is the highest; among the nucleosides, the uridine content is the highest, with the average content of 21.6 mg/kg, accounting for 77.9% of the total amount of nucleosides. Through principal component analysis and clustering analysis, it is found that the comprehensive quality of Zanthoxylum bungeanum from Xihe County and Wudu District in Longnan City, Gansu Province and Qin'an District in Tianshui City, Gansu Province is higher, ranking in the first tier of this measurement. The measured data can provide data support for the development and utilization of local characteristic industries in Gansu Province.
Key words: ultra-high performance liquid chromatography-mass spectrometry/mass spectrometry(UPLC-MS/MS); Zanthoxylum bungeanum; amino acids; nucleosides; principal component analysis
花椒(Zanthoxylum bungeanum)是芸香科花椒属小落叶乔木,一般4~5月份开花,8~10月份结果,是一种药食两用的经济作物,其果皮被誉为“八大调味品”之一[1]。花椒中含有生物碱、蛋白质、脂肪酸、生物活性成分、芳香物质等营养成分,不仅可以作为调味品,而且具有抗炎镇痛[2-3]、杀虫止痒[4]、抗氧化[5]、抗肿瘤[6-7]、抑菌[8]、祛湿等[9]药用价值。蛋白质是花椒的主要营养成分[10],氨基酸是蛋白质的基本结构单元,是维持人体生命活动的重要营养成分,具有营养支持、免疫调节及抗肿瘤等作用[11];核苷是核酸合成的前体,具有保护神经、抗病毒和抗菌等生物活性[12]。目前关于花椒的研究主要集中在花椒精油的提取与分析、挥发性成分、麻味物质等方面[13-15],对于花椒中氨基酸和核苷的研究鲜见报道。
主成分分析(principal component analysis,PCA)是通过降低数据维数,将多个变量通过线性变换为少数综合变量,用简化的数据反映原始数据的多元统计分析方法。聚类分析利用欧氏距离或者马氏距离聚类计算样品之间的相关性,根据相关程度将其简化合并,更直观地对相似品种及组分进行综合比较[16]。
本研究以来自甘肃、陕西、四川等14个地区的花椒为研究对象,采用UPLC-MS/MS法建立了同时测定花椒中氨基酸含量和核苷含量的检测方法,并利用Excel软件进行含量计算,SPSS 26.0软件进行主成分分析和聚类分析,比较不同地区花椒中氨基酸和核苷含量的差异性,以期为甘肃地方特色产业的开发利用提供数据支撑。
1 材料和方法
1.1 材料
花椒样品分别购自不同地区共计14批次,见表1。
1.2 试剂
标准品:丙氨酸(Ala)、精氨酸(Arg)、天冬氨酸(Asp)、胱氨酸(Cys)、谷氨酸(Glu)、亮氨酸(Leu)、赖氨酸(Lys)、丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)、缬氨酸(Val)、组氨酸(His)、异亮氨酸(Ile)、蛋氨酸(Met)、苯丙氨酸(Phe)、脯氨酸(Pro)、甘氨酸(Gly)混合标准溶液(胱氨酸浓度为1.25 mol/L,其余浓度为2.5 mol/L):上海安谱科技有限公司;腺苷(Ade)、尿苷(Uri)、肌苷(Ino)、鸟苷(Gua)、黄嘌呤(Xan)、次黄嘌呤(Hyp)(纯度均≥98%):北京索莱宝科技有限公司;甲醇、乙腈(均为色谱纯):美国Merck公司;甲酸(色谱纯):天津科密欧化学试剂有限公司。
1.3 主要仪器与设备
QTRAP 4500超高效液相色谱-三重四级杆-线性离子肼串联质谱仪 美国SCIEX公司;VXR涡旋振荡器 德国IKA公司;KH30R-Ⅱ冷冻离心机 湖南凯达科学仪器有限公司;KQ-600DE超声波清洗器 东莞市科桥超声波设备有限公司;十万分之一天平(精确度为0.1 mg) 德国Sartorius公司;Milli-Q Gradient纯水仪 美国Millipore公司。
1.4 方法
1.4.1 色谱条件
ACQUITY UPLC BEH Amide色谱柱(100 mm×2.1 mm,1.7 μm);流速:0.2 mL/min;柱温:40 ℃;进样量:5 μL;流动相:A为水溶液(含0.1%甲酸),B為甲醇(含0.1%甲酸);流动相梯度洗脱程序:0~1.0 min,10% B;1.0~1.5 min,10%~90% B;1.5~4.0 min,90% B;4.0~4.1 min,90%~10% B;4.1~8.0 min,10% B。
1.4.2 质谱条件
电喷雾电离源(ESI+);检测方式:多反应监测模式(MRM);气帘气(CUR):35 psi;碰撞气(CAD):中;离子化电压(IS):5 500 V;离子源温度:550 ℃;喷雾气(GS1):55 psi;辅助加热气(GS2):60 psi。
1.4.3 溶液配制
一级核苷标准储备液(500 μg/mL):分别准确称取单个核苷标准品5 mg(精确至0.01 mg)于10 mL容量瓶中,加入适量水溶解,用水定容,混匀后于4 ℃保存。
二级核苷标准混合储备液(5 μg/mL):分别准确移取100 μL一级核苷标准储备液于10 mL容量瓶中,用水定容,混匀后于4 ℃保存。
氨基酸标准储备液:准确移取氨基酸混合标准溶液500 μL于5 mL容量瓶中,加入适量水溶解,用水定容,混匀后于4 ℃保存。
混合标准工作液:分别准确移取200 μL二级核苷标准混合储备液及4.0 mL氨基酸标准储备液于10 mL容量瓶中,用水定容,作为混合标准工作液。取混合标准工作液适量,依次配成系列浓度的混合标准品溶液,现用现配。
1.4.4 样品前处理
将收集到的花椒样品去除杂质,于45 ℃鼓风干燥箱内干燥1 h,粉碎过60目筛,置于干燥器中备用。
称取花椒试样2.0 g(精确至0.000 1 g)置于50 mL离心管中,加入30 mL超纯水,涡旋混合1 min,40 ℃超声提取30 min,4 000 r/min离心5 min,上清液过0.22 μm滤膜,待UPLC-MS/MS分析。
1.4.5 方法学考察
1.4.5.1 线性关系、相关系数及检出限
将“1.4.3”配制好的系列标准工作液按照“1.4.1”和“1.4.2”色谱及质谱条件进样测定,以对照品浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,得到17种氨基酸和6种核苷的线性方程、相关系数。以信噪比(S/N)约为3计算各成分的检出限(LOD),信噪比(S/N)约为10计算各成分的定量限(LOQ)。
1.4.5.2 精密度和加标回收实验
精密称取试样S1(青花椒)6份,每份2.0 g,加入2.5 mg/kg(胱氨酸1.25 mg/kg)、5.0 mg/kg(胱氨酸2.5 mg/kg)、10 mg/kg(胱氨酸5 mg/kg)標准溶液,采用优化后的实验条件进行测定,计算添加水平的加标回收率和相对标准偏差(n=6)。
1.4.6 数据处理
采用 Excel 2016软件对测定数据进行整理统计,计算相关数据的平均值、标准偏差。采用SPSS 26.0对数据进行主成分分析和聚类分析。
2 结果与分析
2.1 MRM模式下目标化合物检测方法的建立
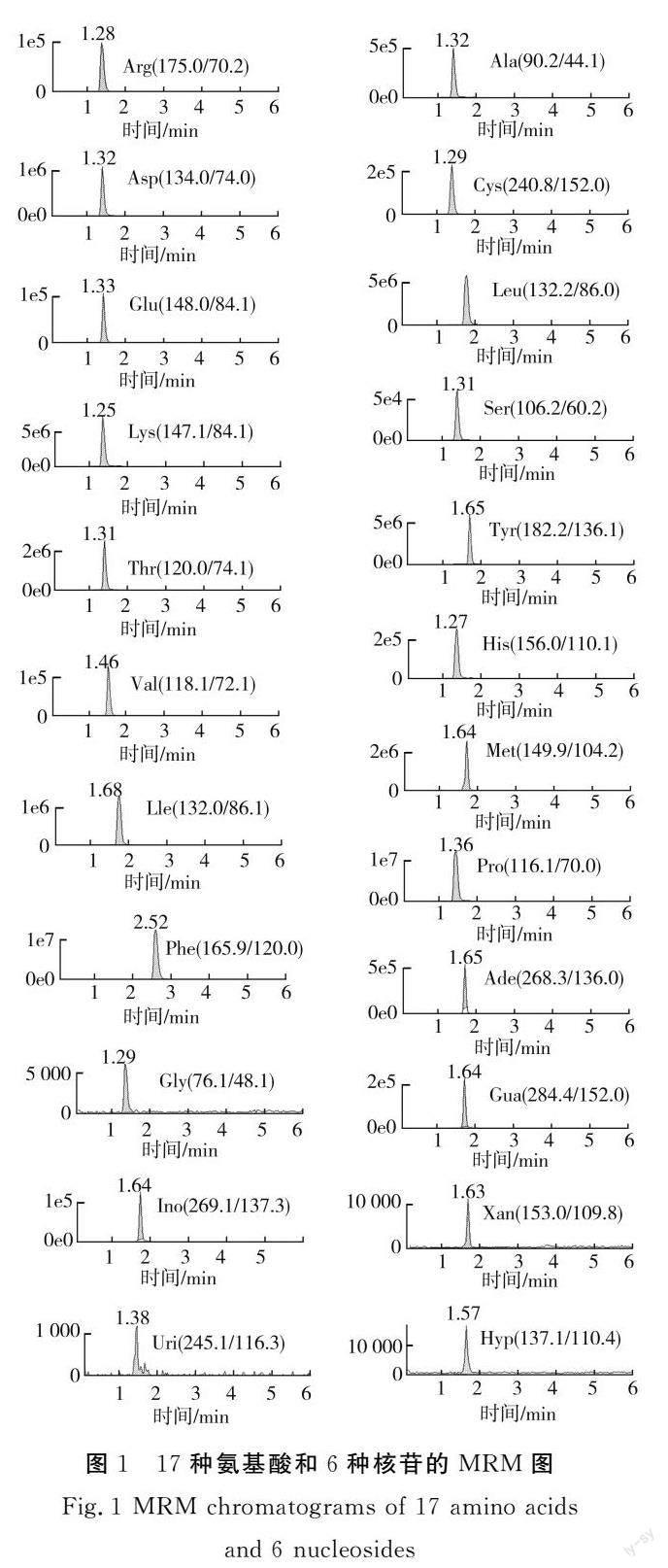
离子化模式ESI+:采集方式为多反应监测(MRM),本研究在国家标准及文献报道[16-17]的基础上,优化了23种待测物质的碰撞能量(DP)和去簇电压(CE),最终得到的17种氨基酸和6种核苷的质谱条件以及23种目标化合物在MRM模式下的质谱条件,见表2。在ESI+扫描模式下,流动相中加入少量甲酸提供酸性环境,可促进目标化合物的电离,提高质谱响应,结果显示,乙腈-0.1%甲酸水溶液作为流动相时各化合物的峰形较好,在该条件下17种氨基酸和6种核苷的MRM图见图1。
2.2 方法学考察
2.2.1 线性关系、相关系数及检出限
将“1.4.3”配制好的系列标准工作液按照“1.4.1”和“1.4.2”色谱及质谱条件进样测定,以对照品浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,得到17种氨基酸和6种核苷的线性方程、相关系数。以各对照品信噪比(S/N)约为3时对应的浓度为检出限(LOD),各对照品信噪比(S/N)约为10时对应的浓度为定量限(LOQ),结果见表3。
由表3可知,17种氨基酸和6种核苷在相应的浓度范围内具有良好的线性关系,相关系数(r)≥0.999 00,检出限在0.001 3~0.087 8 μg/g范围内,定量限在0.004 5~0.292 7 μg/g范围内。
2.2.2 回收率和精密度
在花椒试样中分别添加氨基酸和核苷标准溶液,每个加标水平做6次平行实验,采用优化后的实验条件进行测定,加标回收率及精密度结果见表4。
由表4可知,17种氨基酸和6种核苷的加标回收率范围为60.4%~120.4%,相对标准偏差范围为0.6%~13.4%,说明本方法的准确性良好。
2.3 样品测定
2.3.1 样品中氨基酸含量分析
氨基酸在食物中大部分以蛋白质的形式存在,花椒果皮干样经水解处理后,蛋白质转变成氨基酸[17],从营养学角度上讲蛋白质质量的高低在于它所含的氨基酸种类以及对应的氨基酸含量。14批次花椒样品中氨基酸含量的测定结果见表5。
由表5可知,14批次花椒样品中氨基酸总量(total amino acid,TAA)在333.5~569.9 mg/kg之间,平均含量为451.3 mg/kg,其中S4氨基酸总量最高,其次为S3,S1氨基酸总量最低。14批花椒样品均含有15种氨基酸,其中精氨酸含量最高,含量在69.9~251.1 mg/kg之间,平均含量为172.7 mg/kg,占氨基酸总量的38.3%;脯氨酸次之,含量在73.1~211.6 mg/kg之间,平均含量为148.5 mg/kg,占氨基酸总量的32.9%。李美凤等[18]研究发现,花椒中精氨酸、脯氨酸含量较高,与本研究结果基本一致。脯氨酸在医学上可以作为营养不良、蛋白质缺乏症、严重胃肠道疾病、烫伤及外科手术后的蛋白质补充,植物抗寒性脯氨酸是植物蛋白质的组分之一,无明显毒副作用[19-20]。
花椒中检测出6种人体必需氨基酸(essential amino acid,EAA),必需氨基酸的总含量在68.0~106.9 mg/kg之间,平均含量为81.9 mg/kg,占氨基酸总量的18.2%。必需氨基酸中赖氨酸含量最高,平均含量为47.5 mg/kg,占必需氨基酸总量的57.9%,占氨基酸总量的9.8%,与侯娜等的研究结果一致。14批花椒中必需氨基酸总量最高的是S4,占氨基酸总量(EAA/TAA)的18.8%。14批花椒样品中必需氨基酸总量占氨基酸总量(EAA/TAA)在13.5%~26.8%之间,平均值为18.6%。必需氨基酸总量与非必需氨基酸总量(EAA/NEAA)的百分比为27.9%~60.0%,平均值为44.9%。
2.3.2 样品中核苷含量分析
核苷类成分是生物细胞维持生命活动的基本组成成分,参与DNA代谢过程,尤其对维持免疫应答、抗病毒和糖脂代谢等生物活性具有重要意义[21-23]。14批次花椒样品中核苷含量的结果见表5。由表5可知,14批次花椒样品中核苷总量在14.4~38.5 mg/kg之间,平均含量为27.7 mg/kg,其中S3核苷总量最高,其次为S7,S11核苷总量最低。14批花椒样品均含有6种核苷,其中尿苷含量最高,含量在9.0~30.0 mg/kg之间,平均含量为21.6 mg/kg,占核苷总量的77.9%;鸟苷次之,含量在2.5~5.5 mg/kg之间,平均含量为3.5 mg/kg,占核苷总量的27.7%;肌苷含量最低,含量在0.1~0.3 mg/kg之间,平均含量为0.2 mg/kg,占核苷总量的0.6%。
2.4 主成分分析
采用SPSS 26.0软件对14批花椒中氨基酸和核苷组分进行主成分分析,以特征值大于1作为提取主成分的标准。由表6可知,从21种组分中提取了5个主成分,其特征值分别为9.485,3.203,2.343,2.062,1.022,方差贡献率分别为45.167%、15.252%、11.159%、9.818%、4.865%,累计贡献率分别为45.167%、60.419%、71.578%、81.396%、86.261%,5个主成分的累计贡献率达到86.435%,表明这5个主成分能解释大部分数据。因此选择这5个主成分进行PCA分析,见表6。
由于任何单一主成分都无法代表花椒中21种成分的水平,以各主成分对应的贡献率作为权重,根据主成分得分进行加权求和计算,构建综合评价模型:F=0.452F1+0.604F2+0.716F3+0.814F4+0.863F5,得到主成分综合得分,结果见表7。
由表7可知,在第一主成分中,S4的得分最高;在第二主成分中,S4的得分最高;在第三主成分中,S13的得分最高;在第四主成分中,S3的得分最高;在第五主成分中,S6的得分最高。综合得分排序为S4>S3>S6>S7>S14>S8>S11>S2>S12>S13>S5>S9>S10>S1,其中综合得分最高的是S4(西和油椒),综合得分最低的是S1(青花椒)。表7中的F值表明,这14批次花椒中氨基酸含量差异明显。
2.5 聚类分析
采用SPSS 26.0软件对14批花椒中氨基酸和核苷组分进行主成分分析,以特征值大于1作为提取主成分的标准。
通过氨基酸和核苷含量等指标分析,花椒氨基酸营养价值优良程度并不一致,单一指标比较花椒营养价值有一定的局限性,为了更准确、合理地评价各种质花椒营养价值优良程度,综合花椒中TAA、EAA、CEAA、NEAA、EAA/TAA、EAA/NEAA、核苷总量等指标,对14批次花椒进行聚类分析。
采用SPSS 26.0软件对14个地区的花椒样品进行聚类分析,结果显示在欧氏距离5处可将14份花椒样品分为6类(见图2)。第Ⅰ类为S2、S8、S9、S13、S14 5批次样品;第Ⅱ类为S5、S11样品;第Ⅲ类为S1样品;第Ⅳ类为S12样品;第Ⅴ类为S3、S4、S6、S7 4批次样品;第Ⅵ类为S10样品。由表5可知,6个分类中各营养成分存在差异,第Ⅴ类花椒中氨基酸总量和核苷总量高于其他类,综合品质较高;第Ⅲ类EAA/CEAA最高,但是综合品质一般,低于其他类;第Ⅳ类EAA/TAA最高,综合品质居于中下水平,综合排第9;第Ⅵ类样品NEAA含量最高且核苷总量较高,综合品质仅高于S1样品。氨基酸含量、核苷含量和组分差异与当地土质营养和气温条件有关,同时与管理方式和采收时间有关[24],该聚类结果反映了不同产地样品间的差异性,为花椒的开发利用及营养评价提供了一定的理论参考。
3 结论
本研究采用UPLC-MS/MS建立了同时测定花椒中17种氨基酸和6种核苷的检测方法。23种待测物质在各自的线性范围内线性良好,检出限范围为0.001 3~0.087 8 μg/g,定量限范围为0.004 5~0.292 7 μg/g;加标回收率为60.4%~120.4%,相对标准偏差(RSD)为0.6%~13.4%。采用建立的方法对不同地区的14批次花椒中的氨基酸和核苷含量进行了测定,结合主成分分析和聚类分析对样品进行了综合评价,结果显示,14批次花椒样品中TAA在333.5~569.9 mg/kg之间,平均含量为451.3 mg/kg,其中S4氨基酸总量最高;氨基酸中精氨酸含量最高,平均含量为172.7 mg/kg,占TAA的38.3%;核苷总量在14.4~38.5 mg/kg之间,平均含量为27.7 mg/kg,其中S3核苷总量最高;核苷中尿苷含量最高,平均含量为21.6 mg/kg,占核苷总量的77.9%;通过主成分分析和聚类分析发现来自甘肃省陇南市西和县、甘肃省陇南市武都区、甘肃省天水市秦安区的花椒综合品质较高,位列本次测定的第一梯队。本研究建立的方法具有高效、简便、稳定性好、灵敏度高的特点,可以广泛应用于花椒中氨基酸和核苷含量的测定,测定的数据可为甘肃地方特色产业的开发利用提供数据支撑。
參考文献:
[1]侯娜,赵莉莉,魏安智,等.不同种质花椒氨基酸组成及营养价值评价[J].食品科学,2017,38(18):113-118.
[2]ZHANG Z C, SHEN P, LIU J X, et al. In vivo study of the efficacy of the essential oil of Zanthoxylum bungeanum pericarp in dextran sulfate sodium-induced murine experimental colitis[J].Journal of Agricultural & Food Chemistry,2017,65(16):3311.
[3]边甜甜,司昕蕾,牛江涛,等.花椒挥发油部位经清炒法炮制前后在小鼠体内的抗炎与镇痛作用[J].中国临床药理学杂志,2019,35(4):369-371,376.
[4]赵媛.青花椒提取物对桃蚜和小菜蛾的生物活性研究[D].保定:河北农业大学,2007.
[5]柴丽琴.花椒油树脂提取、成分分析、抗氧化性及抑菌性研究[D].西安:陕西师范大学,2018.
[6]韩胜男.基于中药组效关系的花椒挥发油抗肿瘤活性组分的研究[D].天津:天津大学,2014.
[7]周敏.花椒麻素对肝癌细胞生理功效及机理研究[D].重庆:西南大学,2014.
[8]关荣琴.花椒生物碱成分分离、感官评定及药理作用研究[D].长春:吉林大学,2011.
[9]DEVKOTA K P, WILSON J, HENRICH C J, et al. Isobutylhydroxyamides from the pericarp of Nepalese Zanthoxylum armatum inhibit NF1-defective tumor cell line growth[J].Journal of Natural Products,2013,76(1):59-63.
[10]姜仲茂,乌云塔娜,王森,等.不同产地野生长柄扁桃仁氨基酸组成及营养价值评价[J].食品科学,2016,37(4):77-82.
[11]GUO M C, SHI T Y, DUAN Y H, et al. Investigation of amino acids in wolfberry fruit (Lycium barbarum) by solid-phase extraction and liquid chromatography with precolumn derivatization[J].Journal of Food Composition and Analysis,2015,42:84-90.
[12]陸城宇,李俊松,狄留庆,等.不同产地桑叶氨基酸、核苷、生物碱成分的含量测定及多元统计分析[J].中国现代应用药学,2020,37(9):1052-1057.
[13]游玉明,任文瑾,刘庆庆,等.花椒精有效成分对高脂膳食大鼠脂质代谢的影响[J].营养学报,2015,37(3):288-293.
[14]白小鸣,王华,曾小峰,等.气相色谱-质谱法结合保留指数对比花椒提取物初步分析梁平柚麻味物质的组成成分[J].食品科学,2015,36(18):103-107.
[15]杨静,赵镭,史波林,等.青花椒香气快速气相电子鼻响应特征及GC-MS物质基础分析[J].食品科学,2015,36(22):69-74.
[16]王馨雨,王蓉蓉,王婷,等.不同品种百合内外鳞片游离氨基酸组成的主成分分析及聚类分析[J].食品科学,2020,41(12):211-220.
[17]陈巧玲,李忠海,陈素琼.5种地产食用菌氨基酸组成比较及营养评价[J].食品与机械,2014,30(6):43-46,81.
[18]李美凤,陈艳,孟晓,等.花椒中氨基酸含量分析[J].轻工科技,2016(4):10-12.
[19]CAULI O, RODRIGO R, LLANSOLA M, et al. Glutamatergic and gabaergic neurotransmission and neuronal circuits in hepatic cencephalopathy[J].Metabolic Brain Disease,2009,24(1):69-80.
[20]蒋与刚,徐琪寿.条件性必需氨基酸在创伤愈合中的作用及其机制研究进展[J].生物资源,2002,24(3):59-62.
[21]ZHU S Q, GUO S, DUAN J A, et al. UHPLC-TQ-MS coupled with multivariate statistical analysis to characterize nucleosides, nucleobases and amino acids in angelicae sinensis radix obtained by different drying methods[J].Molecules,2017,22(6):918.
[22]XIANG X, SHA X X, SU S L, et al. Simultaneous determination of polysaccharides and 21 nucleosides and amino acids in different tissues of Salvia miltiorrhiza from different areas by UV-visible spectrophotometry and UHPLC with triple quadrupole MS/MS[J].Journal of Separation Science,2018,41(5):996-1008.
[23]张勋,张嘉嘉,马迟,等.HPLC法同时测定金线莲中12个核苷类成分的含量[J].药物分析杂志,2020,40(7):1197-1208.
[24]狄彩霞,王正银.影响花椒产量和品质的因素[J].中国农学通报,2004,20(3):179-189.
