BDNF信号通路在儿童孤独症谱系障碍中的作用机制及中医药干预研究进展
2023-05-30吴吉裴方妤张涤朱沁泉
吴吉 裴方妤 张涤 朱沁泉
〔摘要〕 腦源性神经营养因子(brain-derived neurotrophic factor, BDNF)为细胞内信号通路转导分子,调节众多重要的生理过程。BDNF信号通路对于神经元的存活、形态发生和可塑性至关重要。目前,认为BDNF信号通路失调与孤独症谱系障碍(autism spectrum disorder, ASD)的发病机制密切相关,BDNF在外周血中的浓度可能成为评估ASD的潜在生物学指标。中医药治疗ASD具有整体调节和多通道、多靶点的优势,可能通过调控BDNF信号通路改善ASD核心症状或伴随症状。目前,研究存在的问题主要有:BDNF下游机制复杂,与ASD发病关系的相关机制未完全阐明;中医药治疗儿童ASD的报道多为中药复方的临床观察研究,尚缺乏中药活性成分疗效机制的动物实验及针对BNDF信号通路的研究。今后的研究中,需进一步设计科学严谨的实验方案,深入了解BDNF信号通路的作用机制。对BDNF信号通路在ASD发病机制中的作用及中医药研究进行综述,以期为ASD的靶向治疗提供理论依据。
〔关键词〕 孤独症谱系障碍;脑源性神经营养因子;信号通路;中医药;靶点;儿童
〔中图分类号〕R272 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.030
Mechanisms of BDNF signaling pathway in autism spectrum disorder and
research progress of Chinese medicine intervention
WU Ji1, PEI Fangyu1, ZHANG Di2*, ZHU Qinquan2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China;
2. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China
〔Abstract〕 Brain-derived neurotrophic factor (BDNF) is an intracellular signal transduction molecule that regulates important physiological processes. Furthermore, BDNF signaling pathway is essential for neuronal survival, morphogenesis and plasticity. Since the imbalance of BDNF signaling pathway is considered to be closely related to the pathogenesis of autism spectrum disorder (ASD), the concentration of BDNF in peripheral blood may become a potential biological index to evaluate ASD. Chinese medicine treatment of ASD can regulate overally with multiple channels and multiple targets. It may improve the core or concomitant symptoms of ASD by regulating BDNF signaling pathway. The main problems in its current research are as follows: the downstream mechanism of BDNF is complex and the ASD pathogenesis is not fully elucidated.Most reports on the treatment of children with ASD by Chinese medicine are clinical observation of formulas, but there is still a lack of animal experiment on the therapeutic mechanisms of active ingredients of formula and research on BDNF signaling pathway. In the future research, it is necessary to further design a scientific and rigorous experimental scheme to deeply understand the mechanisms of BDNF signaling pathway. This paper reviews the role of BDNF signaling pathway in the pathogenesis of ASD and the research of Chinese medicine, in order to provide a theoretical basis for the targeted treatment of ASD.
〔Keywords〕 autism spectrum disorder; brain-derived neurotrophic factor; signaling pathways; Chinese medicine; target; child
孤独症谱系障碍(autism spectrum disorder, ASD)是一组具有临床异质性、可合并其他多种疾病的神经发育障碍症候群,以社会交往障碍、重复刻板的行为-感觉异常与狭隘兴趣为核心症状,是早期大脑发育和神经重组的结果[1]。本病全球发病率为1%~2%,男女比例约4∶1[2]。ASD也是我国0~6岁精神残疾儿童致残的首位原因,占比高达78%。本病可伴有其他发育障碍疾病,如智力障碍、发育性语言障碍、运动障碍等[3]。加之ASD的特征性表现,使患儿在学校、社会交往、家庭生活、自我照护和未来工作等多方面面临挑战[4]。目前,ASD病因及发病机制尚不明确,以康复训练、教育干预为主,药物为辅的治疗手段,旨在改善临床症状,无法达到治愈目的,使得本病成为全世界共同面临的重大公共卫生难题及沉重的社会、家庭负担。
脑源性神经营养因子(brain-derived neurotro?鄄phic factor, BDNF),属于重要的神经营养因子之一,BDNF及其高亲和力酪氨酸激酶受体B(tyrosine kinase receptor B, TrkB)在发育中和成年哺乳动物的大脑尤其是海马和皮质中广泛表达[5]。BDNF/TrkB刺激细胞内信号转导对神经元的存活、形态发生和可塑性至关重要。近年来,研究表明BDNF通过与受体结合,激活下游信号通路,对神经元产生正向或负向的影响,涉及各种脑部疾病的病理生理学,如抑郁症、阿尔茨海默病、帕金森病等[6]。同时研究也关注到,BDNF信号通路可能与ASD发病密切相关。因此,本文旨在初步总结BDNF信号通路在ASD发病过程中的作用机制,为发现治疗ASD的药物或手段提供新思路。
1 BDNF的概述
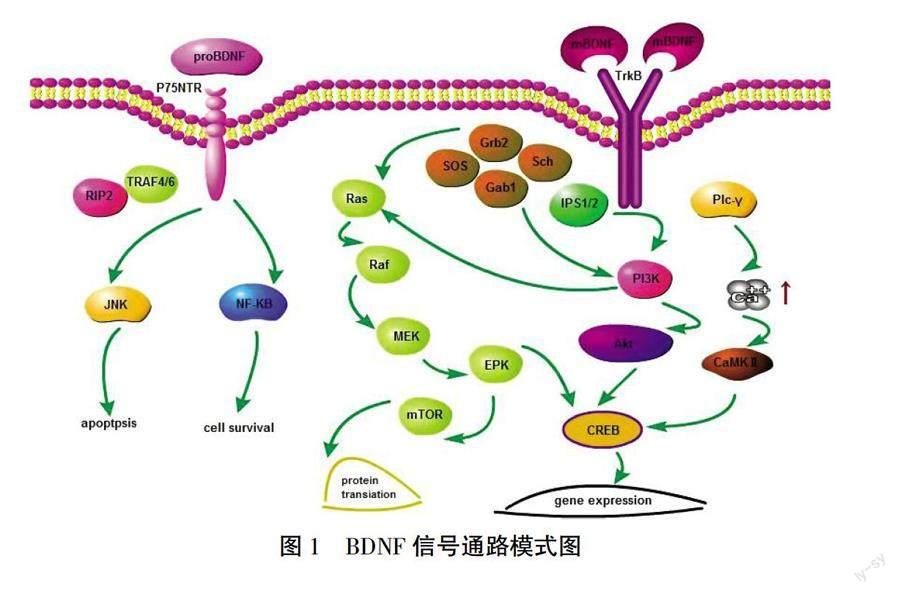
神经营养因子包括神经生长因子、BDNF、神经营养因子-3和神经营养因子-4/5,已知在神经元生长、分化、存活以及神经元结构和功能的调节中发挥关键作用[7-8]。BDNF的合成和成熟是一个多阶段的过程,涉及几种前体异构体的形成。BDNF首先是在内质网中以pre-pro-BDNF形式存在,运输到高尔基体,在高尔基体中分裂后形成pro-BDNF。这种形式再次裂解,最终形成成熟的BDNF(m-BDNF)亚型。在大脑不同区域发育的不同阶段,原始性与间源性BDNF的比例不同。在出生后早期,pro-BDNF的浓度较高,而m-BDNF在成年人中较为普遍[9]。因此,pro-BDNF可能是调节大脑功能的重要因素,而m-BDNF发挥重要作用的过程在成年阶段,如神经保护和突触可塑性。BDNF参与多种神经生理过程,其最关键的功能包括调节神经新生、糖原合成、突触形成、神经保护、控制影响记忆和认知机制的长短突触之间的相互作用[7]。而上述功能需要结合特定的Trk受体,通过各种细胞内信号通路激活。BDNF与磷酸化的TrkB结合可激活丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)/细胞外信号调节蛋白激酶(extracellular regulated protein kinases, ERK)、磷脂酶cγ(Recombinant Phospholipase C Gamma, PLCγ)和磷酸肌醇3激酶(Phosphoinositide 3-kinase, PI3K)/蛋白激酶B(protein kinase B, Akt)通路[10]。除了TrkB,低亲和力的p75受体也参与神经元的存活和可塑性[11]。详见图1[12]。
2 BDNF与ASD
虽然ASD的病因、病理、生理机制尚不清楚,但研究证据表明,遗传基因和环境因素损伤神经发育导致了ASD的产生。大脑中的BDNF可通过血脑屏障进入外周血,并与血清BDNF变化呈正相关。目前,认为外周BDNF水平可间接反映脑内BDNF水平变化。因此,BDNF在外周血中的浓度可以作为评价ASD个体的一个潜在的生物学指标[13]。基于这一理论,近年来,涌现越来越多的报道、动物实验和荟萃分析来评估ASD动物模型或患者血液中BDNF水平的可能变化。然而,研究结果并不一致。这可能是方法学、样本人群、不同疾病阶段、性别、亚型、用药史等方面的差异造成的。自2002年首次利用Fmr1基因敲除(knockout, KO)小鼠模型研究BDNF/TrkB信号通路以来[14],后续展开许多实验对该模型小鼠神经祖细胞、海马和皮质神经元进行研究,并对BDNF和TrkB的RNA和蛋白水平进行分析,总体证明BDNF、TrkB在幼年实验小鼠中表达增加,但随着年龄的增长而下降[15-16]。PIETROPAOLO等[17]和SUN等[18]通过实验证明,应用BDNF或者TrkB激动剂可以增加Fmr1KO小鼠的BDNF水平,以改善或恢复其神经生物学和行为表型。近交系小鼠BTBRt+tf/j(black and tan, brachyuric, BTBR)由于模拟ASD核心特征的行为表型,也被用作该疾病的模型系统。REIM等[19]研究证实BTBR模型小鼠前脑中BDNF和TrkB下降。并且,这可能是一种年龄相关的现象,HWANG等[20]在胎儿BTBR小鼠大脑中观察到BDNF水平升高。SKOGSTRAND等[21]采集了1981年至2004年收集的干血斑样本,统计发现新生儿低血BDNF水平与ASD发生的概率显著相关,提示新生儿较低的BDNF水平可能是ASD发病的原因之一。一项对0~19岁ASD患儿的研究表明,0~9岁ASD患儿血清BDNF水平低于对照组,而10~19岁ASD患儿血清BDNF水平高于对照组[22]。SAGHAZADEH等[23]通过对20项研究进行荟萃分析,发现ASD儿童的血液BDNF水平高于对照组。
3 BDNF与表观遗传
表观遗传机制,如DNA甲基化,在精神疾病中发挥关键作用。表观遗传学研究的是基因表达的可遗传改变,其机制不会直接导致基础DNA序列的改变。具有表观遗传调控功能的基因与ASD的易感性密切相关[24]。DUFFNEY等[25]对215个候选基因的研究发现,19.5%是表观遗传调节因子,这表明几个致病变异可能导致多种疾病表型。双胞胎研究特别证明了表观遗传学可以调节疾病表型:一项针对50对同卵双胞胎ASD的研究,报道了大量ASD相关的差异甲基化区,在一些症状组常见的CpG位点有甲基化模式[26]。易感基因通常包括与甲基化有关的基因,如赖氨酸甲基转移酶5B和赖氨酸去甲基化酶6B;染色质重塑蛋白包括甲基化CG结合蛋白2(methyl-CpG-binding protein 2, MeCP2)、染色质域解旋酶DNA结合蛋白8(chromodomain helicase DNA-binding protein 8, CHD8)等[27]。这些蛋白质的作用靶点从几个到数百个不等,通常包括与ASD有关的通路,比如突触形成。以MeCP2为例,MeCP2是一种染色质修饰剂,与ASD密切相关。在健康人中,MeCP2的结合作用可以调节许多具有突触功能的基因,如BDNF、γ-氨基丁酸A受体β3亚基(gamma-aminobutyric acid receptor beta 3, GABRB3)、胰岛素样生长因子结合蛋白3(IGF binding protein 3, IGFBP3)[28-29]。另外,MeCP2是发育过程中调节谷氨酸能突触形成的限速因子[30]。GO等[31]发现,宫内暴露于丙戊酸的大鼠,通过上调Wnt1的表达和激活GSK-3β/β-catenin通路,导致大头畸形,从而促进神经前体细胞的增殖和延迟神经发生。另一项研究发现,丙戊酸通过两种转录机制增加BDNF,这两种转录机制涉及MeCP2和组织纤维蛋白溶酶原激活物(tissue-type plasminogen activator, tPA)。研究提出,BDNF的增加可以改变突触的生长,损害突触的形成[32]。因此,表观遗传学可以对生物体的转录组产生深远地影响。即使是一个表观遗传调控基因中的致病变异,或环境影响都可能导致广泛的基因失调。表观遗传调控因子本身可以引起疾病,但它们也可能通过影响危险基因的表达而加重或改善疾病表型。DNA甲基化作为表观遗传机制之一,可通过一些候选基因如MeCP2、泛素蛋白连接酶E3A(ubiquitin protein ligase E3A, UBE3A)、CHD8、活性依赖性神经保护蛋白同源框(activity-dependent neuroprotector, ADNP)和BDNF在ASD中发挥作用[33]。在DNA甲基化过程中,DNA甲基转移酶(DNA methyltransferases, DNMTs)催化嘧啶环5位的胞嘧啶残基上加入a-ch3基团。这些CpG二核苷酸序列通常位于基因調控区域内或周围,称为CpG岛。DNA甲基化通常发生在这些调控区可导致转录抑制[34]。许多研究也阐明,DNA甲基化在成年人BDNF基因动态调节中的潜在作用:研究表明,DNA甲基化在活性依赖性BDNF调控中起着重要作用[35];研究还发现,BDNF启动子和基因内区域的甲基化改变与不同的行为趋势有关,如恐惧学习、记忆形成、应激性社会交往等[36]。因此,DNA甲基化可能参与了ASD患者BDNF活性的动态调节。
4 BDNF信号通路的神经保护作用
ASD被认为是一组早期神经异质性疾病。目前,神经病理学病因机制尚不明确,但对ASD患者死后尸检及大量动物实验、临床基因测序的研究表明,ASD患者存在神经元形态和细胞结构区域特异性异常。根据西蒙斯基金会自闭症研究计划基因数据库,基因检测技术的最新进展已经能够鉴定出与ASD相关的1000多个候选基因和拷贝数变异(copy number variation, CNV)位点[37]。据估计,在高达25%的ASD病例、染色体重排(包括罕见和新生CNV)和编码序列突变中可以确定遗传原因,分别占ASD患者的10%~20%和5%~10%[38]。许多ASD候选基因涉及基本细胞功能的许多方面,如染色质重塑、代谢、mRNA翻译可能会影响神经元过程,从神经发生到神经元迁移,轴突引导,树突生长以及突触形成和功能[39]。BDNF/TrkB在神经元存活、形态发生和可塑性中起着重要作用。BDNF与TrkB的结合激活多种细胞内信号通路,包括MAPK/ERK、PLCγ和PI3K/Akt通路[10]。MAPK/ERK信号级联调节神经元分化过程中蛋白质的合成。MAPK相关的信号也是激活ERK1/2和环磷腺苷效应元件结合蛋白(cAMP-response element binding protein, CREB)所必需的。这一通路不仅对早期反应基因表达(如c-Fos和ARC)至关重要[40],而且对细胞骨架蛋白合成(如ARC和cypin)以及海马神经元的树突生长和分支也至关重要[41]。PI3K/Akt相关通路发挥抗凋亡和前生存活性,并能调节N-甲基-D-天门冬胺酸受体(N-methyl-D-aspartic acid receptor, NMDA)依赖性突触可塑性。PI3K/Akt/mTOR级联通过调节蛋白质合成和细胞骨架发育,促进树突生长和分支[40]。PLCγ依赖途径激活Ca2+调素依赖蛋白激酶(CAM kinase, CAMK)和蛋白激酶C蛋白激酶(protein kinase C, PKC),随后增加1,2-二酰甘油(diacylglycerol, DAG)和Ca2+离子浓度。蛋白激酶C依赖途径可以增强突触可塑性[12]。BDNF/TrkB复合体激活代表Rho家族的GTP-ases,刺激肌动蛋白和微管的合成,从而导致神经纤维的生长[40]。
BDNF通过抑制gsk-3β和激活CREB来激活PI-3K/Akt和ERK通路发挥对细胞凋亡的保护作用[42]。BDNF能刺激CREB Ser133位点磷酸化而活化CREB,大量研究也表明,持续磷酸化活化的CREB才能与靶基因转录调控区CRE结合,而启动下游CREB依赖基因的转录,使包括与细胞生长、存活、正常轴突的功能维持等有关靶基因开放[43]。其中,内源性BDNF表达的增加、TrkB受体水平的上调,激活CREB,可进一步激活抗凋亡基因表达程序,Bcl-2家族蛋白中促抗凋亡成员在线粒体上与其他凋亡蛋白的相互作用,调控线粒体结构与功能的稳定性,促进神经营养因子介导的中枢神经存活,抑制神经元凋亡,发挥BDNF的神经保护作用[44]。BDNF和Ras蛋白的组成性激活可以阻止mk801诱导的未成熟神经元凋亡性死亡[45]。
神经递质是在突触传递中担当信使的重要化学物质,其类型、分布和含量的不同会对人类的思维、情感和行为产生影响。兴奋性(excitability, E)神经递质和抑制性(inhibitory, I)神经递质之间的平衡关系对脑功能的正常发挥起重要作用,E/I失衡可能与ASD发病密切相关[46]。在哺乳动物中枢神经系统(central nervous system, CNS)中,谷氨酸(glutamic acid, Glu)是最主要的興奋性神经递质,也是一种潜在的神经毒素,其引起的兴奋毒性可能导致神经细胞的死亡。为了保持突触传递的敏感性,Glu必须被及时清除。BDNF对海马神经元中Glu的保护作用是通过PI3K和MAPK信号通路介导。研究表明,低水平的NMDA受体刺激通过海马神经元中BDNF自分泌环保护海马神经元免受谷氨酸兴奋毒性。GABA能神经元指的是能够释放抑制性神经递质GABA的一类抑制性中间神经元的总称。GABA能神经元在脑中主要发挥抑制神经元活性的作用,因此,其对于维持正常的神经环路功能至关重要。证据表明,BDNF在γ-氨基丁酸(γ-aminobutyric acid, GABA)能神经元发育方面具有重要作用。BDNF及其激活的下游信号通路中的分子起到调节GABA能神经元数量、胞体大小、神经元迁移、树突轴突发育及突触成熟等作用[47]。丙戊酸钠(valproic acid, VPA)小鼠模型中不同发育时期E/I平衡的变化,参与E/I平衡的突触前和突触后兴奋性和抑制功能的典型标志物在发育过程中显著降低,反映了VPA暴露小鼠突触可塑性发育障碍。BDNF在VPA暴露组中的表达严重降低。在关键的E/I失衡期间使用外源性BDNF治疗改善了突触功能和自闭症样行为[48]。
5 中医药治疗ASD的研究进展
目前,治疗儿童ASD的方法主要是行为干预训练;配合利培酮等非典型抗精神药物改善情绪、攻击行为。本病康复周期漫长、照养负担大、预后往往不够理想。而中医药治疗ASD具有整体调节和多通道、多靶点的优势。但目前国内中药复方治疗儿童ASD报道多为临床观察,相关作用机制的实验研究主要涉及针灸疗法。因此,本文仅对部分单味中药、中药复方干预BDNF信号通路改善与ASD相关的伴随症状,或针灸干预BDNF信号通路改善儿童ASD核心症状进展的实验研究进行归纳整理,为明确中医药治疗ASD作用机制提供新思路。
5.1 单味中药
5.1.1 姜黄 姜黄为姜科姜黄属植物姜黄的干燥根茎。其味辛,苦,温,归脾、肝经,有破血行气、通经止痛之功。姜黄素为其主要化学成分,现代药理学研究证实,其活性成分具有抗氧化、抗炎等作用[49]。陈淑娟等[50]通过实验研究发现,通过2周腹腔注射姜黄素能有效改善ASD模型小鼠重复刻板行为及社会交流障碍;并且姜黄素干预后ASD模型鼠大脑颞叶皮质BDNF阳性细胞IOD值增加(P<0.05)。推测姜黄素通过增加BDNF表达,上调BDNF-Akt-Bcl2抗凋亡信号通路,抑制神经胶质细胞、小脑浦肯野细胞凋亡,发挥对ASD的治疗作用。
5.1.2 何首乌 何首乌是蓼科何首乌属植物干燥块根。历代本草载其味苦、涩,性温。归肝、心、肾经,生用解毒消痈,润肠通便,制用补肝肾,益精血,乌须发,强筋骨。何首乌苷是其最主要的药理活性成分,化学名称为二苯乙烯苷;在该植物中的含量极高,同时药理活性清晰。现代药理学研究发现,其在抗氧化、抑制细胞凋亡、神经保护以及改善血管功能和增强学习记忆能力等方面具有重要作用[51]。李茜茜等[52]通过细胞实验发现,何首乌苷预先处理的氧化损伤大鼠海马神经元核固缩细胞的数目或核溶解成碎片明显减少,统计显示预处理组的细胞凋亡率与H2O2损伤组相比下降24%(P<0.01)。当加入BDNF/TrkB信号转导通路阻断剂K252a后,神经元细胞存活率大幅度下降(P<0.01),细胞骨架形态呈损伤状态。表明何首乌苷可能通过激活BDNF/TrkB信号转导通路及维护神经元骨架的完整,实现对大鼠海马神经元氧化应激损伤的拮抗作用。
5.1.3 熟地黄 地黄是一种玄参科系植物地黄的干燥或新鲜块根,属草本药物之上品。熟地黄是由地黄酒炖蒸煮炮制而来,其药性微温,味甘甜,有益精填髓、补血滋阴的功效。熟地黄富含氨基酸、地黄素、糖类、梓醇等多种微量元素,具有改善记忆认知、提高免疫力、抗肿瘤等多种功能。熟地黄对中枢神经系统具有显著的抑制作用。据报道,从地黄中分离得到的一种环烯醚萜苷——梓醇,可减轻PC12细胞H2O2诱导的凋亡,通过抗氧化能力保护海马CA1区神经元免于死亡,并显著减轻认知障碍[53]。注意缺陷多动障碍(attention deficit and hyperactivity disorder, ADHD)表现为与年龄不相称的注意力易分散,注意广度缩小,不分场合的过度活动,情绪冲动并伴有认知障碍和学习困难。研究表明,ASD与ADHD两病存在共有的基因危险座和受影响的脑部区域[54]。袁海霞等[55]发现熟地黄煎水灌胃4周后,ADHD模型大鼠自发活动明显减少;与空白组相比,熟地黄组前额叶、纹状体中BDNF、TrkB mRNA和蛋白表达水平均显著提高(P<0.05);熟地黄可能通过增加BDNF、TrkB的表达来促进神经元生长、发育、成熟,从而起到控制ADHD多动、冲动的作用。
5.1.4 白芍 白芍是毛茛科植物芍药的干燥根茎,味苦、酸,微寒,归肝、脾经,具有养血敛阴、柔肝止痛之效。其主要化学成分包括单萜及其苷类、三萜类、黄酮类、鞣质类以及多糖类等化合物。芍药苷及芍药内酯苷属于单萜及其苷类化合物,是白芍中的主要化学物质,具有抗炎、神经保护、抗氧化等药理作用[56]。焦虑、抑郁情绪障碍是ASD患儿最常见的共患病之一[57],有研究证实ASD与重度抑郁存在遗传风险重叠[58]。多种情绪问题严重影响着患儿心理健康、社会交往及家庭关系。朱映黎等[59]研究发现,芍药苷及芍药内酯苷能显著上调肝郁证模型大鼠海马中BDNF水平,进而增加抑郁大鼠自发活动及探索行为,缓解其对陌生环境的恐惧感和紧张度。
5.2 中药复方研究
中医学古籍中没有“孤独症”的相应病名。现代医家根据ASD临床表现将其归于神志病范畴,并认为本病病位在心、脑,与肾、肝、脾等脏腑密切相关。病因病机为先天不足、胎毒浸淫,养护不当而致髓海空虚、痰蒙神窍、五脏功能失调。目前,关于中药复方治疗ASD的机制研究相对匮乏,本文拟总结中药复方基于BDNF信号通路治疗与ASD病因病机趋同的共患病的相关研究,以期为中药复方基于异病同治理论治疗ASD提供新思路。
5.2.1 温胆汤 温胆汤首载于唐代孙思邈的《备急千金要方》:“大病后,虚烦不得眠,此胆寒故也,宜服此温胆汤方,法半夏、竹茹、枳实各二两,橘皮三两,生姜四两,甘草片一两。”中医学认为痰火上扰、痰湿内阻、蒙蔽清窍则会导致神经系统疾病。因此,现代医家将温胆汤广泛应用于治疗儿童孤独症、抑郁症、失眠症、精神分裂症等神经系统疾病。阿依奴尔·吾买尔等[60]采用加味温胆汤配合行为教学训练治疗25例ASD患儿,治疗1个月后,患儿异常生活行为较治疗前减少。精神分裂症与ASD有共同的遗传风险因素和致病基因,是ASD常见共患病之一。高源等[61]研究发现温胆汤可能通过调节BDNF信号通路因子,上调BDNF的蛋白和mRNA表达水平,改善精神分裂症模型鼠的刻板行为,从而提高精神分裂症认知障碍模型鼠的学习记忆、认知功能。
5.2.2 大补元煎 大补元煎源自《景岳全書》,由人参、山药、熟地黄、杜仲、当归、山茱萸、枸杞子和炙甘草组成,为培元固本治法的代表方。中医学认为痴呆发病责之髓海空虚,与肾精不足所致ASD病机相似。何丽玲等[62]研究发现,给予大补元煎能增强痴呆小鼠海马突触可塑性、改善突触功能,并且机制与上调小鼠海马中 BDNF/TrkB/CREB 信号通路相关。
5.3 针刺研究
目前,针灸多为治疗ASD的辅助疗法。针灸治疗过程中辨证选穴,标本兼治,缓急兼顾,改善阴阳失衡状态,最终达到阴平阳秘。针刺头部穴位可疏经通络、平衡阴阳。百会穴为众多经脉交会穴,针刺可调节经气,增强记忆力;印堂则有明目宁心安神之功。罗彤[63]发现针刺百会、印堂可改善慢性应激抑郁模型大鼠的抑郁状态,提高了抑郁模型大鼠自主活动能力和空间探索能力,降低了抑郁模型大鼠快感缺失水平,其机制可能与海马中tPA/BDNF通路有关,实验中电针组海马区BDNF、TrkB蛋白含量显著高于空白组(P<0.01)。长强穴在脊柱骨的尾端,是督阳初始之处,可通任督,调肠腑。冯祥等[64]认为督脉阳虚、督脉不通与ASD发病相关。林燊[65]运用电针疗法以不同时长刺激ASD模型大鼠长强穴,可改善ASD大鼠自主活动,以电针20 s为单位刺激时长(累计干预15次)能改善ASD大鼠刻板重复、兴趣降低等异常行为模式;并能上调BDNF蛋白表达,下调Bcl-2蛋白表达,激活ASD大鼠海马区p-CREB、CREB蛋白表达引起针刺响应效应。
6 展望
目前,國内外都从遗传、环境等多方面对ASD的发病机制展开了大量的研究与探索,但是由于神经系统疾病发病机制的复杂性,具体病因仍不明确。现阶段研究发现,ASD患者外周血中BDNF水平变化,使得BDNF可能成为诊断及治疗ASD的潜在方向。从BDNF信号传导通路的异常状态进行切入,将会成为探索ASD病因的一个新目标。ASD可能存在BDNF信号通路传导异常,对BDNF信号传导通路在ASD中的作用机制进行深入挖掘,旨在发现ASD可能存在的发病新机制,为临床治疗ASD提供新靶点。
中医药目前对孤独症核心的研究较少,且多数研究缺乏远期疗效追踪。虽然,近年来关于中医药在治疗ASD患儿言语、认知、社交等问题的报道越来越多,但其疗效和优势仍难获认同,究其原因在于:其一,中医疗效评估多基于临床观察及问卷调查,缺少疾病改善的生物学数据支持;其二,临床治疗ASD的中药缺乏基础研究、药理机制不明,针灸推拿治疗的实验机制研究匮乏。因此,中医药关于ASD的研究,今后应在中医理论基础上,充分利用生物学、神经学、遗传学等现代学科,选取接近临床ASD的动物模型,进行严谨的科研设计及实验研究,明确中医药治疗ASD的作用机制,通过数据化的生物学评估指标证实中医药的切实临床疗效。
参考文献
[1] AMERICAN PSYCHIATRIC ASSOCIATION. Diagnostic and Statistical Manual of Mental Disorders: Fifth Edition[M]. Washington: American Psychiatric Publishing, 2013: 50-58.
[2] BAXTER A J, BRUGHA T S, ERSKINE H E, et al. The epidemiology and global burden of autism spectrum disorders[J]. Psychological Medicine, 2015, 45(3): 601-613.
[3] MASI A, DEMAYO M M, GLOZIER N, et al. An overview of autism spectrum disorder, heterogeneity and treatment options[J]. Neuroscience Bulletin, 2017, 33(2): 183-193.
[4] 邹 卓,刘 芸,黄浩宇,等.儿童孤独症谱系障碍流行现状和家庭干预的研究及策略[J].中国全科医学,2020,23(8):900-907.
[5] CYNTHIA, WETMORE. Localization of brain-derived neurotrophic factor mRNA to neurons in the brain by in situ hybridization[J]. Experimental Neurology, 1990, 109(2): 141-152.
[6] COLUCCI-D'AMATO L, SPERANZA L, VOLPICELLI F. Neurotrophic factor BDNF, physiological functions and therapeutic potential in depression, neurodegeneration and brain cancer[J]. International Journal of Molecular Sciences, 2020, 21(20): 7777.
[7] HUANG E J, REICHARDT L F. Neurotrophins: Roles in neuronal development and function[J]. Annual Review of Neuroscience, 2001, 24: 677-736.
[8] LEWIN G R, BARDE Y A. Physiology of the neurotrophins[J]. Annual Review of Neuroscience, 1996, 19(1): 289-317.
[9] DAVID R, KAPLAN. Neurotrophin signal transduction in the nervous system[J]. Current Opinion in Neurobiology, 2000, 10(3): 381-391.
[10] NUMAKAWA T, ODAKA H, ADACHI N. Actions of brain-derived neurotrophin factor in the neurogenesis and neuronal function, and its involvement in the pathophysiology of brain diseases[J]. International Journal of Molecular Sciences, 2018, 19(11): 3650.
[11] CHAO M V, HEMPSTEAD B L. p75 and Trk: A two-receptor system[J]. Trends in Neurosciences, 1995, 18(7): 321-326.
[12] KOWIA■SKI P, LIETZAU G, CZUBA E, et al. BDNF: A key factor with multipotent impact on brain signaling and synaptic plasticity[J]. Cellular and Molecular Neurobiology, 2018, 38(3): 579-593.
[13] BARBOSA A G, PRATESI R, PAZ G S C, et al. Assessment of BDNF serum levels as a diagnostic marker in children with autism spectrum disorder[J]. Scientific Reports, 2020, 10(1): 17348.
[14] CASTR?魪N M, LAMPINEN K E, MIETTINEN R, et al. BDNF regulates the expression of fragile X mental retardation protein mRNA in the hippocampus[J]. Neurobiology of Disease, 2002, 11(1): 221-229.
[15] UUTELA M, LINDHOLM J, RANTAM?魧KI T, et al. Distinctive behavioral and cellular responses to fluoxetine in the mouse model for Fragile X syndrome[J]. Frontiers in Cellular Neuroscience, 2014, 8: 150.
[16] LEAH, SELBY. Major defects in neocortical GABAergic inhibitory circuits in mice lacking the fragile X mental retardation protein[J]. Neuroscience Letters, 2007, 412(3): 227-232.
[17] PIETROPAOLO S, GOUBRAN M G, JOFFRE C, et al. Dietary supplementation of omega-3 fatty acids rescues fragile X phenotypes in Fmr1-Ko mice[J]. Psychoneuroendocrinology, 2014, 49: 119-129.
[18] SUN M K, HONGPAISAN J, ALKON D L. Rescue of synaptic phenotypes and spatial memory in young fragile X mice[J]. The Journal of Pharmacology and Experimental Therapeutics, 2016, 357(2): 300-310.
[19] REIM D, SCHMEISSER M J. Neurotrophic factors in mouse models of autism spectrum disorder: Focus on BDNF and IGF-1[J]. Advances in Anatomy, Embryology, and Cell Biology, 2017, 224: 121-134.
[20] HWANG S R, KIM C Y, SHIN K M, et al. Altered expression levels of neurodevelopmental proteins in fetal brains of BTBR T+tf/J mice with autism-like behavioral characteristics[J]. Journal of Toxicology and Environmental Health Part A, 2015, 78(8): 516-523.
[21] SKOGSTRAND K, HAGEN C M, BORBYE-LORENZEN N, et al. Reduced neonatal brain-derived neurotrophic factor is associated with autism spectrum disorders[J]. Translational Psychiatry, 2019, 9(1): 252.
[22] KATOH-SEMBA R, WAKAKO R, KOMORI T, et al. Age-related changes in BDNF protein levels in human serum: Differences between autism cases and normal controls[J]. International Journal of Developmental Neuroscience, 2007, 25(6): 367-372.
[23] SAGHAZADEH A, REZAEI N. Brain-derived neurotrophic factor levels in autism: A systematic review and meta-analysis[J]. Journal of Autism and Developmental Disorders, 2017, 47(4): 1018-1029.
[24] RYLAARSDAM L, GUEMEZ-GAMBOA A. Genetic causes and modifiers of autism spectrum disorder[J]. Frontiers in Cellular Neuroscience, 2019, 13: 385.
[25] DUFFNEY L J, VALDEZ P, TREMBLAY M W, et al. Epigenetics and autism spectrum disorder: A report of an autism case with mutation in H1 linker histone HIST1H1E and literature review[J]. American Journal of Medical Genetics Part B: Neuropsychiatric Genetics, 2018, 177(4): 426-433.
[26] WONG C C, MEABURN E L, RONALD A, et al. Methylomic analysis of monozygotic twins discordant for autism spectrum disorder and related behavioural traits[J]. Molecular Psychiatry, 2014, 19(4): 495-503.
[27] DE RUBEIS S, HE X, GOLDBERG A P, et al. Synaptic, transcriptional and chromatin genes disrupted in autism[J]. Nature, 2014, 515(7526): 209-215.
[28] SAMACO R C, HOGART A, LASALLE J M. Epigenetic overlap in autism-spectrum neurodevelopmental disorders: MeCP2 deficiency causes reduced expression of UBE3A and GABRB3[J]. Human Molecular Genetics, 2005, 14(4): 483-492.
[29] KUBOTA T, MOCHIZUKI K. Epigenetic effect of environmental factors on autism spectrum disorders[J]. International Journal of Environmental Research and Public Health, 2016, 13(5): 504.
[30] CHAO H T, ZOGHBI Y, ROSENMUND C. MeCP2 controls excitatory synaptic strength by regulating glutamatergic synapse number[J]. Neuron, 2007, 56(1): 58-65.
[31] SANG H, GO. Prenatal exposure to valproic acid increases the neural progenitor cell pool and induces macrocephaly in rat brain via a mechanism involving the GSK-3β/β-catenin pathway[J]. Neuropharmacology, 2012, 63(6): 1028-1041.
[32] KO H M, JIN Y, PARK H H, et al. Dual mechanisms for the regulation of brain-derived neurotrophic factor by valproic acid in neural progenitor cells[J]. The Korean Journal of Physiology & Pharmacology, 2018, 22(6): 679-688.
[33] WOODBURY-SMITH M, SCHERER S W. Progress in the genetics of autism spectrum disorder[J]. Developmental Medicine and Child Neurology, 2018, 60(5): 445-451.
[34] MIRANDA T B, JONES P A. DNA methylation: The nuts and bolts of repression[J]. Journal of Cellular Physiology, 2007, 213(2): 384-390.
[35] MARTINOWICH K, HATTORI D, WU H, et al. DNA methylation-related chromatin remodeling in activity-dependent BDNF gene regulation[J]. Science (New York, N Y), 2003, 302(5646): 890-893.
[36] LUBIN F D, ROTH T L, SWEATT J D. Epigenetic regulation of BDNF gene transcription in the consolidation of fear memory[J]. The Journal of Neuroscience, 2008, 28(42): 10576-10586.
[37] ARPI M N T, SIMPSON T I. SFARI genes and where to find them; modelling autism spectrum disorder specific gene expression dysregulation with RNA-seq data[J]. Scientific Reports, 2022, 12(1): 10158.
[38] BACCHELLI E, CAMELI C, VIGGIANO M, et al. An integrated analysis of rare cnv and exome variation in autism spectrum disorder using the infinium psycharray[J]. Scientific Reports, 2020, 10(1): 1-13.
[39] SATTERSTROM F K, KOSMICKI J A, WANG J B, et al. Large-scale exome sequencing study implicates both developmental and functional changes in the neurobiology of autism[J]. Cell, 2020, 180(3): 568-584. e23.
[40] GONZALEZ A, MOYA-ALVARADO G, GONZALEZ-BILLAUT C, et al. Cellular and molecular mechanisms regulating neuronal growth by brain-derived neurotrophic factor[J]. Cytoskeleton, 2016, 73(10): 612-628.
[41] KWON M, FERN?魣NDEZ J R, ZEGAREK G F, et al. BDNF-promoted increases in proximal dendrites occur via CREB-dependent transcriptional regulation of cypin[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2011, 31(26): 9735-9745.
[42] PANDYA C D, KUTIYANAWALLA A, PILLAI A. BDNF-TrkB signaling and neuroprotection in schizophrenia[J]. Asian Journal of Psychiatry, 2013, 6(1): 22-28.
[43] DEOGRACIAS R, ESPLIGUERO G, IGLESIAS T, et al. Expression of the neurotrophin receptor trkB is regulated by the cAMP/CREB pathway in neurons[J]. Molecular and Cellular Neurosciences, 2004, 26(3): 470-480.
[44] ESVALD E E, TUVIKENE J, SIRP A, et al. CREB family transcription factors are major mediators of BDNF transcriptional autoregulation in cortical neurons[J]. The Journal of Neuroscience, 2020, 40(7): 1405-1426.
[45] NUMAKAWA T, ODAKA H. Brain-derived neurotrophic factor signaling in the pathophysiology of Alzheimer's disease: Beneficial effects of flavonoids for neuroprotection[J]. International Journal of Molecular Sciences, 2021, 22(11): 5719.
[46] PORT R G, OBERMAN L M, ROBERTS T P. Revisiting the excitation/inhibition imbalance hypothesis of ASD through a clinical lens[J]. The British Journal of Radiology, 2019, 92(1101): 20180944.
[47] 楊恩璐,孙秉贵. BDNF及其下游通路与GABA能神经元发育相关性的研究进展[J].生命科学,2020,32(6):544-550.
[48] QI C C, CHEN A D, MAO H H, et al. Excitatory and inhibitory synaptic imbalance caused by brain-derived neurotrophic factor deficits during development in a valproic acid mouse model of autism[J]. Frontiers in molecular neuroscience, 2022, 15:1-19.
[49] 孙林林,乔 利,田振华,等.姜黄化学成分及药理作用研究进展[J].山东中医药大学学报,2019,43(2):207-212.
[50] 陈淑娟,姜志梅,张士岭,等.姜黄素对孤独症大鼠行为及脑源性神经营养因子表达的影响[J].实用儿科临床杂志,2012,27(15):1187-1189.
[51] 王 浩,杨 健,周良云,等.何首乌化学成分与药理作用研究进展[J].中国实验方剂学杂志,2019,25(13):192-205.
[52] 李茜茜,李 飞,郎修远,等.何首乌苷通过激活BDNF/TrkB信号通路拮抗H2O2诱导的大鼠海马神经元氧化损伤[J].天然产物研究与开发,2019,31(7):1163-1169.
[53] 陈思琦,李佳欣,吴鑫宇,等.熟地黄的药理学研究进展[J].化学工程师,2019,33(11):46-50.
[54] BRUCHHAGE M M K, BUCCI M P, BECKER E B E. Cerebellar involvement in autism and ADHD[M]//The Cerebellum: Disorders and Treatment. Amsterdam: Elsevier, 2018: 61-72.
[55] 袁海霞,倪新强,吴正治,等.基于“肾脑相关”探讨熟地黄对ADHD模型大鼠行为学的影响[J].中药材,2018,41(8):1970-1974.
[56] 王 倩,李柳潼,马永犇,等.白芍与赤芍化学成分和药理作用比较研究及质量標志物的预测分析[J].中国新药杂志,2021,30(12):1093-1098.
[57] 王菲菲,李 雪,刘 靖,等.孤独症幼儿的情绪行为问题研究[J].中国全科医学,2019,22(18):2189-2193.
[58] MORIMOTO Y, YAMAMOTO N, KANEGAE S, et al. Genetic overlap among autism spectrum disorders and other neuropsychiatric disorders[M]//Autism Spectrum Disorders. Brisbane: Exon Publications, 2021: 67-78.
[59] 朱映黎,王林元,王成龙,等.芍药内酯苷和芍药苷对慢性束缚应激大鼠神经营养因子以及一氧化氮影响的研究[J].中国中药杂志,2016,41(22):4240-4246.
[60] 阿依奴尔·吾买尔,刘兴盛.加味温胆汤配合教学训练矫治孤独症儿童异常行为21例[J].世界最新医学信息文摘,2015,15(48):138.
[61] 高 源,朱金华,张 媛,等.温胆汤对精神分裂症模型大鼠海马组织BDNF、CaMKⅡ表达的影响[J].中药药理与临床,2021,37(4):8-12.
[62] 何丽玲,龙清华,胡 慧,等.大补元煎通过上调BDNF/TrkB/CREB信号通路改善APP/PS1双转基因痴呆小鼠海马突触可塑性[J].中国实验方剂学杂志,2020,26(21):1-7.
[63] 罗 彤.电针对CUMS抑郁模型大鼠海马tPA/BDNF通路影响的实验研究[D].北京:北京中医药大学,2020.
[64] 冯 祥,李 桃,蒋全睿,等.基于“督脉入脑”理论探讨推拿干预孤独症谱系障碍的思路[J].湖南中医药大学学报,2022,42(3):401-405.
[65] 林 燊.电针不同刺激时长对自闭症大鼠BDNF-CREB相关信号通路的影响[D].福州:福建中医药大学,2020.
〔收稿日期〕2021-12-10
〔基金项目〕湖南省科技厅重点领域研发计划项目(2019SK2081);湖南省卫生健康委员会科研课题(202206010043);湖南中医药大学校极研究生创新课题(2022CX157)。
〔第一作者〕吴 吉,女,硕士研究生,研究方向:中医药防治儿科疾病。
〔通信作者〕*朱沁泉,女,博士研究生,主治医师,E-mail:121088153@qq.com;张 涤,男,主任医师,E-mail:2655357548@qq.com。
