茶渣蛋白提取物对吉富罗非鱼生长性能和生化指标的影响
2023-05-30魏汉张钰婷李伟强黄贞胜吕一鸣张晨
魏汉,张钰婷,李伟强,黄贞胜,吕一鸣,张晨
(1.福州大学生物科学与工程学院,福建 福州 350108;2.福建省食品生物技术创新工程技术研究中心,福建 福州 350108;3.福建大昌生物科技实业有限公司,福建 福州 350000)
0 引言
吉富罗非鱼(GIFT,Oreochromisniloticus)是中国水产养殖业中主要的罗非鱼品系之一,其养殖周期短、环境适应性强[1].我国水产养殖业越来越趋于集约化,高密度养殖模式导致吉富罗非鱼免疫力低下,出现鱼病爆发等问题[2].此外,我国水产饲用蛋白资源紧缺,且非粮型蛋白资源利用率极低,急需开发水产饲料蛋白资源[3].
饲料蛋白资源是水产养殖业发展的基础性资源,其需求缺口极大[4].茶渣是一种非粮型植物蛋白资源,其含有的茶多酚可增强鱼类免疫功能[5].我国每年加工产生的茶渣量超100万t,其中约含蛋白质25万t.然而,茶渣因存在适口性差、消化率低等问题,难以作为饲用蛋白资源[4].本课题组前期研究表明,采用碱法从茶渣中获得茶渣蛋白提取物(tea residue protein extract,TRPE),蛋白质提取率可高达95%[4].TRPE是一种优质、适口的易消化植物源蛋白[6],可作为蛋白源饲料或替抗饲料应用于水产养殖中.
水产饲料中蛋白源的组成主要为鱼粉和豆粕.鱼粉中的必需氨基酸含量高、消化率高[7].然而,鱼粉价格近年来持续走高[7].TRPE中的氨基酸含量较鱼粉低[4,8],但其生产成本(约1 000元·t-1)仅为鱼粉成本的十分之一[4,9].此外,豆粕作为植物源蛋白,其氨基酸组成合理、供应充足[8].TRPE中的氨基酸含量较豆粕更高[4,8],其成本仅为豆粕成本的三分之一[7,9].
本研究以TRPE分别替代饲料中不同含量的鱼粉和豆粕,通过测定吉富罗非鱼的生长指标、血清、肝脏的生化指标和非特异性免疫指标,分析TRPE对吉富罗非鱼生长性能、生化指标、非特异性免疫能力的影响.
1 试验材料与方法
1.1 试验材料
秘鲁鱼粉购自新乡市华畜商贸有限公司;大豆油购自益海嘉里金龙鱼粮油食品股份有限公司;绿茶渣由大闽食品(漳州)有限公司提供.TRPE的提取采用高温碱提酸沉法[4].饲料组分含量均以干物质为基础进行计算.
TRPE中含有45.0%(质量分数,下同)粗蛋白、13.3%糖、9.7%粗脂肪、3.6%多酚、9.9%灰分;鱼粉中含有67.6%粗蛋白、9.9%粗脂肪、17.4%灰分,多酚和糖未检出;豆粕中含有45.7%粗蛋白、28.4%糖、2.2%粗脂肪、2.3%灰分,多酚未检出.
TRPE、鱼粉、豆粕中的氨基酸质量分数分别为50.1%、58.6%、39.7%,必需氨基酸和限制性氨基酸的质量分数分别为23.2%、30.6%、17.9%.TRPE、鱼粉、豆粕中蛋氨酸和赖氨酸的质量分数差异较大,蛋氨酸质量分数分别为0.8%、1.9%、0.4%,赖氨酸质量分数分别为1.8%、4.8%、2.8%.其他氨基酸质量分数差异较小.
1.2 试验对象与日粮
试验所用鱼苗由广州港发水产有限公司提供.根据吉富罗非鱼的营养需求,配制基础饲料作为对照,标记为S0[10],具体参数如表1、2所示.用TRPE分别替代S0中15%、30%、45%、60%的鱼粉和50%的豆粕,配制成6种饲料作为试验组,分别标记为S15、S30、S45、S60、SD50.并将上述不同饲料喂养后的吉富罗非鱼分别标记为T0、T15、T30、T45、T60和TD50.

表1 鱼饲料原料组成
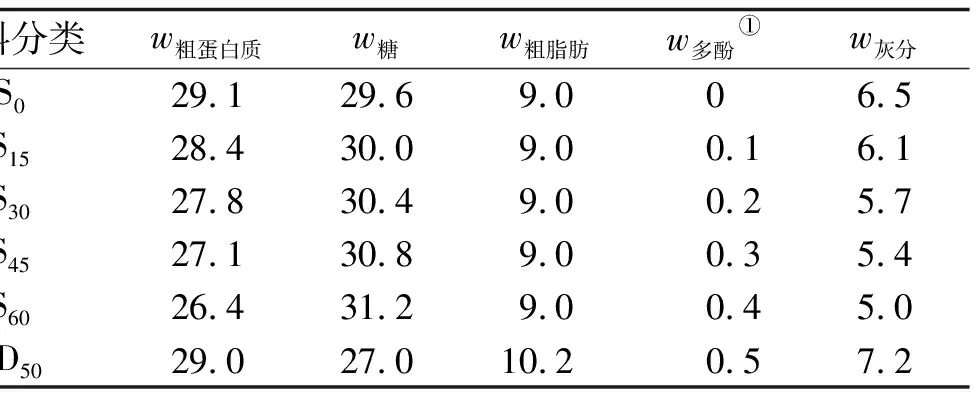
表2 鱼饲料营养水平
基础饲料和试验组饲料中的麦麸、玉米粉、米糠、大豆油的质量分数相同,分别为30%、10%、6%、2%.维生素与矿物质的质量分数为2%,维生素与矿物质预混料可为每100 g全价料提供维生素A、B1、B2、C、D、E的量分别为20、80、40、10、1 μg和1 mg,叶酸300 μg、胆碱10 mg、生物素30 μg、磷30 mg、铁600 μg、锌2 mg、硒200 μg、乳酸钙600 mg、磷酸钙400 mg、碘6 μg、蛋氨酸10 mg、赖氨酸16 mg、色氨酸10 mg.
1.3 饲养管理
养殖所用玻璃鱼缸尺寸(长×宽×高)为80 cm×40 cm×60 cm.水为提前经过3 d曝气且已加热至22 ℃的自来水.用商业膨化饲料(购自天津市晨辉饲料有限公司)进行7 d的前期驯化.随机挑选大小均匀、活泼,且初始体质量为(2.65±0.15)g的吉富罗非鱼540尾,将其均分为6组,每组中包含3个重复的平行组,每个平行组含30尾鱼.试验采用饱食投喂,每日投喂两次,投喂时间为9:00和17:00,每日投喂量为总体质量(每周日称取每缸鱼体总体质量)的3%.每日吸污、换水1次,换水量为原水量的三分之一.不定期测量水中的pH值和氨氮含量.试验期为60 d(2020.12.06—2021.02.05),在此期间不间断向水中充气,水温控制为(22±2)℃,pH值控制在6.9~7.4,氨氮质量浓度低于0.03 mg·L-1.
1.4 样品采集
从正式养殖起,每隔14 d对鱼体进行一次称重,并计算尾数.养殖结束后,禁食24 h后进行采样,每个平行组随机取10尾鱼.采样前,拭干鱼体体表水分,称量鱼体末体质量、体长,以计算鱼体生长指标.每缸鱼体均使用100 mg·L-1的MS222进行麻醉,并使用1 mL一次性注射器从尾静脉抽血(脊椎刺穿法)[5],以获得30~100 μL的血样.血样以进样针定量,用生理盐水稀释15倍后,立即静置于4 ℃的冰箱中.2 h后,将其离心以制备血清.鱼体取血后立即剖开腹腔,剥离内脏并称重.取样后,样品立即冻存于-80 ℃的冰箱中.所用材料和试剂均经无菌处理,离心条件均为3 000 r·min-1、10 min、4 ℃.
1.5 生理、生化和非特异性免疫指标测定
1.5.1生长、形体指标
吉富罗非鱼的生长、形体指标包括质量增加率(RWG)、特定生长率(RSG)、饲料系数(RFC)、成活率(RS)、肥满度(FC)、肝体比(IHS)和脏体比(IVS).RWG=[(mt-m0)/m0]×100%;RSG=[(lnmt-lnm0)/t]×100%;RFC=MFI/(mt-m0);RS=(Nt/N0)×100%;FC=(mb/L3)×100%;IHS=(mh/mb)×100%;IVS=(mv/mb)×100%.式中:t为饲喂天数;m0为初始体质量,单位为g;mt为末体质量,单位为g;MFI为每尾鱼体平均投喂量(干质量),单位为g;N0为初始尾数;Nt为最终尾数;L为鱼体末体长,单位为cm;mh为最终肝脏质量,单位为g;mv为最终内脏质量,单位为g;mb为最终体质量,单位为g.
1.5.2生化、非特异性免疫指标
总蛋白(TP)、葡萄糖(GLU)、碱性磷酸酶(AKP)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)、溶菌酶(LSZ)、总超氧化物歧化酶(T-SOD)、丙二醛(MDA)的测定均使用南京建成生物工程研究所提供的试剂盒.
1.6 数据处理
在 Microsoft Excel 2016 软件中,使用单因素方差分析方法和 Duncan法来进行数据统计和分析,以确定各组之间的显著性差异.结果以“平均值±标准差”的形式表示,并将显著性水平设置为P<0.05.
2 试验结果与分析
2.1 TRPE对吉富罗非鱼生长性能的影响
2.1.1平均体质量变化


表3 不同养殖时间吉富罗非鱼的平均体质量
随着时间增加,T0组与TD50组均表现出较大且相似的平均体质量变化(P>0.05),T15组次之,T60组变化最小.随着TRPE替代鱼粉量的不断增加,吉富罗非鱼平均体质量的增长不断变缓.
2.1.2生长指标
吉富罗非鱼的生长指标如表4所示.与T0组罗非鱼相比较,当TRPE替代鱼粉量为30%时,吉富罗非鱼(T30)的质量增加率和特定生长率有显著变化(P<0.05),其他指标无显著变化(P>0.05);当TRPE替代鱼粉量不低于45%时,吉富罗非鱼的各项生长指标均有显著变化(P<0.05);当TRPE替代豆粕量为50%时,吉富罗非鱼(TD50)的各项生长指标均无显著变化(P>0.05).

表4 吉富罗非鱼的生长指标
2.1.3肝体比、脏体比
吉富罗非鱼的肝体比(IHS)、脏体比(IVS)如表5所示.当TRPE替代鱼粉量不低于45%时,吉富罗非鱼的脏体比均显著高于T0组(P<0.05).所有试验组别吉富罗非鱼的肝体比差异均不具有统计学意义(P>0.05).
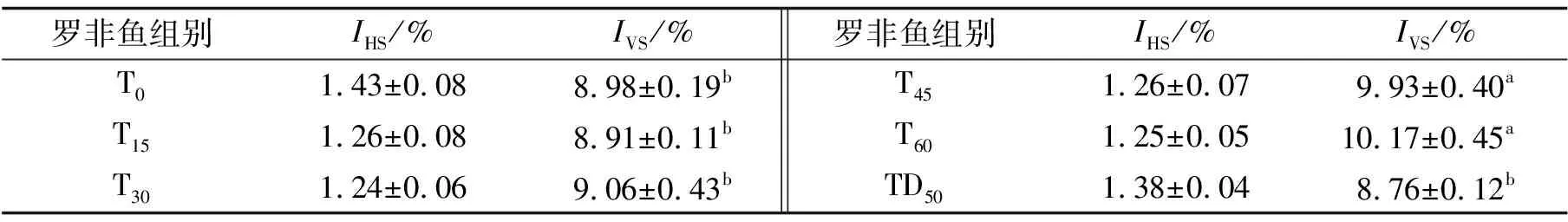
表5 吉富罗非鱼的肝体比和脏体比
2.2 TRPE对吉富罗非鱼生化指标的影响
2.2.1血清中的TP和GLU
吉富罗非鱼血清中TP的质量浓度(ρTP)和GLU的浓度(cGLU)如图1所示,二者差异均不具有统计学意义(P>0.05).

图1 吉富罗非鱼血清中的TP和GLUFig.1 TP and GLU in serum of GIFT 注:同组数据柱上标有不同字母表示差异具有统计学意义(P<0.05),出现相同字母或无字母表示差异不具有统计学意义(P>0.05),下同.
2.2.2转氨酶和AKP
1) 血清中的GOT、GPT和AKP.吉富罗非鱼血清中GOT、GPT和AKP的活力如图2所示.由图2(a)可知,随着TRPE替代鱼粉量的增加,鱼血清中GPT活力也随之升高.与T0组相比,当TRPE替代鱼粉量不低于60%时,吉富罗非鱼的GOT活力显著升高(P<0.05);仅当TRPE替代豆粕量为50%时,吉富罗非鱼的GPT无显著变化(P>0.05).由图2(b)可知,仅当TRPE替代鱼粉量不低于60%时,吉富罗非鱼的AKP显著低于T0组(P<0.05).

图2 吉富罗非鱼血清中的GOT、GPT和AKPFig.2 GOT,GPT and AKP in serum of GIFT
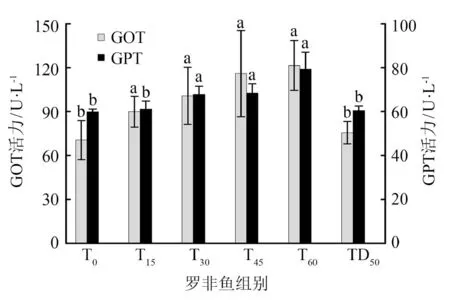
图3 吉富罗非鱼肝脏中转氨酶活力Fig.3 Transaminase activity in liver of GIFT
2) 肝脏中的GOT和GPT.吉富罗非鱼肝脏中GOT、GPT的活力如图3所示.与T0组相比,当TRPE替代鱼粉量不低于30%时,吉富罗非鱼的GOT显著升高(P<0.05).T15和TD50组吉富罗非鱼的GPT无显著变化(P>0.05).
2.3 TRPE对吉富罗非鱼非特异性免疫指标的影响
吉富罗非鱼血清中LSZ、T-SOD的活力和肝脏中MDA的含量(bMDA)如图4所示.由图4(a)可知,与T0组相比,T15组吉富罗非鱼的LSZ活力无明显变化(P>0.05);当TRPE替代鱼粉量不低于30%或豆粕量为50%时,吉富罗非鱼的LSZ活力显著升高(P<0.05).由图4(b)可知,当TRPE替代鱼粉量不低于45%时,吉富罗非鱼的T-SOD酶活力显著高于T0组(P<0.05).由图4(c)可知,各组吉富罗非鱼的MDA含量差异均无统计学意义(P>0.05).
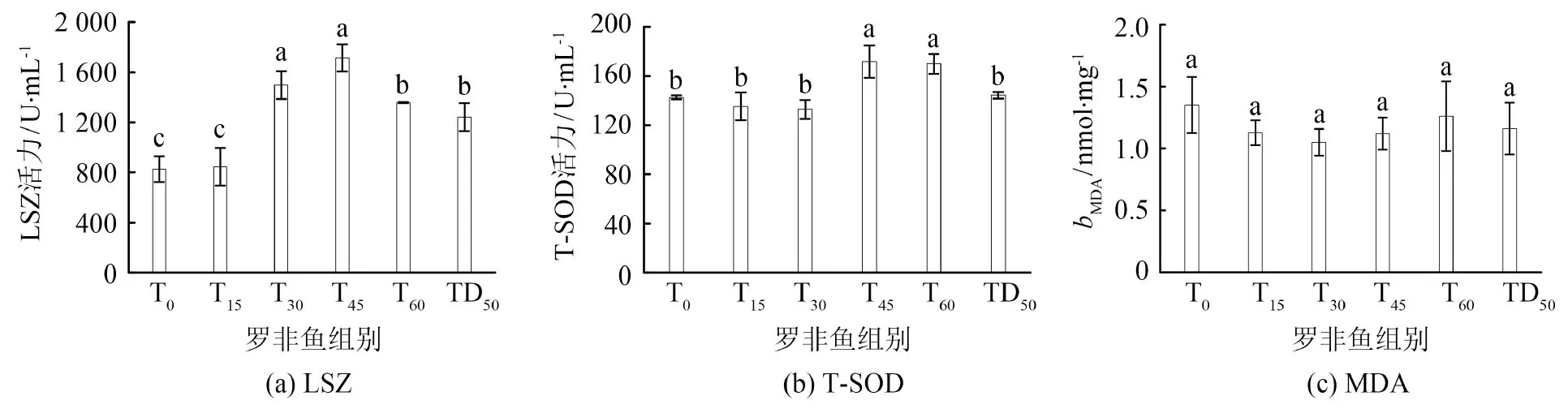
图4 吉富罗非鱼非特异性免疫指标Fig.4 Non-specific immune indices of GIFT
3 试验结果讨论
3.1 TRPE对吉富罗非鱼生长性能的影响
TRPE替代鱼粉量与吉富罗非鱼生长性能呈显著负相关.TRPE中的蛋氨酸和赖氨酸含量不足鱼粉的50%,但在罗非鱼生长性能中起重要调节作用[11].鱼粉作为鱼类同源性蛋白,其中包含促进生长发育的生长因子[11].因此,TRPE替代鱼粉量过大时,会影响吉富罗非鱼的生长性能.TRPE与豆粕中的蛋白质含量相似,且TRPE中的必需氨基酸水平略微高于豆粕.因此,当TRPE替代基础饲料中50%豆粕时,饲料中的组分含量基本无变化(见表2).
此外,由于本试验是在冬季进行的,在预实验中,若养殖水温为吉富罗非鱼最适温度28 ℃,鱼的摄食量虽然会大幅增加,但死亡率也会随之升高.为保证鱼的存活率,以便分析TRPE的作用,将养殖水温控制在(22±2)℃.在该条件下,虽然吉富罗非鱼摄食减少,鱼的体质量增加较小,但存活率极高.采用不同饲料进行养殖,吉富罗非鱼的存活率均在95%以上,符合水产养殖的要求.同时,T30、T60和TD50组吉富罗非鱼的存活率达到100%.因此,以TRPE替代鱼粉或豆粕不会影响吉富罗非鱼的存活率.
3.2 TRPE对吉富罗非鱼生理生化指标的影响
血清总蛋白具有维持血清渗透压、运输多种代谢物和营养物质的生理作用[12].血清葡萄糖为各种组织、脏器的正常运作提供动力[12].由图1可知,以TRPE替代基础饲料中的鱼粉或者豆粕,不会对罗非鱼血清中的TP和GLU含量产生显著影响.
GOT、GPT都属于胞内功能酶,是评价肝损伤程度的重要指标[13].AKP活性可作为检测肝脏和骨骼生长代谢状况的指标[13].TRPE与鱼粉中的必需氨基酸和限制性氨基酸含量不同,且TRPE中的氨基酸多数存在于与糖、多酚等多种化合物的结合态中[4].TRPE中的氨基酸被消化系统分解为氨类物质,这些氨类物质可能会影响肝细胞或某些组织的代谢,从而导致转氨酶活性增高[14].当TRPE替代鱼粉量增大(≥30%)后,必需氨基酸组成不合理,导致鱼体生长缓慢,AKP活力降低.然而,TD50组的AKP活力无显著变化,这可能是由于TRPE与豆粕均为植物蛋白质,且具有较为相似的物质组分和氨基酸组成.
3.3 TRPE对吉富罗非鱼非特异性免疫指标的影响
非特异性免疫是鱼类抵抗病原体的第一道屏障,其指标主要包括LSZ、T-SOD、MDA等[15].LSZ是一种代谢调控酶,能增强机体对病原体的识别和吞噬功能[15].以TRPE替代基础饲料中的部分鱼粉(≥30%),罗非鱼的LSZ活力显著提高.以TRPE替代基础饲料中50%的豆粕,罗非鱼的LSZ活力(1 242.2 U·mL-1)提升约1.5倍.这可能是由于茶多酚能促进干扰素、白细胞介素等的合成,可激活巨噬细胞、T/B淋巴细胞的免疫水平[16].
T-SOD活性可作为鱼类免疫系统状态的指示器,表征机体自身抗衰老、抗炎症和提高免疫功能的能力[17].TRPE替代鱼粉后,饲料中必需氨基酸水平下降,吉富罗非鱼体质量随之下降(见表3),而鱼所摄入的多酚含量始终不变,导致鱼血清中多酚浓度增大.多酚在鱼血清中的相对含量增加,鱼体抗性增强,从而导致T-SOD浓度升高.当TRPE替代基础饲料中50%的豆粕时,在吉富罗非鱼正常的生长过程中,TRPE中的多酚在其生理代谢周期中被消耗,导致T-SOD活性无显著变化.
MDA含量是反映机体非特异性免疫潜在能力的重要参数,可间接反映组织的过氧化损伤程度[18].以TRPE替代两种氮源后,不会引起鱼体肝脏中MDA含量的显著变化(P>0.05).
4 结语
TRPE可替代吉富罗非鱼基础饲料中15%的鱼粉或50%的豆粕.当TRPE替代基础饲料中50%的豆粕时,吉富罗非鱼非特异性免疫指标中溶菌酶活力(825.4 U·mL-1)提升约1.5倍,可明显增强吉富罗非鱼的免疫能力.
