TGF-β1、MTA 联合应用对人牙髓干细胞增殖和分化的影响
2023-05-30柴文宇李珍珍殷亮亮李春年
柴文宇,李珍珍,殷亮亮,李春年
牙髓干细胞(dental pulp stem cells,DPSCs)是一类存在于牙髓组织中具有较高自我分化能力及多向分化潜能的干细胞[1],在牙齿发育过程中,DPSCs 分化为成牙本质细胞后,不断分泌形成牙本质,保护牙髓免受有害刺激和细菌入侵[2],在活髓保存、牙髓再生和骨组织缺损修复等方面发挥重要作用。
活髓保存治疗常用的盖髓材料有氢氧化钙、MTA、iRoot BP 等。三氧化矿物凝聚体(mineral trioxide aggregate,MTA)因其具有优越的生物相容性、抗菌性、抗炎性、封闭性及诱导牙源性干细胞成牙/成骨分化的能力逐渐应用于活髓保存治疗[3]。有研究发现,MTA 盖髓成功率为80.5%,显著高于氢氧化钙[4],且MTA 诱导牙髓组织形成牙本质桥的频率更高,形成的牙本质更均匀、孔隙少[3,5]。MTA 较多的应用于直接盖髓术、牙髓切断术、穿孔修补和根尖屏障等治疗过程中[6],对于活髓保存的治疗效果显著。
转化生长因子β1(transforming growth factorβ1,TGF-β1)是牙本质中含量最丰富的生长因子之一,参与了牙齿生长发育过程,同时在创伤愈合、血管生成、细胞外基质生成、促进骨髓干细胞增殖和分化以及矿化组织修复等方面发挥着重要作用[7]。TGF-β1 是牙胚上皮-间充质相互作用过程中的一种信号分子,对成牙本质细胞分化和牙本质基质的分泌有促进作用,能够诱导DPSCs 向成牙本质细胞分化和修复性牙本质形成[8],在牙齿发生病变后,TGF-β1 从脱矿牙本质中释放出来参与抗炎反应。本研究将TGF-β1 与MTA 联合后,处理体外培养的DPSCs,探讨对DPSCs 增殖和分化的影响,通过研究TGF-β1、MTA 促进体外培养人牙髓干细胞的分化,为活髓保存时促进人牙髓细胞分化提供实验参考。
1 材料和方法
1.1 主要试剂和材料 细胞培养箱(美国Thermo公司);倒置相差显微镜(德国ZEISS 公司);Synergy-TH 酶标仪(美国Biotech 公司);低温高速离心机(美国Thermo 公司);6 孔培养板(美国Thermo Fisher 公司);96 孔培养板(美国Thermo Fisher 公司);α-MEM 培养基(美国Gibco 公司);MTA(美国Pro Root Dentsply 公司);胎牛血清(以色列BI公司);PBS(以色列BI公司);重组人转化生长因子β1(苏州近岸蛋白质公司);茜素红染色液(北京索莱宝公司);油红O 染色液(北京索莱宝公司)
1.2 hDPSCs 的分离、培养和提纯
1.2.1 分离培养 选自河北医科大学口腔医院,收集年龄为15-25 岁患者因正畸或阻生需拔除的前磨牙或第三磨牙。本研究得到医院伦理委员会批准(批准号:2020-027)。将离体牙迅速转移至超净工作台内,取出牙髓组织,剪碎后加入0.5ml的I 型胶原酶(3g/L)和中性蛋白酶(4g/L),消化约40min,终止消化,离心,加入培养基重悬细胞,于37℃恒温培养箱内培养细胞。
1.2.2 细胞提纯 取对数生长期的hDPSCs,有限稀释法克隆提纯细胞,将小于10 个/ml 的细胞悬液接种于96 孔板中,每孔加100μl 细胞悬液。24h 后,挑选只含1 个细胞的孔,做标记,在标记孔内加100μl 培养液,继续培养。待单克隆细胞面积扩大至孔底面积的50%以上时,将多个标记孔内的单克隆细胞混合扩大培养,获得纯化后的hDPSCs。
1.3 hDPSCs 的鉴定
1.3.1 表面标记物鉴定 将P3 代细胞消化、离心、重悬后,调整浓度为1×106个/ml;并转移1ml 至EP 管内,每个EP 管内加入5μl CD34、CD90、CD44、CD45 抗体和同型对照,混匀,室温下避光孵育20min,清洗并离心,用500μl PBS 重悬细胞,转移至流式管内,用流式细胞仪鉴定细胞的表面标志物。
1.3.2 多潜能分化鉴定 取生长状况良好的P3 代hDPSCs 按照2×104个/ 孔的密度接种在包含2ml 完全培养基的6 孔板中。当细胞融合度达到70%~80%时,分别加入成骨诱导液(10%FBS+10nmol/L 地塞米松+50mg/L 维生素C+10μmol/L β-甘油磷酸钠+100U/ml 青霉素+100μg/ml 链霉素+α-MEM),进行成骨分化鉴定;加入成脂诱导液(10%FBS+10μmol/L 地塞米松+200μmol/L 吲哚美辛+10mg/L 胰岛素+0.5mmol/L IBMX+100U/ml 青霉素+100μg/ml 链霉素+α-MEM),进行成脂分化鉴定。诱导14d 后,分别用茜素红染液和油红O 染色,在显微镜下观察与拍照保存资料。
1.4 实验分组 取P3 代hDPSCs,随机分组,设置3个实验组,包括加入0.2mg/ml MTA的MTA组、加入5μg/L TGF-β1 的TGF-β1 组、同时加入0.2mg/ml MTA 和5μg/L TGF-β1 的MTA+TGF-β1 组。对照组加入完全培养液。
1.5 CCK-8 法检测细胞增殖 取生长状况良好的P3 代hDPSCs,以3~5×103个/孔的细胞密度接种于96 孔板。设置MTA 组、TGF-β1 组、MTA+TGF-β1 组和对照组,另设置1 个调零组只加培养液用于检测结果校正,每组设置5 个复孔。分别连续培养1d、3d、5d、7d 后,用酶标仪测定各个孔在450nm 处的吸光度值。
1.6 ALP 活性检测取生长良好的P3 代hDPSCs,以1×105个/ml 的密度接种于6孔板内,待细胞融合达80%后,分组,并设置成骨诱导液组,3 个实验组和成骨诱导液组的细胞培养液均为成骨诱导液。分别培养7d 和14d 后,每孔加入200μl RIPA 裂解液,离心,取上清备用。根据碱性磷酸酶检测试剂盒说明书(碧云天,中国)进行加样,用酶标仪检测各孔405nm 波长处的吸光度值。根据ALP 活性单位的定义,计算出ALP 的活性。
1.7 实时荧光定量反转录PCR(qRT-PCR)选取生长良好的P3 代hDPSCs,以3×105个/孔的细胞密度接种于6 孔板,待细胞生长良好贴壁后,分组,分别连续培养7d、14d。提取总RNA,逆转录合成cDNA,根据上海生工生物公司设计引物扩增DSPP、OC、Runx-2 基因。PCR 引物序列表参照表1,以GAPDH 为内参。

表1 引物序列表
1.8 统计学分析 采用SPSS26.0 软件进行统计学分析,检测结果以平均值±标准差表示,组间比较采用单因素方差分析,显著性检验水准为α=0.05,以P<0.05 为差异有统计学意义。
2 结果
2.1 hDPSCs 的分离培养与鉴定 采用改良组织块酶消化法成功培养出hDPSCs,大多呈长梭形或多角形,有细胞突起,体积较小,核呈卵圆形,核仁大而明显,传代后细胞多呈长梭形,细胞生长速度更快,细胞形态更为一致(图1)。
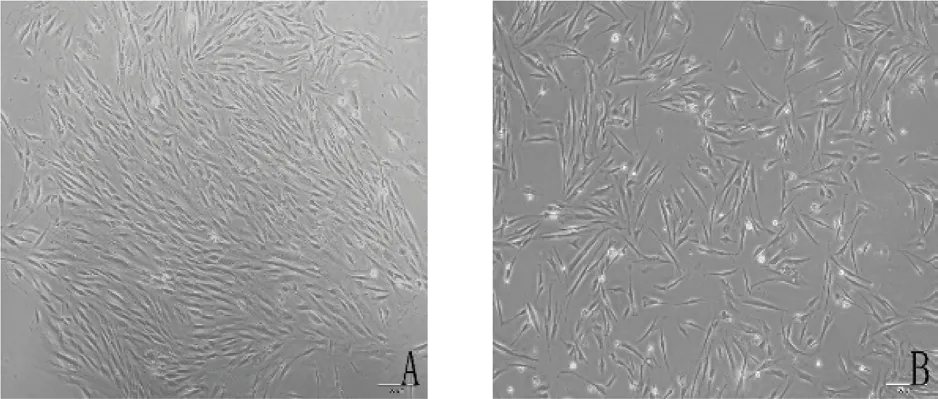
图1 人牙髓干细胞的培养(A.原代细胞培养7 天,×200;B.原代细胞传代后1 天,×200)
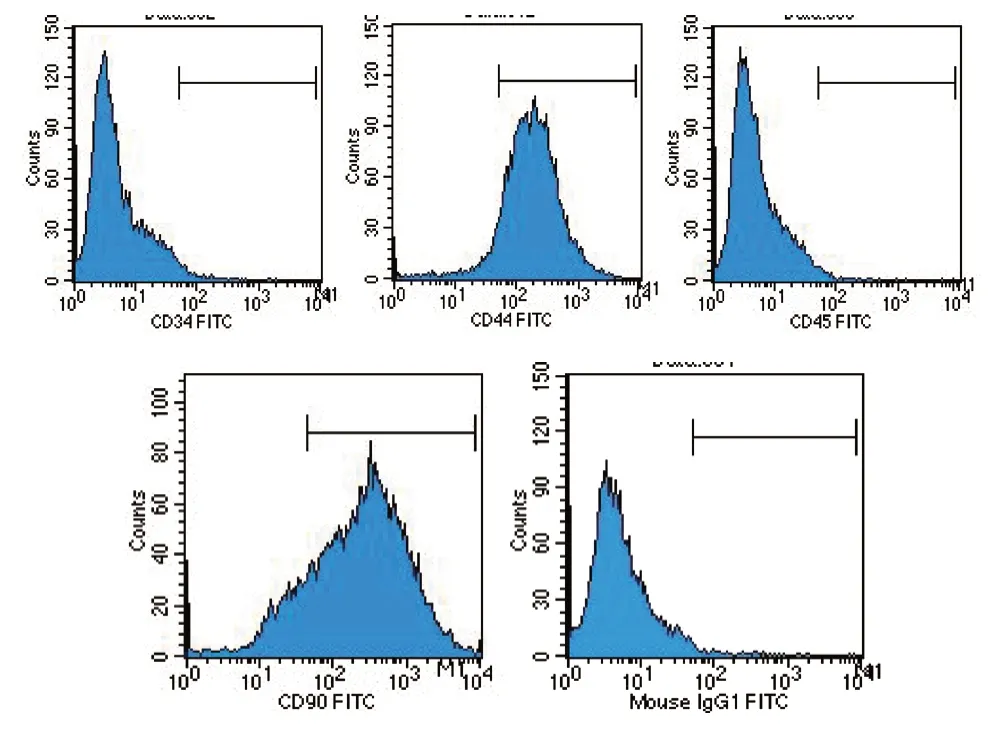
图2 流式细胞仪检测细胞表面标志物
2.2 hDPSCs 的鉴定结果
2.2.1 流式细胞仪鉴定结果 CD44(92.80%)、CD90(85.49%) 表达呈阳性,CD34(0.25%)、CD45(0.12%) 表达呈阴性,符合牙髓干细胞的特征。
2.2.2 hDPSCs 经过体外成骨诱导液的诱导,茜素红染色液染色可以看到有明显的矿化结节生成(图3),提示hDPSCs 能够成骨向分化。经过体外成脂诱导液的诱导,hDPSCs 能够成脂向分化,油红O 染色液染色后可以观察到脂滴形成(见图4)。
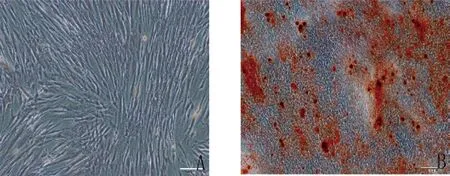
图3 牙髓干细胞成骨诱导14 天(A.对照组,×200;B.成骨诱导组,×100)
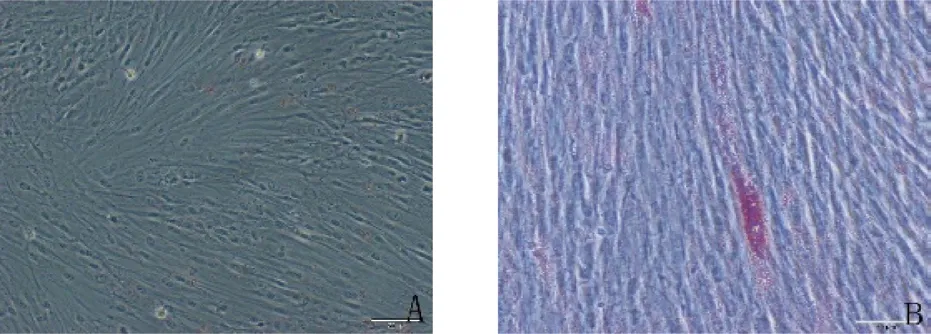
图4 人牙髓干细胞成脂诱导14 天(A.对照组,×200;B.成脂诱导组,×200)
2.3 TGF-β1、MTA 对hDPSCs 增殖的影响 CCK-8 检测结果显示,在第1 天,各组对hDPSCs 的增殖作用无统计学差异(P>0.05);在第3、5、7 天,各实验组的OD 值均高于对照组,差异具有统计学意义(P<0.05);自第3 天开始,各组OD 值不断升高,相比于第1、3、5 天的实验结果,第7 天OD 值最高(P<0.05);在第3、5、7 天,MTA+TGF-β1 组OD 值高于MTA 组和TGF-β1 组(P<0.05);在 第5、7 天时,TGF-β1组OD 值高于MTA 组(P<0.05)(见图5)。

图5 不同组别的细胞培养液作用于牙髓干细胞1、3、5、7 天后细胞增殖活性的比较(****:P <0.001)
2.4 TGF-β1、MTA 对hDPSCs 的ALP 活性的影响 在培养的第7 天和14 天,各实验组的ALP 活性比矿化组和对照组高(P<0.05);随着培养时间的延长,各组第14 天的ALP 活性较第7 天增高(P<0.05);MTA+TGF-β1 组的ALP 活性高于MTA组和TGF-β1 组,差异具有统计学意义(P<0.05);在培养的第14 天,与MTA 组相比,TGF-β1 组的hDPSCs 具有较高ALP 活性(P<0.05)(见图6)。
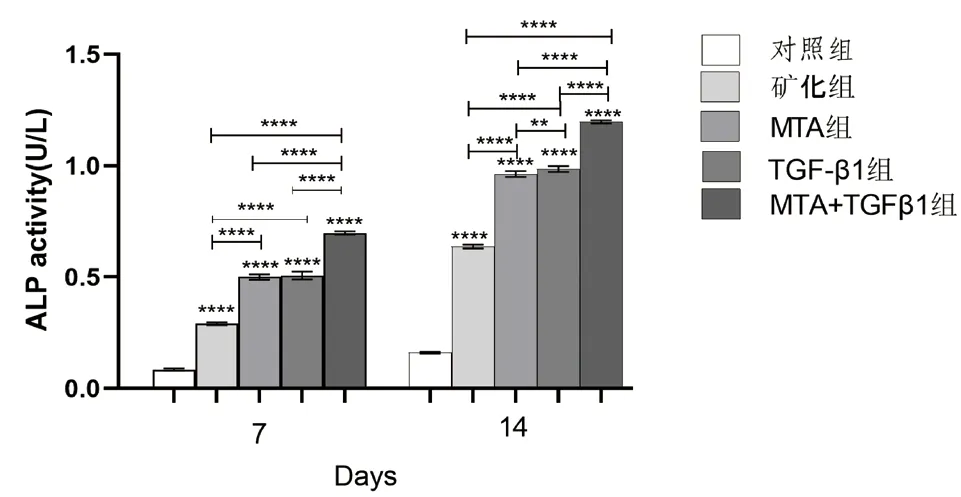
图6 不同组别的细胞培养液作用于牙髓干细胞7、14 天后ALP 表达量的比较(**:P <0.01;****:P <0.0001)
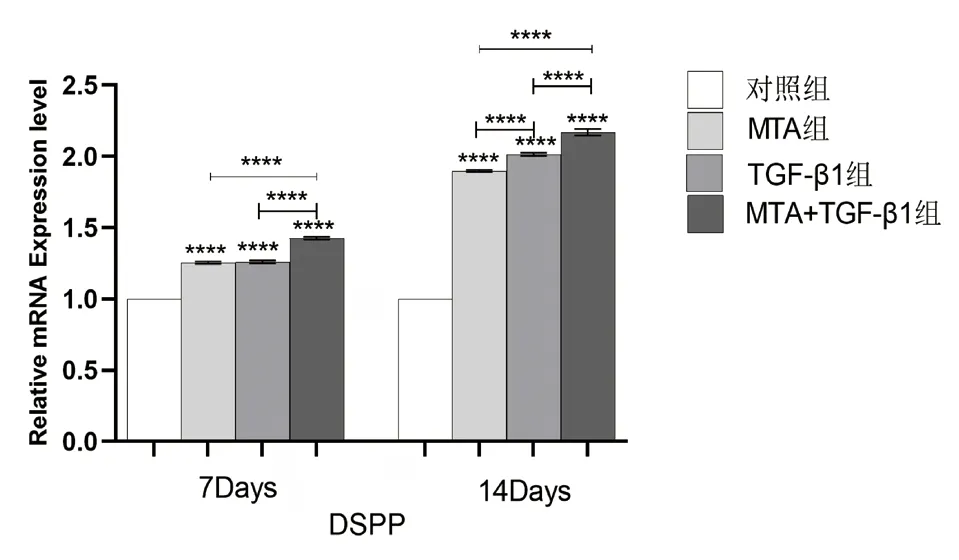
图7 不同组别的细胞培养液作用于牙髓干细胞7、14 天后DSPP 相对表达量的比较(****:P <0.0001)
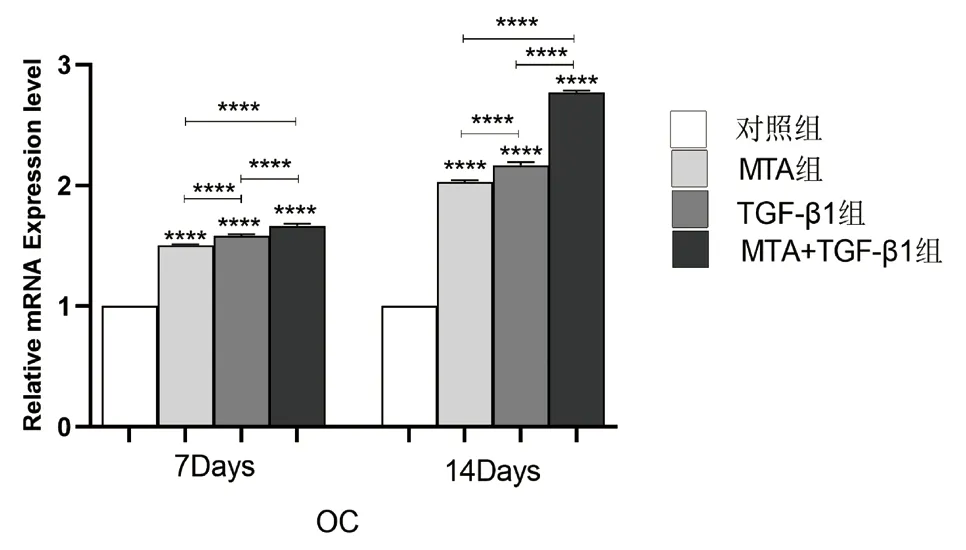
图8 不同组别的细胞培养液作用于牙髓干细胞7、14 天后OC 相对表达量的比较(****:P <0.0001)
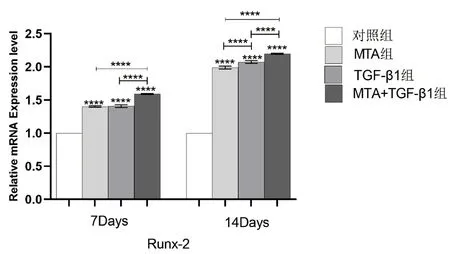
图9 不同组别的细胞培养液作用于牙髓干细胞7、14 天后Runx-2 相对表达量的比较(****:P <0.0001)
2.5 TGF-β1、MTA 对hDPSCs 中DSPP、OC、Runx-2 的mRNA 相对表达量的影响 实验结果(图7-9)所示:细胞培养7、14 天后,与对照组相比,各实验组的DSPP、OC、Runx-2 等成骨/ 成牙本质相关基因的相对表达量均上调(P<0.05);培养至14 天,各组的DSPP、OC、Runx-2 的相对表达量较第7天增高(P<0.05);MTA+TGF-β1 组细胞中DSPP、OC、Runx-2 的mRNA 相对表达量均高于MTA 组和TGF-β1 组,差异具有统计学意义(P<0.05)。
3 讨论
人牙髓干细胞是从人恒牙或乳牙的牙髓组织中分离出来的间充质干细胞[9],通常位于牙髓组织中的小血管和毛细血管周围。本研究采取改良组织块酶消化法[10]应用于细胞培养,hDPSCs 易于从牙髓组织中分离出来,进行原代培养。
MTA 能够促进软硬组织的再生,在活髓保存治疗中,MTA 诱导牙本质桥形成的频率较高[11]。Aeinehchi 等[12]研究发现,将MTA 和Ca(OH)2同时应用于恒牙直接盖随术后,MTA 组牙髓炎症反应比Ca(OH)2组轻微且6 个月后形成较厚的的牙本质桥,MTA 展现出良好的生物相容性、抗炎性和成骨性[13]。本实验致力于将TGF-β1 与MTA 联合应用于人牙髓组织的活髓保存,有望为临床治疗提供重要参考。
TGF-β1 是一种多功能细胞因子,对牙齿发育和对外界刺激的反应有调节作用,并参与牙齿的器官发生/形态发生过程[14,15]。TGF-β1 能够参与并维持牙髓组织内的生态平衡,同时可以调节hDPSCs 的增殖和成骨/成牙本质分化[16]。已有研究表明,TGF-β1 过表达可促进DPSCs 的增殖及成骨分化[17,18,19]。Farea 等[20]发 现,TGF-β1 可使人脱落乳牙来源的多能干细胞碱性磷酸酶,骨涎蛋白和骨钙素蛋白表达上调,矿物质沉积。有实验研究将小鼠体内的TGF-β1 基因敲除,小鼠DPSCs 中牙本质涎磷蛋白的表达水平下降,表现为牙本质发育缺陷、牙本质矿化不良等[21]。有学者将TGF-β1 和支架材料作为盖髓材料用于犬的牙齿露髓孔后,牙髓表面有修复性牙本质的形成[22]。综上,TGF-β1 有望用于临床活髓保存治疗,研究价值重大。
ALP 是矿化组织(骨、牙本质、牙骨质等)产生、再生和代谢等环节中的重要成分,在牙齿发育过程中,成牙本质细胞中ALP 活性逐渐升高,ALP 也是hDPSCs 向成牙本质细胞分化、细胞外基质沉积和牙本质逐渐形成的早期标志[23]。本研究中,在第7、14 天,MTA+TGF-β1 组的碱性磷酸酶活性始终高于其它组,MTA 和TGF-β1 之间可能存在协同作用。
本实验中选择DSPP、OC、Runx-2 作为hDPSCs 成骨/成牙本质分化的标志基因。DSPP主要由成牙本质细胞合成,是hDPSCs 成牙本质细胞分化走向成熟的标志性产物[24]。OC 有调节矿化和胶原合成的作用,在牙本质矿化过程中起重要作用[25]。Runx-2 在骨形成过程中调节软骨、成骨细胞和成牙本质细胞的分化以及多种细胞外基质蛋白的表达[26]。研究结果表明,TGF-β1 与MTA联合应用上调了hDPSCs 中DSPP、OC、Runx-2的mRNA 相对表达水平,优于单独应用。
有研究表明,胞外信号调节激酶/分裂原激活蛋白激酶信号通路(Extracellular signal-regulated kinase/mitogen-activated protein kinase,ERK/MAPK)在MTA 诱导hDPSCs 向成牙本质样细胞分化过程中发挥了作用。细胞内TGF-β 信号主要通过Smad依赖的信号通路传递,Smad4 基因突变会导致TGF-β 信号传导受阻,最终表现为牙根形成短、成牙本质细胞分化和牙本质形成的缺陷等情况[27]。如果敲除大鼠的TβR Ⅱ基因,大鼠牙齿的结构形态也会受到影响,出现牙本质发育不良,牙本质明显变薄,并在成牙本质细胞层下面形成了一层异位的纤维基质,最终导致牙髓闭塞[28]。除了经典的TGF-β/Smad 信号通路,ERK/MAPK、Rho 样GTPase 信号通路和PI3K/Akt 信号通路等非Smad信号途径也可能在TGF-β 激活过程中起着关键作用[29]。ERK/MAPK 能够介导多种细胞的增殖和迁移等生理过程,有研究证明,TGF-β1 促进牙髓细胞的增殖和分化的作用机制可能与ERK/MAPK信号通路相关,且具有时间和浓度依赖性[30]。TGF-β/Smad 信号通路和其他信号途径之间存在串扰已被证实,TGF-β1 通过Smad2/3 和MEK/ERK信号传导,影响尖端乳头干细胞的增殖、胶原代谢和分化[31]。Chang 等[32]发现,TGF-β1 可通过ALK5/Smad(2/3)、TAK1、p38 和MEK/ERK 信号通路调节人脱落乳牙干细胞的增殖、胶原代谢和分化等脱落行为。可能是由于MTA 和TGF-β1 存在相近的信号通路调节机制,使得MTA、TGF-β1联合应用的效果优于单独使用。
综上,TGF-β1 与MTA 联合应用促进人牙髓干细胞的增殖、分化的能力优于单独使用MTA 和TGF-β1,分子调控机制有待于进一步研究。
