水开菲尔粒中乳酸菌的分离及其发酵荔枝汁的特性分析
2023-05-30刘芸曹宜阮传清
刘芸 曹宜 阮传清


摘 要:乳酸菌發酵能保留荔枝原有风味,并赋予其全新储存性能和营养价值。为拓展发酵剂资源,经MC培养基分离,形态学观察、生理生化特性和16s rDNA基因序列分析,从水开菲尔粒中分离出类干酪乳酪杆菌坚韧亚种FJAT54886(Lacticaseibacillus paracasei subsp.tolerans FJAT54886)和红条液体乳杆菌FJAT54887(Liquorilactobacillus satsumensis FJAT54887)。这2株菌与适合于植物原料发酵的植物乳植物杆菌FJAT54898(Lactiplantibacillus plantarum FJAT54898) 和类干酪乳杆菌类干酪亚种FJAT54854(Lacticaseibacillus paracasei subsp.paracasei FJAT54854)进行荔枝汁发酵特性的对比分析。结果表明:植物乳植物杆菌FJAT54898、类干酪乳酪杆菌类干酪亚种FJAT54854的活菌数增殖速度及最终活菌数均显著高于红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886(P<0.05),后两者最终活菌数为7.36 Lg(cfu·mL-1)和7.02 Lg(cfu·mL-1)。类干酪乳酪杆菌类干酪亚种FJAT 54854和植物乳植物杆菌FJAT54898的pH显著低于红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886(P<0.05),后两者pH分别为3.75和4.33。类干酪乳酪杆菌类干酪亚种FJAT54854和植物乳植物杆菌FJAT54898的酸度也高于红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886,后两者酸度分别为99.6ΟT和76.5ΟT。以上结果为荔枝汁发酵产品研发的菌株优选提供参考。
关键词:水开菲尔粒;菌种鉴定;类干酪乳酪杆菌坚韧亚种;红条液体乳杆菌;荔枝汁;发酵
中图分类号:TS 275 文献标志码:A 文章编号:0253-2301(2023)02-0013-09
DOI: 10.13651/j.cnki.fjnykj.2023.02.003
Abstract: The fermentation of lactic acid bacteria can retain the original flavor of litchi and endow it with new storage performance and nutritional value. In order to expand the fermentation agent resources, Lacticaseibacillus paracaseis subsp.tolerans FJAT54886 and Liquorilactobacillus satsumensis FJAT54887 were isolated from water kefir grains by the separation of MC culturing medium, morphological observation, physiological and biochemical characteristics and 16s rDNA gene sequence analysis. Then, the fermentation characteristics of litchi juice were compared and analyzed among these two strains and Lactiplantibacillus plantarum FJAT54898 and Lacticaseibacillus paracaseis subsp.paracasei FJAT54854 which were suitable for the fermentation of plant materials. The results showed that the proliferation rate and final viable counts of Lactobacillus planturum FJAT54898 and Lacticaseibacillus paracaseis subsp.paracasei FJAT54854 were significantly higher than those of Liquorilactobacillus satsumensis FJAT54887 and Lacticaseibacillus paracaseis subsp.tolerans FJAT54886 (P<0.05). The final viable counts of the latter two was 7.36 Lg(cfu·mL-1) and 7.02 Lg(cfu·mL-1), respectively. The pH value of Lacticaseibacillus paracaseis subsp. paracasei FJAT54854 and Lactobacillus planturum FJAT54898 was significantly lower than that of Liquorilactobacillus satsumensis FJAT54887 and Lacticaseibacillus paracaseis subsp.tolerans FJAT54886 (P<0.05). The pH value of the latter two were 3.75 and 4.33, respectively. The acidity concentration of Lacticaseibacillus paracaseis subsp.paracasei FJAT54854 and Lactiplantibacillus plantarum FJAT54898 was also higher than that of Liquorilactobacillus satsumensis FJAT54887 and Lacticaseibacillus paracaseis subsp.tolerans FJAT54886. The acidity concentration of the latter two was 99.6ΟT and 76.5ΟT, respectively. The above results provided reference for the selection of strains for the development of litchi juice fermented products.
Key words: Water kefir grains; Strain identification; Lacticaseibacillus paracaseis subsp.tolerans; Liquorilactobacillus satsumensis; Litchi juice; Fermentation
中國是全球最大的荔枝生产国,福建是中国荔枝第三大产区,品种资源丰富。但荔枝是最不耐贮藏的果品之一,且生产地域集中、采摘期短,不利于荔枝产业的可持续发展[1]。对荔枝鲜果进行深加工是解决其季节性滞销和远途运输的重要途径。目前荔枝加工比例严重不足,深加工技术研发相对滞后,对原料的消化十分有限[2-3]。荔枝汁含糖量较高,为161.4 g·L-1[4],乳酸菌发酵可将荔枝汁中的糖转化为乳酸,并产生多种风味物质,在保留原有荔枝特有风味的同时,赋予其全新的储存性能和营养价值[5-6]。挖掘优良菌株,研究其发酵性能有助于提高荔枝发酵乳酸菌产品的营养价值、发酵风味、口感和组织状态[7]。目前,针对发酵荔枝汁的乳酸菌菌株优选研究较少。孙淑夷等[8]研究表明酵母和乳酸菌混合发酵有利于提高荔枝发酵液中SOD酶和淀粉酶的活性。胡珊等[9]发现荔枝内生肠膜明串珠菌Leuconostoc mesenteroides在荔枝汁中生长良好,能降解发酵液中的果糖和葡萄糖。其余研究主要集中在荔枝汁乳酸菌发酵剂配方和生产工艺的探讨[10-12]。
水开菲尔粒是乳酸菌来源之一,它是一种以乳杆菌为主的天然形成的复合菌系,菌相构成复杂[13]。同为传统发酵原种,目前研究较多的是牛奶开菲尔粒,它主要以乳品为发酵基质。而水开菲尔粒传统上被利用来发酵红糖水或果汁制作饮料,它可成为健康的含糖苏打饮料的替代品。目前有关水开菲尔粒的研究已有少量报道。梁新红等[14]从水开菲尔粒中分离得到1株能产生抑菌物质的植物乳杆菌Lactiplantibacillus plantarum,并对其产细菌素进行分析。高芜超等[15]对水开菲尔粒中的细菌进行多样性分析,并对分离得到的7株乳酸菌进行生理生化特征的研究。翟苗苗等[16]研究了水开菲尔粒发酵香蕉皮过程中成分的变化。通过研究水开菲尔粒来源的乳酸菌及其对荔枝汁的发酵性能,可为果汁的发酵加工拓展菌种资源,丰富果蔬发酵制品的种类和产品风味,为优化发酵工艺提供更多选择。
本研究从实验室保藏的水开菲尔粒中分离乳酸菌,观察菌株的形态特征、生理生化特征等生物学特性,结合菌株的16S rDNA序列分析,初步判断其分类学地位,并以荔枝汁为主要发酵基质,将所分离到的乳酸菌与本实验室前期筛选的适合于植物原料发酵的植物乳植物杆菌FJAT54898(Lactiplantibacillus plantarum FJAT54898)和类干酪乳酪杆菌类干酪亚种FJAT54854(Lacticaseibacillus paracasei subsp.paracasei FJAT54854)进行发酵特性的对比,为制备荔枝汁乳酸菌发酵产品提供参考。
1 材料与方法
1.1 供试材料
1.1.1 供试样品 供试水开菲尔粒由福建省农业科学院农业生物资源研究所保藏。
1.1.2 供试菌株 植物乳植物杆菌FJAT54898(Lactiplantibacillus plantarum FJAT54898)和类干酪乳酪杆菌类干酪亚种FJAT54854(Lacticaseibacillus paracasei subsp.paracasei FJAT54854)由福建省农业科学院农业生物资源研究所提供。
1.1.3 主要培养基及试剂 MRS肉汤培养基、MRS固体培养基、MC培养基(北京陆桥技术股份有限公司);太古红糖(成都太古糖业有限公司);API 50 CH 碳水化合物试剂条、API 50CHL 液体培养基(美国BioMerieux公司);Biospin细菌基因组DNA提取试剂盒(上海捷瑞生物工程有限公司);PCR扩增试剂[生工生物工程(上海)股份有限公司];16S rDNA扩增引物正向引物:5′AGAGTTTGATCCTGGCTCAG3′,反向引物:5′GGTTACCTTGTTACGACTT3′(上海生物工程有限公司)。
1.1.4 仪器与设备 ZHJHC1209C超净工作台(上海智城分析仪器制造有限公司);Bluepard隔水式恒温培养箱(上海一恒科技有限公司);聚合酶链式反应(polymerase chain reaction,PCR)扩增仪(德国耶拿分析仪器股份公司);Sartorius PB10 pH计(德国赛多利斯集团);JEOL扫描电子显微镜JSM6380Lv(日本电子株式会社)。
1.2 试验方法
1.2.1 水开菲尔粒的活化 将25 g红糖加入250 mL无菌水,充分摇匀溶解,经121℃高压灭菌15 min,冷却至室温。在无菌条件下,加入15 g水开菲尔菌粒,用无菌纱布包裹密封瓶口,30℃静置培养24 h。如糖水略显浑浊,不断有小气泡产生,则表示活化成功。用已灭菌的筛子过滤分离出活化的水开菲尔粒,加到新灭菌的糖水中继续活化培养。循环3次后供分离使用。
1.2.2 菌株的分离和纯化 在无菌操作条件下,称取1.0 g水开菲尔粒于9 mL无菌水中,用玻棒捣碎并强力振荡3~5 min,即成为10-1倍水开菲尔粒悬浊液,采用梯度稀释法稀释至浓度为10-6,取各个稀释度的悬浊液各0.1 mL,平板涂布于MC培养基,置于37℃恒温培养48 h后观察菌落形态。从平板上挑选菌落特征不同且具有溶钙圈的单菌落,经反复划线接种培养,获得纯培养物,并编号保存。
1.2.3 菌株的形态学特征 观察1.2.2中纯化的菌株在MRS和MC培养基上的菌落形态(色泽、大小、表面、边缘、凸起),用扫描电镜观察该菌的显微结构并拍照。
1.2.4 菌株的生理生化鉴定 采用革兰氏染色法,观察菌株染色情况,并进行过氧化氢酶检测。再对菌株采用API 50 CH碳水化合物试剂条进行生理生化测定,试验按照试剂盒说明书操作。提取MRS液体培养基中的乳酸菌菌株,先制备相当于2个麦式浊度的菌悬液,然后将菌悬液加到试剂条上的50个微量生化管中,上层用无菌石蜡油封,37℃静置培养,于24、48 h各观察1次结果,以48 h观察到的结果作为最终结果。
1.2.5 菌株的分子鉴定 16S rDNA序列的PCR扩增:取1.2.2中纯化的培养物,采用Biospin细菌基因组DNA提取试剂盒提取细菌基因组DNA,作为PCR扩增的模板,利用16S rDNA引物进行PCR扩增。PCR反应体系(25 μL):ddH2O18.7 μL、10×Taq Reaction Buffer 2.5 μL、10 mmol·L-1 dNTP 0.5 μL、引物各1 μL、Taq DNA Polymerase 0.3 μL、Temple 1 μL。PCR扩增程序:94℃预变性5 min,94℃变性30 s,55℃退火45 s,72℃延伸90 s,35个循环,最后72℃延伸10 min。用1.5%琼脂糖凝胶电泳检测PCR扩增结果,用凝胶图像分析系统观察并保存。
PCR产物测序及序列对比分析:将扩增成功的PCR产物送交福州铂尚生物技术有限公司测序。将测序结果通过网站GenBank(http://www.ncbi.nlm.nih.gov)进行序列比对分析,选择相关的参考菌株序列,再经Clustal X[17]对齐后,用软件Mega 5.0[18]进行聚类分析 (方法为:NeighborJoining,Nucleotide:JukesCantor),构建聚类树[19-21]。
1.2.6 乳酸菌发酵荔枝汁的特性分析 将以上鉴定的菌株、植物乳植物杆菌FJAT54898和类干酪乳酪杆菌类干酪亚种FJAT54854进行荔枝汁发酵试验。将不同菌株分别接入MRS液体培养基活化制作发酵种子,浓度调节至108 cfu·mL-1,以5%接菌量分别接种于新鲜荔枝汁,每瓶80 mL,于37℃恒温培养箱中静置发酵48 h,不同处理设3个重复,每12 h取样检验。每瓶取荔枝汁发酵液1 mL,用无菌水梯度稀释至10-7,取各个稀释度的悬浊液各0.1 mL,分别均匀涂布于MC培养基的平板上,置于37℃恒温培养72 h后统计乳酸菌活菌数。用pH计测定荔枝汁发酵液pH,参照GB 5009.239-2016《食品安全国家标准食品酸度的测定》测定酸度(ΟT)。
1.2.7 数据分析 在DPS数据处理系统中[22],采用Tukey多重比较方差分析方法对不同处理的活菌数、pH和酸度进行比较。
2 结果与分析
2.1 水开菲尔粒中乳酸菌的形態学特征分析
2.1.1 菌落形态特征 从水开菲尔粒中分离得到2株不同菌落形态特征的菌株,分别命名为FJAT54886和FJAT54887。水开菲尔粒中FJAT54886的菌落数为5.5×105 CFU·g-1,FJAT54887的菌落数为2.1×108 CFU·g-1。FJAT54887在MRS培养基上菌落大小为0.7~1.1 mm,白色,近圆形,微隆起,表面光滑湿润,边缘整齐,有光泽(图1),其在MC培养基上的菌落为0.7~1.2 mm,粉红色,近圆形,半透明,表面光滑,微隆起,边缘不齐,质地呈凝胶状(图2)。FJAT54886在MRS和MC培养基上的菌落形态相似(图3、4),菌落较FJAT54887大,为0.8~1.6 mm,近圆形,较FJAT54887更凸起,湿润,边缘整齐,有光泽,FJAT54886在MRS上为微黄色,在MC培养基上为淡粉色。
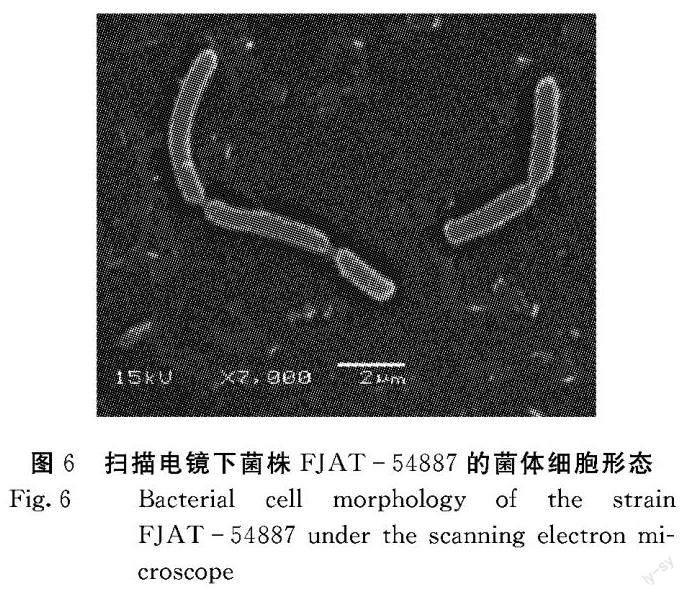
2.1.2 菌体细胞形态 扫描电镜显微形态观察结果显示:菌株FJAT54886的菌体为中长杆状,呈链状分布,相互缠绕,宽度约0.75 μm,无芽孢(图5)。菌株FJAT54887的菌体细胞为圆端直杆状或圆端弯曲杆状,宽度约0.73 μm,成对或呈链状分布,无芽孢(图6)。
2.2 水开菲尔粒中乳酸菌的生理生化鉴定
菌株FJAT54886和FJAT54887革兰氏染色反应呈阳性,过氧化氢酶反应呈阴性。再采用API 50CHL碳水化合物生理生化检测2株菌,反应结果见表1,菌株FJAT54886与D核糖、D半乳糖、D葡萄糖、D果糖、D甘露糖、甘露醇、甲基αD葡萄糖苷、N乙酰葡萄糖胺、七叶灵、水杨苷、D纤维二糖、D麦芽糖、D蔗糖、D海藻糖、菊粉、D松三糖、D松二糖和D塔格糖反应呈阳性。菌株FJAT54887与D葡萄糖、D果糖、D甘露糖、L山梨糖、甘露醇、七叶灵、水杨苷、D蔗糖、D海藻糖反应呈阳性。其余没列出的碳水化合物发酵试验结果为阴性。利用API LAB Plus自动判读系统鉴定菌株FJAT54886为类干酪乳酪杆菌Lacticaseibacillus paracasei,鉴定值为99.3%,而FJAT54887判读系统未能匹配到鉴定值高于80%的菌株。
2.3 水开菲尔粒中乳酸菌菌株的分子鉴定
菌株FJAT54886和FJAT54887的16S rDNA序列经同源性比对,利用NeighborJoin法构建系统发育树,并用Bootstrap method检验,检验次数设置为1000次(图7)。由系统发育树可知,FJAT54886与Lacticaseibacillus paracasei strain R094 (NR_025880)和Lacticaseibacillus paracasei strain ATCC 25302(NR_117987)处于同一节点,且Bootstrp method检验值为100%。因此,FJAT54886属于乳酪杆菌属Lacticaseibacillus,并与Lacticaseibacillus paracasei的3个菌株Lactobacillus paracasei subsp.tolerans strain JCM 1171(LC065035)、Lacticaseibacillus paracasei subsp.tolerans strain NBRC 15906 (NR 041054)和Lacticaseibacillus paracasei strain R094(NR 025880)处于系统发育树中相同的最小分枝上,与Lactobacillus paracasei subsp.tolerans strain JCM 1171(LC065035)的16S rDNA序列相似性最高,为99.93%。故将菌株FJAT54886所属的种鉴定为Lacticaseibacillus paracasei subsp.Tolerans(类干酪乳酪杆菌坚韧亚种)。
菌株FJAT54887与Liquorilactobacillus satsumensis的2个菌株 strain NRIC 0604 (NR_028658)和strain 7 (MW405857)在系统发育树上均处于邻近的小分枝上,16S rDNA序列相似性达99.44%。故将菌株FJAT54887鉴定为液体乳杆菌属的Liquorilactobacillus satsumensis(红条液体乳杆菌)。
2.4 水开菲尔粒中乳酸菌发酵荔枝汁的特性分析
2.4.1 不同乳酸菌发酵荔枝汁过程中活菌数量的变化 植物乳植物杆菌FJAT54898、类干酪乳酪杆菌类干酪亚种FJAT 54854、类干酪乳酪杆菌坚韧亚种FJAT54886和红条液体乳杆菌FJAT54887在荔枝汁发酵液中活菌数的变化见图8。接菌后12 h内,类干酪乳酪杆菌类干酪亚种FJAT 54854的增殖速度最快,显著高于其他菌株(P<0.05),类干酪乳酪杆菌坚韧亚种FJAT54886最慢。发酵至24 h时,4株菌发酵液的活菌数差异显著(P<0.05),植物乳植物杆菌FJAT54898活菌数迅速增长,超过其他菌株,高达9.22 Lg(cfu·mL-1),类干酪乳酪杆菌类干酪亚种FJAT54854、红条液体乳杆菌FJAT54887次之,类干酪乳酪杆菌坚韧亚种FJAT54886的活菌数依然最少,为7.35 Lg(cfu·mL-1)。发酵至24~36 h,4株菌均进入稳定期,保持少量增长或稳定。发酵至48 h时,植物乳植物杆菌FJAT54898、类干酪乳酪杆菌类干酪亚种FJAT54854保持稳定,红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886则进入衰亡期,活菌数明显下降,这可能是由于随着乳酸菌的数量增加,乳酸菌的次级代谢产物乳酸反过来抑制了这2株乳酸菌的繁殖。此时,4株菌荔枝汁发酵液中活菌数仍差异显著(P<0.05),由高到低分别为:发酵植物乳植物杆菌FJAT54898、类干酪乳酪杆菌类干酪亚种FJAT54854、红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886,后2者最终活菌数为7.36 Lg(cfu·mL-1)和7.02 Lg(cfu·mL-1)。
2.4.2 不同乳酸菌发酵荔枝汁过程中的pH变化 植物乳植物杆菌FJAT54898、类干酪乳酪杆菌类干酪亚种FJAT54854、类干酪乳酪杆菌坚韧亚种
FJAT54886和红条液体乳杆菌FJAT54887在荔枝汁发酵液中pH的变化见图9。整个培养过程,4株菌荔枝汁发酵液的pH均随发酵时间的延长有不同程度的降低,其中前24 h下降最快。发酵至24 h时,4株菌发酵液pH差异显著(P<0.05),类干酪乳酪杆菌类干酪亚种FJAT54854发酵液pH最低,为3.67,类干酪乳酪杆菌坚韧亚种FJAT54886 pH最高,为4.43。随后4株乳酸菌荔枝汁发酵液的pH下降速度均减缓。发酵至48 h时,4株菌发酵液的pH呈显著差异(P<0.05),由低到高分别是:类干酪乳酪杆菌类干酪亚种FJAT54854为3.46、植物乳植物杆菌FJAT54898为3.63、红条液体乳杆菌FJAT54887为3.75、类干酪乳酪杆菌坚韧亚种FJAT54886为4.33。
2.4.3 不同乳酸菌发酵荔枝汁过程中的酸度变化 植物乳植物杆菌FJAT54898、类干酪乳酪杆菌类干酪亚种FJAT54854、类干酪乳酪杆菌坚韧亚种
FJAT54886和红条液体乳杆菌FJAT54887在荔枝汁发酵液中酸度的变化见图10。与pH相反,随着乳酸菌的增殖,4株菌的荔枝汁发酵液的酸度均随发酵时间的延长有不同程度的升高。发酵12~36 h时,4种菌株荔枝汁发酵液的酸度上升幅度最大。接菌36 h后,类干酪乳酪杆菌坚韧亚种FJAT54886的酸度基本稳定在71.2~76.5ΟT,其余3种菌株的荔枝汁发酵液的酸度仍保持上升状态,趋势减缓。发酵至48 h时,类干酪乳酪杆菌类干酪亚种FJAT54854发酵液酸度最高,为140.3ΟT,植物乳植物杆菌FJAT54898和红条液体乳杆菌FJAT54887次之,分别为109.7ΟT和99.6ΟT,类干酪乳酪杆菌坚韧亚种FJAT54886酸度最低,为76.5ΟT。
3 结论与讨论
本研究从水开菲尔粒中分离出2株乳酸菌,经菌株生物学特性、生理生化特性的研究,以及16S rDNA序列同源性和系统发育树分析,菌株分别命名为Lacticaseibacillus paracasei subsp.Tolerans FJAT54886(類干酪乳酪杆菌坚韧亚种FJAT54886)和Liquorilactobacillus satsumensis FJAT54887 (红条液体乳杆菌FJAT54887)。这与高芜超等[15]的分离结果类似。高芜超等[15]对水开菲尔粒的研究表明乳酸菌是其优势菌,并从中分离出4株发酵乳杆菌、1株类干酪乳酪杆菌、1株哈尔滨乳杆菌和1株红条液体乳杆菌,并对这7株乳酸菌的形态特征及耐酸耐胆盐特性进行了研究。
目前鲜见对类干酪乳酪杆菌坚韧亚种和红条液体乳杆菌发酵特性的研究。本研究将这2株菌与本实验室前期筛选的适合于植物原料发酵的植物乳植物杆菌FJAT54898、类干酪乳酪杆菌类干酪亚种FJAT54854分别接入新鲜荔枝汁中发酵48 h,进行发酵特性的对比。研究表明荔枝汁发酵液中,植物乳植物杆菌FJAT54898、类干酪乳酪杆菌类干酪亚种FJAT54854的活菌数增殖速度及最终活菌数均显著高于红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886。乳酸菌的生长繁殖过程中利用糖类物质,产生大量乳酸,又引起了发酵液中pH值和酸度的相应变化[23],发酵过程中活菌数越高的荔枝汁发酵液pH下降最快,最终pH最低,而酸度上升最快,最终酸度最高。当发酵至48 h时,红条液体乳杆菌FJAT54887的活菌数为7.36 Lg(cfu·mL-1),pH为3.75、酸度为99.6ΟT,类干酪乳酪杆菌坚韧亚种FJAT54886活菌数为7.02 Lg(cfu·mL-1),pH为4.33,酸度为76.5ΟT。筛选优良菌种需要考察菌种的发酵速度、产酸能力以及产品最终的口感与风味[24]。虽然红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886在荔枝汁中的增殖能力,发酵速度和产酸能力弱于植物乳植物杆菌FJAT54898和类干酪乳酪杆菌类干酪亚种FJAT54854,但是酸度直接影响产品的风味和口感,是消费者对乳酸菌发酵饮品接受程度的一项重要指标[25-26]。一般的消费者感觉较适宜的乳酸菌饮料酸度为60~100ΟT[27],红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886荔枝汁酵液酸度适中,而植物乳植物杆菌FJAT54898和类干酪乳酪杆菌类干酪亚种FJAT54854荔枝汁发酵液的酸度分别为109.6ΟT和140.3ΟT,口感过酸,超出人们习惯接受的范围。同时,研究中还发现类干酪乳酪杆菌坚韧亚种FJAT54886在发酵过程具有产气活力,使饮品挥发更多荔枝香气,这将在提升产品感官评价方面具有积极的意义。因此,所筛选的红条液体乳杆菌FJAT54887和类干酪乳酪杆菌坚韧亚种FJAT54886作为果蔬类发酵微生物具有良好的应用前景,可为工业化开发的水开菲尔饮料提供实践依据。
参考文献:
[1]余蕾.正交试验优化荔枝乳酸菌饮料的配方[J].广西轻工业,2008(6): 3-4.
[2]移兰丽,余元善,肖更生,等.荔枝果汁饮料和荔枝原汁挥发性成分分析[J].热带作物学报,2016,37(4):822-828.
[3]余恺,胡卓炎,余小林,等.荔枝果汁产品开发与市场策略分析[J].食品工业科技,2010,31(3):405-409.
[4]岳强,曾新安,于淑娟,等.新鲜荔枝汁营养成分分析[J].食品工业科技,2006,27(4):173-174.
[5]赵蓓,李锋.发酵型复合果蔬乳饮料的制备工艺研究[J].食品安全导刊,2015(6):131-134.
[6]王磊,陈宇飞,刘长姣.发酵饮料的开发现状及研究前景[J].食品工业科技,2015,36(10):379-382.
[7]刘芸,刘波,朱育菁,等.黑豆酸奶发酵微生物鉴定与发酵特性研究[J].福建农业学报,2011,26(3):450-456.
[8]孙淑夷,赵雷,周沫霖,等.菌种和底物因素对荔枝发酵液主要功效酶活性的影响[J].食品安全质量检测学报,2016,7 (6):2465-2472.
[9]胡珊,黄皓,梁卫驱,等.荔枝内生乳酸菌的筛选、鉴定及发酵效果分析[J].南方农业学报,2019,50(1):137-143.
[10]梁立坚,刘廷琨,刘伟,等.荔枝果汁及其果汁饮料的研制[J].饮料工业,2004,7(4):32-35.
[11]白水宝,华英奇.荔枝果肉果汁饮料工艺研究[J].食品研究与开发,2001,22(4):32-33.
[12]郑欣,余元善,吴继军,等.不同乳酸菌在荔枝汁中的发酵特性研究[J].广东农业科学,2013(7):95-98.
[13]LAUREYS D,VUYST L D.Microbial species diversity,community dynamics,and metabolite kinetics of water Kefir fermentation[J].Appl Environ Microbiol,2014,80(8):2564-2572.
[14]梁新红,冉军舰,孙华迪,等.1株水开菲尔粒中植物乳杆菌的鉴定及产细菌素基因分析[J].食品科学,2018,39(18):145-151.
[15]高芫超,肖爱波,王成,等.水开菲尔和水开菲尔粒细菌多样性分析及乳酸菌分离鉴定[J].粮油食品科技,2022,30(1):182-189.
[16]翟苗苗,欧阳信,李梦茹,等.水开菲尔粒发酵香蕉皮过程中成分变化研究[J].中国酿造,2018,37(7):51-54.
[17]THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignement aided by quality analysis tools[J].Nucleic Acids Res,1997,25:4876-4882.
[18]TAMURA K,DUDLEY J,NEI M,et al.MEGA5: Molecular evolutionary genetics analysis (MEGA) software version 5.0[J].MolBiolEvol,2007,24 (24):1596-1599.
[19]JUKES T H,CANTOR C R.Evolution of protein molecules in mammalian protein metabolism[M].New York:Academic Press,1969,21-132.
[20]FELSENTEIN J.Confidence limits on phylogenies: an approach using the bootstrap[J].Evolution,1985,39(4):783-791.
[21]SAITOU N,NEI M.The neighborjoining method:a new method for reconstructing phylogenetic trees[J].MolBiolEvol,1987,4:406-425.
[22]唐启义.DPS数据处理系统[M].北京:科学出版社,2016.
[23]刘芸,刘波,刘欣,等.豆腐乳中乳酸菌的分离鉴定与发酵特性研究[J].食品安全检测学报,2019,10(9):2664-2671.
[24]蒋立文,卜尔红,侯艳梅.利用纯种乳酸菌制作泡萝卜的技术研究[J].中国酿造,2006(11):15-18.
[25]谢继志,肖宏彬.酸奶中乳酸菌数及酸度的检测与评价[J].中国乳品工业,2002,30(1):22-25.
[26]许谦.保存温度对酸奶品质及活性乳酸菌含量的影响[J].微生物学杂志,2014,34(4):67-70.
[27]倪晓宇,王建红.乳酸菌飲料在不同贮存温度下乳酸菌和酸度的变化分析[J].中国乳业,2014(6):51-53.
(责任编辑:柯文辉)
