基于网络药理学和实验验证探讨颐脑解郁方对抑郁症促炎细胞因子的影响
2023-05-30张双李骁群李江林赵瑞珍唐启盛
张双 李骁群 李江林 赵瑞珍 唐启盛
〔摘要〕 目的 運用网络药理学方法探讨颐脑解郁方对抑郁症促炎细胞因子的调控作用,并进行实验验证。方法 首先通过TCMSP、HERB数据库查找颐脑解郁方组成药物的主要活性成分,使用SwissTargetPrediction平台进行靶点预测;利用GeneCards数据库筛选抑郁症、炎症相关疾病基因;药物与疾病靶点的交集靶点为颐脑解郁方的潜在调控靶点,在Cytoscape 3.8.0软件中构建药物-活性成分-潜在调控靶点-疾病网络,应用CytoNCA插件计算度值,筛选重要的活性成分;利用STRING数据库构建潜在调控靶点的蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络,得到核心蛋白,之后利用R语言对潜在调控靶点进行GO与KEGG富集分析,绘制条形图和点图。最终选取较重要的交集核心蛋白进行实验验证,动物实验选用SPF级雄性大鼠,随机分为正常组、模型组、颐脑解郁方组(中药组)和盐酸氟西汀组(西药组),采用慢性不可预知温和刺激(chronic unpredictable mild stress, CUMS)联合孤养法复制抑郁模型,使用旷场实验评估大鼠的抑郁样行为,最后采集各组大鼠的血清进行指标检测。结果 共筛选出颐脑解郁方有效成分272种,作用靶点共计1167个,抑郁症、炎症相关靶点93个;颐脑解郁方的潜在调控靶点35个,较重要的活性成分为槲皮素和咖啡酸,核心蛋白为白介素-6(interleukin 6, IL-6)、干扰素(interferon, TNF)、Toll样受体4(Toll-like receptor 4, TLR4)、白介素-1β(interleukin 1β, IL-1β)等,GO富集和KEGG富集分析结果显示颐脑解郁方具有多靶点、多通路的特点,其中核因子κB(nuclear factor kappa-B, NF-κB)通路较为重要;动物实验发现颐脑解郁方能够降低抑郁大鼠血清中IL-6、TNF-α、IL-1β水平(P<0.05)。结论 颐脑解郁方可能通过降低血清中促炎细胞因子水平发挥抗抑郁的作用,是多种成分、多种通路和靶点共同作用的结果。
〔关键词〕 颐脑解郁方;抑郁症;促炎细胞因子;网络药理学;实验验证;大鼠
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.03.014
Effects of Yinao Jieyu Formula on pro-inflammatory factors for depression based on
network pharmacology and experimental verification
ZHANG Shuang1,2, LI Xiaoqun1,2, LI Jianglin1,2, ZHAO Ruizhen2*, TANG Qisheng2
1. Beijing University of Chinese Medicine, Beijing 100029, China; 2. Preventive and Treatment Center, The Third
Hospital of Beijing University of Chinese Medicine, Beijing 100029, China
〔Abstract〕 Objective To explore the effects of Yinao Jieyu Formula (YNJYF) on pro-inflammatory factors for depression based on network pharmacology and experimental verification. Methods The ingredients of YNJYF were obtained from TCMSP and HERB databases, and the targets were detected by SwissTargetPrediction. The genes related to depression and inflammation were obtained from GeneCards database. Intersection of ingredients and disease are the potential targets of YNJYF. The network of herbs, ingredients, potential targets and diseases was built by Cytoscape 3.8.0 software. And the degree was calculated by CytoNCA to find the important active ingredients. Then the protein-protein interaction (PPI) network about the potential targets through STRING database was constructed to obtain the core proteins, and the potential targets were analyzed by GO and KEGG with the R language, then the barplot and dotplot were drawn. Finally, the more important core proteins were selected to verify by experiment. SPF male rats were randomly divided into normal group, model group, YNJYF group (Chinese medicine group) and fluoxetine group (western medicine group). Chronic unpredictable mild stress (CUMS) and solitary rearing were used to replicate the depression model, and the depressive-like behavior was evaluated by open field experiment. Finally, the serum of each group was collected for test. Results A total of 272 active ingredients and 1167 targets of YNJYF were obtained. There were 93 targets related to depression and inflammation, and 35 potential targets of YNJYF. The important active ingredients were quercetin and caffeic acid. The core proteins were interleukin-6 (IL-6), interferon (TNF), Toll-like receptors 4 (TLR4), interleukin-1β (IL-1β), etc. GO and KEGG enrichment analysis showed that YNJYF had multiple targets and multiple pathways, and nuclear factor kappa-B (NF-κB) pathway was more important. Animal experiment showed that YNJYF could reduce the levels of IL-6, TNF-α and IL-1β in depressed rats. Conclusion YNJYF may play an antidepressant role by decreasing the level of pro-inflammatory cytokines in serum, which results from the joint action of multiple components, multiple targets and multiple pathways.
〔Keywords〕 Yinao Jieyu Formula; depression; pro-inflammatory cytokine; network pharmacology; experimental verification; rats
随着社会节奏的加快及竞争的加剧,抑郁症成为现今社会最主要的情感障碍疾病[1]。抑郁症以持续的情绪低落、快感缺失为主要表现,伴有不同程度的认知和行为改变,同时可伴有失眠、体质量改变等躯体症状以及幻觉、妄想等精神病性症状,甚至出现自杀行为,给家庭和社会带来沉重负担。目前,抑郁症发病机制仍不明确,近年来,炎症假说受到诸多关注且得到越来越多实验证据的支持[2-3]。炎症因子具有丰富的生物学特性,其可通过影响神经递质的代谢、下丘脑-垂体-肾上腺轴等多种途径参与抑郁症的生理病理过程[4]。临床研究表明,抑郁症患者外周血中炎症因子白介素-1β(interleukin 1β, IL-1β)、干扰素-α(interferon α, TNF-α)和白介素-6(interleukin 6, IL-6)水平明显高于正常对照组,而在给予抗抑郁治疗之后这些炎症因子的表达水平得到抑制[5]。因此,炎症细胞因子可能成为抑郁症治疗的新靶点。
颐脑解郁方是唐启盛教授多年临床经验的总结,对治疗抑郁症具有良好的临床疗效,且安全性好[6-7]。前期基础实验结果表明颐脑解郁方可改善慢性不可预知温和刺激(chronic unpredictable mild stress, CUMS)模型大鼠抑郁样表现[8-9],可调控模型大鼠的神经递质及信号因子的表达[8-10]。为进一步验证其与免疫反应间的关联,本研究采用网络药理学结合实验验证的方法观察颐脑解郁方对抑郁症炎症细胞因子的影响,丰富中医药抗抑郁治疗的科学理论和证据。
1 资料与方法
1.1 颐脑解郁方药物活性成分和作用靶点的获取
在中药系统药理学分析平台[11]( TCMSP,https://old.tcmsp-e.com/tcmsp.php)和本草组鉴平台[12](HERB, http://drug.ac.cn/)分別搜索“刺五加”“五味子”“郁金”“栀子”化学成分。TCMSP筛选条件设置为生物利用度(OB)≥30%,类药性(DL)≥0.18;HERB数据库中药物成分根据Lipinsk原则[13]在SwissADME数据库中进行筛选。将上述获得的中药成分通过SwissTargetPrediction平台预测靶点并导出。
1.2 抑郁症和炎症相关靶点的收集
以“depression”“depressive disorder”“major depressive disorder”和“inflammation”为检索词在GeneCards数据库(https://www.genecards.org)检索相关靶点导出并取交集。
1.3 药物活性成分与疾病共同靶点筛选
应用R语言中的VennDiagram数据包对颐脑解郁方药物活性成分靶点和抑郁症、炎症相关靶点进行筛选,获得共同靶点,共同靶点认为是颐脑解郁方对抑郁症促炎细胞因子的潜在调控靶点。
1.4 构建药物-活性成分-潜在调控靶点-疾病的数据网络
在Cytoscape 3.8.0中构建颐脑解郁方药物-活性成分-潜在调控靶点-疾病网络,使用CytoNCA插件对网络进行分析,根据Degree参数获得颐脑解郁方在调控抑郁症促炎细胞因子中发挥药效的主要活性成分。
1.5 蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络
利用STRING数据库构建颐脑解郁方调控抑郁症促炎细胞因子水平的潜在调控靶点的PPI网络,并筛选出核心蛋白。将潜在调控靶点录入数据库,物种选择“homo sapiens”,最低阈值设置为中等置信度0.4,其余参数不变,隐藏没有相互联系的节点,获得蛋白互作关系,导出PPI网络,保存TSV格式文件,使用R软件筛选核心蛋白。
1.6 潜在调控靶点的GO和KEGG通路富集分析
使用R语言的clusterProfiler及Bioconductor包[14]提供的GO通路和KEGG通路数据库进行信号通路富集分析。以P<0.05为条件进行信号通路富集分析,筛选出具有统计学意义的生物学过程和信号通路,并将富集结果可视化。
1.7 实验验证
1.7.1 实验动物 SPF级雄性Wistar大鼠30只,体质量(200±10) g,由北京维通利华实验动物技术有限公司提供,合格证编号:SYXK(京)2020-0036。保持室内温度、湿度固定,7:00~19:00光照(昼夜颠倒应激方法时段除外)。本研究由北京中医药大学实验动物伦理委员会审核通过,研究内容和过程涉及的实验动物均符合国家对医学实验动物的有关要求,伦理编号为BUCM-4-2021091308-3166。
1.7.2 材料 (1)药物:颐脑解郁方(药物组成为刺五加20 g、郁金10 g、栀子10 g、五味子10 g,颗粒剂由北京康仁堂制药有限公司提供,批号:20033601);盐酸氟西汀胶囊(规格:20 mg/粒,礼来苏州制药有限公司,国药准字J20170022)。
(2)试剂:放免试剂盒IL-1β(北京华英生物有限公司,批号:HY-100237);TNF-α(北京华英生物有限公司,批号:HY-10116);IL-6(北京华英生物有限公司,批号:HY-10105)。
(3)仪器:敞箱(自制,80 cm×80 cm×40 cm),夹尾器(自制),游泳水箱(自制,45 cm×33 cm×27 cm),恒温加热器(自制),空气振荡浴(哈尔滨东明医疗仪器厂,型号:HZQ-C),秒表计数器(上海晨光文具股份有限公司,型号:ARC925L8),SONY数码摄录一体机(日本索尼公司,型号:HDR-SR10E),单人单面洁净工作台(苏洁净化设备有限公司,型号:SW-CJ-ID)、电子天平(上海梅特勒-托利多仪器有限公司,型号:ME204),低温离心机(日本Beckman,型号:Avanti JXN-30),γ-911全自动放免计数仪(中国科技大学实业总公司,型号:GC-911)。
1.7.3 方法 (1)分组:大鼠适应性喂养1周,按随机数字表分为正常组、模型组、颐脑解郁方组(中药组)、盐酸氟西汀组(西药组),共4组。
(2)造模:采用CUMS联合孤养法制备抑郁大鼠模型[9]。CUMS方法:21 d内随机选用以下7种应激方法:夹尾1 min、45 ℃热环境5 min、昼夜颠倒、禁水24 h、禁食24 h、震荡环境30 min、4 ℃冰水游泳5 min,每种方法使用3次,保证每周1次、随机排序。孤养法:即大鼠单笼饲养。
(3)给药方法:根据参考文献于应激结束后开始干预,模型组、中药组、西药组开始分别灌胃双蒸水、颐脑解郁方、盐酸氟西汀[9-10]。颐脑解郁方颗粒和盐酸氟西汀在灌胃前使用双蒸水调配,浓度和灌胃剂量与课题组前期一致[10],颐脑解郁方药物浓度为0.62 g 生药/mL,盐酸氟西汀浓度为0.23 g/L。根据大鼠体质量变化调整灌胃量,灌胃量均为1 mL/100 g,连续灌胃28 d。正常组不予任何处理,正常自由饮水和进食。
(4)旷场实验:使用自制黑色敞箱进行实验,敞箱底面用白线划分为25个16 cm×16 cm方格。将大鼠置于箱子中央方格中,观察大鼠3 min的活动情况,记录大鼠的水平运动得分和垂直运动得分。水平运动得分计分规则:以大鼠穿越方格数(至少3爪进入方格)为水平运动得分,每格得1分;垂直运动得分计分规则:以大鼠前两肢直立次数为垂直运动得分,每直立1次得1分。每只测定结束后清理尿便并使用酒精消毒擦拭箱子内部,避免气味残留。
造模前、造模后和灌胃结束后,采用旷场实验进行行为学测试,符合条件者进入下一步实验过程。剔除死亡、衰弱、造模失败以及合并其他系统病变的大鼠后, 最终每组纳入6只进行实验测试。
1.7.4 统计学方法 采用SPSS 26.0统计软件进行处理,对所得数据资料进行分析,所有数据为计量资料,以“x±s”表示。组间比较先进行数据的正态性和方差齊性检验,方差不齐采用秩和检验,符合条件者采用单因素方差分析检验(one-way Anova),组间比较采用LSD方法,P<0.05为差异具有统计学意义。
2 结果
2.1 颐脑解郁方活性成分和作用靶点
在TCMSP和HERB数据库查找有效成分,通过筛选共获得刺五加有效活性成分9个,五味子有效活性成分59个,郁金有效活性成分148个,栀子有效活性成分72个,去除重复的成分,得到颐脑解郁方有效活性成分共计272个。使用SwissTargetPrediction数据库查找以上活性成分的靶点,筛选Probability>0.05的靶点,删除重复基因,共计1167个。
2.2 颐脑解郁方对抑郁症促炎细胞因子的潜在调控靶点
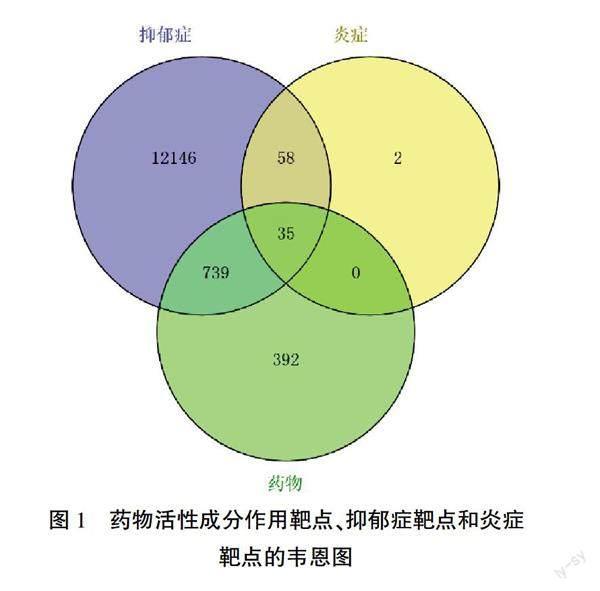
从GeneCards数据库收集抑郁症和炎症相关基因,分别得到12 978个、11 109个靶点,纳入Relevance score>10的靶点,分别得到1552个、95个。使用R语言的VennDiagram数据包中Venny函数绘制药物有效活性成分的作用靶点和抑郁症靶点、炎症靶点的交集,获得颐脑解郁方对抑郁症促炎细胞因子的潜在调控靶点35个。详见图1。
2.3 药物-活性成分-潜在调控靶点-疾病网络
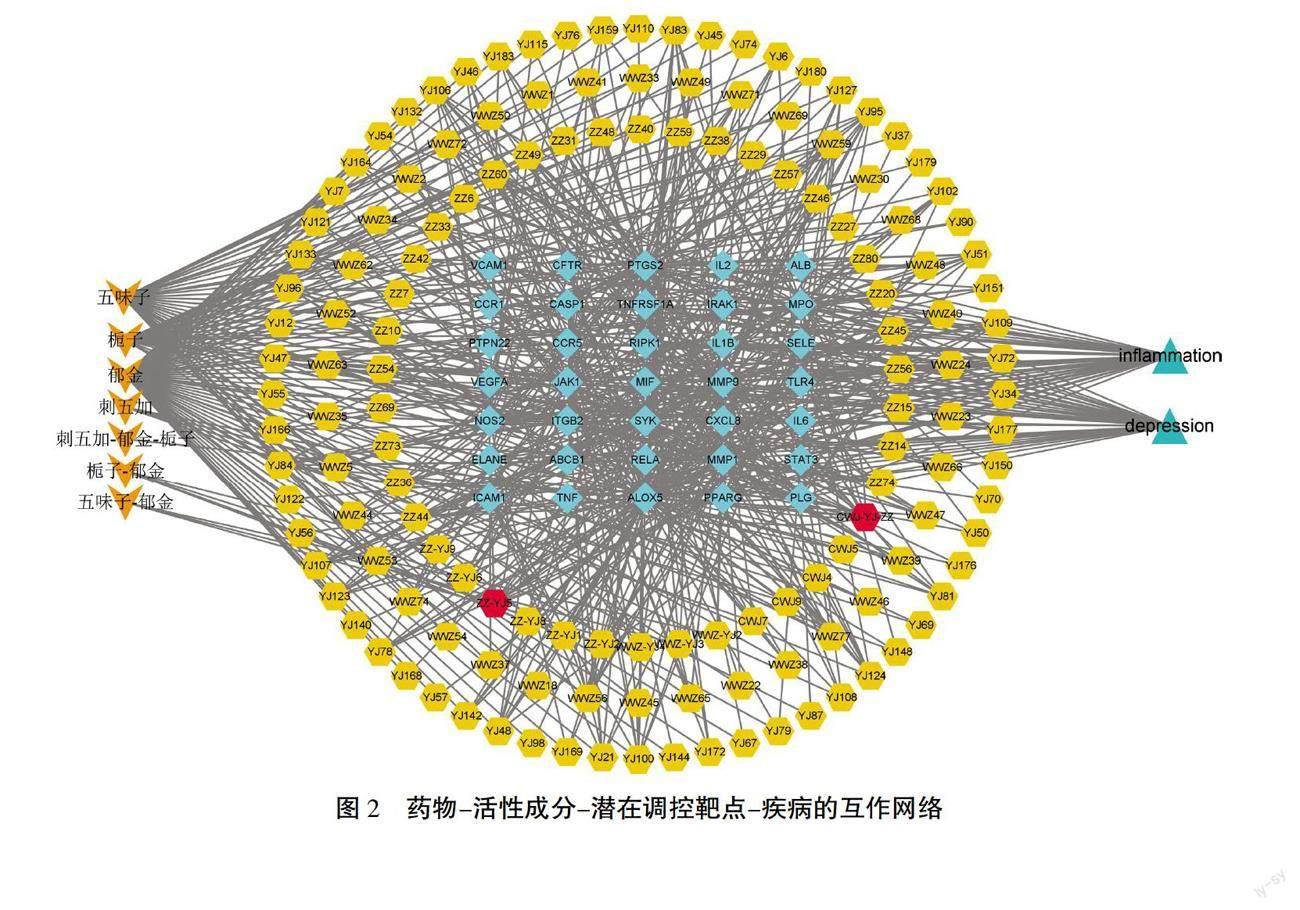
将郁金、栀子、刺五加、五味子的有效活性成分及潜在调控靶点导入软件Cytoscape 3.8.0中,构建颐脑解郁方药物-活性成分-潜在调控靶点-疾病的可视化网络,如图2所示。通过Cytoscape 3.8.0软件中的CytoNCA插件计算网络拓扑学特征,根据Degree进行排序,槲皮素(quercetin)和咖啡酸(caffeic acid)是Degree最高的药物活性成分(Degree均为15,图2红色所示),其中槲皮素是刺五加、郁金、栀子3味药的共有成分,咖啡酸是郁金、栀子的共同成分。
2.4 PPI网络
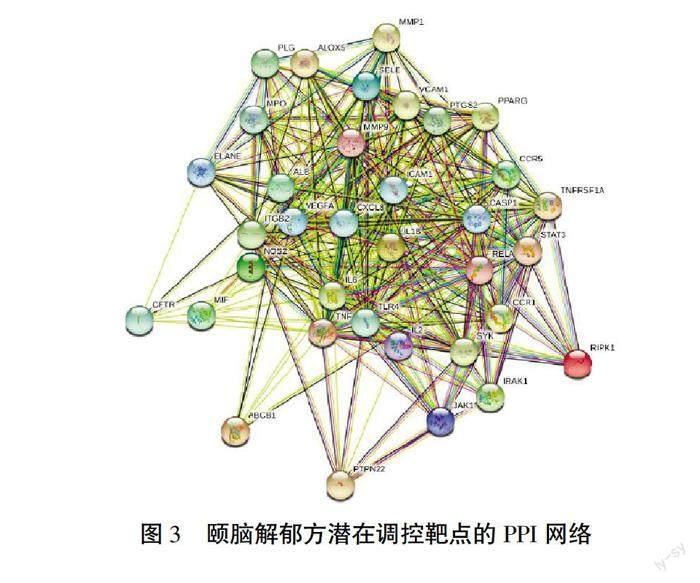
在STRING网站的检索框“Multiple proteins”输入35个潜在调控靶点,物种选择人类(Homo sapiens),得到颐脑解郁方对抑郁症炎症机制的潜在调控靶点的PPI网络(图3),该网络共计35个节点,369条边。
通过R语言分析获取PPI网络中关联度最高的前20个核心蛋白,绘制条形图(图4),主要的核心蛋白有IL-6、TNF、TLR4、IL-1β等。
2.5 潜在调控靶点的富集分析
将35个潜在调控靶点基因导入R/bioconductor进行GO、KEGG富集分析。GO富集分析得到分子功能(molecular function, MF)条目18个,生物学过程(biological process, BP)条目769个,细胞组分(cellular component, CC)条目9个,选取结果的top20进行可视化分析,如图5所示。其中MF主要涉及细胞因子受体结合、细胞因子活性、信号受体激活剂活性、抗氧化活性等;BP包括对各种刺激的反应(脂多糖、细菌来源分子)、对细胞黏附的调节、炎症反应的调节、细胞因子生成的积极调节等;CC主要涉及质膜外侧、分泌颗粒腔、细胞质囊泡腔、囊泡腔等。
KEGG信号通路富集分析结果显示P<0.05的结果共有182条,通路主要集中在核因子κB(nuclearfactorkappa-B, NF-κB)信号通路、TNF信号通路、感染、白介素17(interleukin-17, IL-17)信号通路等,如图6所示。
2.6 实验验证
2.6.1 各组大鼠旷场实验结果比较 造模前各组大鼠旷场实验水平运动得分和垂直运动得分差异无统计学意义(P>0.05)。造模结束后,与正常组比较,各组大鼠旷场实验水平运动得分和垂直运动得分均降低(P<0.01,P<0.05)。干预结束后,与模型组比较,中药组和西药组水平运动得分及垂直运动得分均上升(P<0.05),结果见表1,图7为各组大鼠旷场轨迹图。
2.6.2 各组大鼠血清IL-1β、IL-6、TNF-α水平的比较 与正常组相比,模型组血清IL-1β、IL-6、TNF-α含量均明显升高(P<0.01);与模型组相比,中药组和西药组大鼠血清IL-1β、IL-6、TNF-α含量均下降(P<0.05)。详见表2。
3 讨论
抑郁症属于中医学“郁证”范畴,《素问·举痛论》曰:“百病生于气也。”抑郁症也不例外,其基本病机为情志不舒、气机郁滞[15],加之现代社会快节奏和高压力,造成精血津液等物质的消耗,如《灵枢·本神》记载:“怵惕思虑者,则伤神,神伤则恐惧流淫而不止……”颐脑解郁方以补肾调气立意,其内涵为填肾精、益肾气、温肾阳、滋肾阴和调达气机。脑为髓海,肾主骨生髓,神志的正常依赖肾精的充养以及气的升降出入,正如《素问·六微旨大论》中所说:“出入废,则神机化灭;升降息,则气立孤危。故非出入,则无以生长壮老已;非升降,则无以生长化收藏。”全方重用刺五加为君药,益肾填精、安神益智;五味子滋肾敛肺、宁心安神;郁金入肝经血分,可活血止痛、行气解郁;栀子泻火除烦,可解郁除烦;全方配伍应用,标本兼治,具有益肾降浊、理气开郁、颐脑醒神的作用[3,16]。
研究表明,炎症是抑郁症等压力相关性疾病的共同发病机制[17],其发病和进展与免疫激活、促炎细胞因子分泌有关。因此,本研究采用网络药理学方法结合CUMS抑郁模型实验验证探讨颐脑解郁方对抑郁症促炎细胞因子的调节作用。
药物-活性成分-潜在调控靶点-疾病网络表明颐脑解郁方中有效活性成分较多,而且某些活性成分会对多个目标靶点产生影响,体现了中药多成分、多靶点、多通路的作用特点,其中槲皮素和咖啡酸是颐脑解郁方组成药物中较为重要的活性物质。槲皮素是一种黄酮类化合物,存在于多种食物和中药中,具有抗炎和抗氧化的作用[18],研究发现,槲皮素能通过抑制NLRP3/Caspase-1/IL-1β的激活发挥抗抑郁作用[19]。咖啡酸是一种存在于多种植物、药材中的天然酚类物质,具有天然抗氧化、抗炎的作用,有研究显示咖啡酸可改善CUMS模型大鼠的抑郁样行为[20],显著降低抑郁大鼠海马中的IL-1β、IL-6和TNF-α含量[21]。
本研究结果显示,颐脑解郁方对抑郁症促炎细胞因子的潜在调控靶点共计35个,核心蛋白为IL-6、TNF、TLR4、IL-1β等。研究发现在抑郁症患者中IL-6、TNF-α、IL-1β水平显著升高,而且其水平与抑郁症的发展密切相关[5]。TLR4是一种模式识别受体,参与NF-κB信号通路激活,导致其下游IL-1β、IL-6、TNF-α等促炎细胞因子的表达升高[22]。另外有研究发现,TNF-α会增加血脑屏障的通透性[23],血脑屏障的功能障碍加速了炎症介质和外周免疫细胞向中枢神经系统的渗透,导致行为异常和情绪障碍[24]。穿越血脑屏障的IL-6、IL-1β等促炎细胞因子能激活小胶质细胞,促进神经炎症的发生[25],介导海马等脑区的细胞焦亡[26],影響神经再生[27],而且促炎细胞因子水平升高可引起大脑内吲哚胺-2,3-双加氧酶升高,导致海马组织内5-HT水平下降,从而诱发抑郁症[28]。若能抑制IL-1β、IL-6、TNF-α等促炎细胞因子的过度产生、活化可能减轻脑神经损害的发生发展[11]。
GO分析结果显示,这些靶点参与了细胞因子受体调节、细胞因子活性等过程,影响细胞因子的产生、转运、信号传递等。KEGG富集分析结果显示,核心靶点涉及NF-κB信号通路、TNF信号通路、IL-17信号通路等多条通路,与炎症反应密切相关。其中NF-κB信号通路是调节炎症反应的重要通路,当阻断NF-κB时,外周的炎症反应则不会引起中枢炎症反应。研究表明NF-κB可通过多种信号通路参与抑郁症的发生,在CMS模型小鼠和LPS诱导的细胞模型中TLR4信号的激活促进了NF-κB的磷酸化,从而促进了炎症反应,导致抑郁[29-30]。综合网络药理学和动物实验结果认为,颐脑解郁方可能通过槲皮素、咖啡酸等有效活性成分抑制NF-κB信号通路,从而降低血清中IL-6、IL-1β、TNF-α的水平,使5-HT神经递质水平恢复正常从而产生抗抑郁作用,颐脑解郁方还可能通过降低血清中IL-6、IL-1β、TNF-α水平减轻神经炎症,产生神经保护作用。
动物实验研究结果显示,21 d CUMS应激结束后,和正常组相比,其余3组大鼠旷场实验水平运动得分、垂直运动得分偏低,提示模型制备成功。药物干预28 d后,与模型组相比,中药组和西药组旷场实验水平运动得分、垂直运动得分上升,说明颐脑解郁方同盐酸氟西汀一样,可改善抑郁大鼠行为,提示颐脑解郁方具有抗抑郁作用。模型组与正常组相比,血清中IL-6、TNF-α、IL-1β水平升高(P<0.01),说明促炎细胞因子升高与抑郁症相关;中药组和西药组促炎细胞因子水平较模型组下降,表明颐脑解郁方能够降低CUMS抑郁模型大鼠血清中IL-6、IL-1β、TNF-α促炎细胞因子水平。
综上所述,本研究从网络药理学角度对颐脑解郁方调控抑郁症促炎细胞因子的有效活性成分、潜在调控靶点、关键蛋白和通路、机制进行了阐述,并针对血清促炎细胞因子水平进行了实验验证。结果提示颐脑解郁方可能通过降低血清促炎细胞因子水平从而改善抑郁症,其作用涉及不同靶点和通路,体现了中医药治疗抑郁症的多靶点、多途径的治疗特点。本次研究为初步探索,颐脑解郁方调节抑郁症促炎细胞因子水平的具体通路机制需进一步实验验证。
参考文献
[1] GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: A systematic analysis for the Global Burden of Disease Study 2019[J]. Lancet, 2020, 396(10258): 1204-1222.
[2] TROUBAT R, BARONE P, LEMAN S, et al. Neuroinflammation and depression: A review[J]. The European Journal of Neuroscience, 2021, 53(1): 151-171.
[3] 白 扬,李晓红,任素剑,等.冠心病、抑郁症与慢性应激[J].湖北中医药大学学报,2019,21(2):54-57.
[4] 杨会增,杨程皓.抑郁症抗炎治疗的研究进展[J].临床精神医学杂志,2022,32(6):492-496.
[5] P?魪REZ-S?譧NCHEZ G, BECERRIL-VILLANUEVA E, ARREOLA R, et al. Inflammatory profiles in depressed adolescents treated with fluoxetine: An 8-week follow-up open study[J]. Mediators of Inflammation, 2018, 2018: 4074051.
[6] 曲 淼,孙文军,徐向青,等.益肾调气法治疗肾虚肝郁型抑郁症的多中心、随机、对照临床研究[J].世界中医药,2019,14(7):1710-1713,1718.
[7] 赵 晶,唐启盛,裴清华,等.颐脑解郁方治疗抑郁症肾虚肝郁型的临床疗效观察[J].北京中医药大学学报,2008,31(1):61-63.
[8] 裴清华,唐启盛,侯秀娟.颐脑解郁方对抑郁状态模型大鼠行为学及脑内5-羟色胺去甲肾上腺素的表达影响[J].中华中医药学刊,2008,26(7):1446-1448.
[9] 唐启盛,侯秀娟,赵瑞珍.中药颐脑解郁方对抑郁模型大鼠脑单胺递质的干预作用[J].北京中医药,2011,30(9):710-713.
[10] 赵 芸,赵瑞珍,赵子珺,等.颐脑解郁方对抑郁大鼠PI-3K/Akt信号转导通路的影响[J].中西医结合心脑血管病杂志,2018,16(23): 3441-3444.
[11] RU J L, LI P, WANG J N, et al. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13.
[12] FANG S S, DONG L, LIU L, et al. HERB: A high-throughput experiment-and reference-guided database of traditional Chinese medicine[J]. Nucleic Acids Research, 2021, 49(D1): D1197-D1206.
[13] LIPINSKI C A. Lead-and drug-like compounds: The rule-of-five revolution[J]. Drug Discovery Today Technologies, 2004, 1(4): 337-341.
[14] YU G C, WANG L G, HAN Y Y, et al. clusterProfiler: An R package for comparing biological themes among gene clusters[J]. Omics: a Journal of Integrative Biology, 2012, 16(5): 284-287.
[15] 王 雪,趙 燕,扈新刚,等.从中医肝主疏泄理论谈疏肝解郁法在情志病中的应用[J].环球中医药,2019,12(3):366-370.
[16] 李冬梅,唐启盛,赵瑞珍,等.脑卒中后大鼠模型边缘系统血管内皮生长因子的动态改变及中药的干预作用[J].北京中医药大学学报,2014,37(9):606-610.
[17] ARIOZ B I, TASTAN B, TARAKCIOGLU E, et al. Melatonin attenuates LPS-induced acute depressive-like behaviors and microglial NLRP3 inflammasome activation through the SIRT1/Nrf2 pathway[J]. Frontiers in Immunology, 2019, 10: 1511.
[18] LI Y, YAO J Y, HAN C Y, et al. Quercetin, inflammation and immunity[J]. Nutrients, 2016, 8(3): 167.
[19] HAN X J, XU T S, FANG Q J, et al. Quercetin hinders microglial activation to alleviate neurotoxicity via the interplay between NLRP3 inflammasome and mitophagy[J]. Redox Biology, 2021, 44: 102010.
[20] HUANG D, ZHANG L, YANG J Q, et al. Evaluation on monoamine neurotransmitters changes in depression rats given with sertraline, meloxicam or/and caffeic acid[J]. Genes & Diseases, 2019, 6(2): 167-175.
[21] 马庆阳.咖啡酸对CUMS大鼠抑郁行为的影响[D].重庆:重庆医科大学,2012.
[22] WEI Y C, HU Y H, QI K M, et al. Dihydromyricetin improves LPS-induced sickness and depressive-like behaviors in mice by inhibiting the TLR4/Akt/HIF1a/NLRP3 pathway[J]. Behavioural Brain Research, 2022, 423: 113775.
[23] CHENG Y Y, DESSE S, MARTINEZ A, et al. TNFα disrupts blood brain barrier integrity to maintain prolonged depressive-like behavior in mice[J]. Brain, Behavior, and Immunity, 2018, 69: 556-567.
[24] UZZAN S, AZAB A N. Anti-TNF-α compounds as a treatment for depression[J]. Molecules, 2021, 26(8): 2368.
[25] WANG Y L, HAN Q Q, GONG W Q, et al. Microglial activation mediates chronic mild stress-induced depressive-and anxiety-like behavior in adult rats[J]. Journal of Neuroinflammation, 2018, 15(1): 21.
[26] XU Y J, SHENG H, BAO Q Y, et al. NLRP3 inflammasome activation mediates estrogen deficiency-induced depression-and anxiety-like behavior and hippocampal inflammation in mice[J]. Brain, Behavior, and Immunity, 2016, 56: 175-186.
[27] KIM Y K, NA K S, MYINT A M, et al. The role of pro-inflammatory cytokines in neuroinflammation, neurogenesis and the neuroendocrine system in major depression[J]. Progress in Neuro-Psychopharmacology & Biological Psychiatry, 2016, 64: 277-284.
[28] KIM Y K, WON E.. The influence of stress on neuroinflammation and alterations in brain structure and function in major depressive disorder[J]. Behavioural Brain Research, 2017, 329: 6-11.
[29] HUANG X, FEI G Q, LIU W J, et al. Adipose-derived mesenchymal stem cells protect against CMS-induced depression-like behaviors in mice via regulating the Nrf2/HO-1 and TLR4/NF-κB signaling pathways[J]. Acta Pharmacologica Sinica, 2020, 41(5): 612-619.
[30] XU X, PIAO H N, AOSAI F M, et al. Arctigenin protects against depression by inhibiting microglial activation and neuroinflammation via HMGB1/TLR4/NF-κB and TNF-α/TNFR1/NF-κB pathways[J]. British Journal of Pharmacology, 2020, 177(22): 5224-5245.
〔收稿日期〕2022-10-27
〔基金項目〕中央高校基本科研业务费专项重点攻关项目(2020-JYB-ZDGG-144-3)。
〔第一作者〕张 双,女,博士研究生,研究方向:神经精神疾病的中医药防治。
〔通信作者〕*赵瑞珍,女,博士,主任医师,硕士研究生导师,E-mail:zhaoruizhen2009@163.com。
