eGFR-CysC联合血栓弹力图对慢加急性肝衰竭患者临床预后的预测价值
2023-05-30巴志伟赵文刘传苗
巴志伟?赵文?刘传苗


【摘要】目的 探討胱抑素C估算肾小球滤过率(eGFR-CysC)联合血栓弹力图(TEG)对慢加急性肝衰竭(ACLF)患者临床预后的预测价值。方法 选择34例ACLF患者(ACLF组)、26例慢性肝炎患者(慢性肝炎组)及30例肝硬化患者(肝硬化组),收集患者的入院24 h内实验室检查指标、TEG参数及eGFR-CysC结果,比较3组患者的各指标差异。对ACLF患者根据是否发生并发症及预后分组,利用二元logistic回归分析影响ACLF患者预后的危险因素,并通过受试者操作特征(ROC)曲线分析相关因素对ACLF患者预后的预测价值。结果 3组患者的白细胞、ALT、总胆红素、白蛋白、CRP、凝血酶原活动度、凝血酶原时间、国际标准化比值以及TEG的反应时间(R)、最大振幅(MA)和eGFR-CysC比较差异均有统计学意义(P均< 0.05)。ACLF组内分析显示,MA和eGFR-CysC在有无急性肾损伤组间比较差异有统计学意义(P均< 0.05),R和MA在有无上消化道出血组间比较差异均有统计学意义(P均< 0.05);死亡组与生存组间MA、eGFR-CysC比较差异亦均有统计学意义(P均< 0.05),二元logistic回归提示MA(OR=0.439,95%CI 0.231~0.833,P = 0.012)和eGFR-CysC(OR=0.931,95%CI 0.878~0.988,P = 0.018)是ACLF短期预后的危险因素。MA联合eGFR-CysC对ACLF患者临床预后的预测价值(AUC=0.933,95%CI 0.792~0.990)与终末期肝病模型(AUC=0.839,95%CI 0.672~0.942)相近(P > 0.05)。结论 MA、eGFR-CysC可预测ACLF患者临床预后,其预测价值与终末期肝病模型相近。
【关键词】慢加急性肝衰竭;胱抑素C估算肾小球滤过率;血栓弹力图;终末期肝病模型;预后
Predictive value of cystatin C-based estimated glomerular filtration rate combined with thromboelastogram for clinical prognosis of acute-on-chronic liver failure Ba Zhiwei,Zhao Wen,Liu Chuanmiao. Department of Infectious Diseases, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, China
Corresponding author, Liu Chuanmiao, E-mail: 2240758802@qq.com
【Abstract】Objective To investigate the value of cystatin C-based estimated glomerular filtration rate (eGFR-CysC) combined with thromboelastogram (TEG) to predict clinical prognosis of patients with acute-on-chronic liver failure (ACLF). Methods 34 patients with ACLF (ACLF group), 26 patients with chronic hepatitis (chronic hepatitis group) and 30 patients with cirrhosis (cirrhosis group) were selected. Laboratory parameters within 24 h after admission, TEG parameters and eGFR-CysC value were collected and compared among three groups. All patients were divided into different groups according to the incidence of complications and prognosis. The risk factors affecting clinical prognosis of ACLF patients were analyzed by binary logistic regression analysis. The predictive value of these risk factors for clinical prognosis of ACLF patients was assessed by the receiver operating characteristic (ROC)curve. Results There were significant differences in the white blood cell count (WBC), alanine aminotransferase (ALT), total bilirubin (TBIL), albumin (ALB), C-reactive protein (CRP), prothrombin time activity (PTA), prothrombin time (PT), international normalized ratio (INR), reaction time of TEG (R), maximum amplitude (MA) and eGFR-CysC among different groups (all P < 0.05). ACLF intra-group analysis showed that MA and eGFR-CysC were significantly different between patients with or without acute renal injury (both P < 0.05), R and MA were significantly different between patients with or without upper gastrointestinal bleeding (both P < 0.05), MA and eGFR-CysC significantly differed between the death and survival groups (both P < 0.05). Binary logistic regression analysis suggested that MA (OR=0.439, 95%CI 0.231-0.833, P = 0.012) and eGFR-CysC (OR=0.931, 95%CI 0.878-0.988, P = 0.018) were the risk factors affecting short-term prognosis of ACLF. MA combined with eGFR-CysC yielded similar prognostic value in patients with ACLF (AUC=0.933, 95%CI 0.792-0.990) compared with Model for End-Stage Liver Disease (MELD) (AUC=0.839, 95%CI 0.672-0.942) (P > 0.05). Conclusion MA and eGFR-CysC can predict clinical prognosis of ACLF patients. MA combined with eGFR-CysC yield similar predictive value for ACLF compared with MELD.
【Key words】Acute-on-chronic liver failure; Cystatin C-based estimated glomerular filtration rate; Thromboelastogram;
MELD; Prognosis
慢加急性肝衰竭(ACLF)是一种由多种原因导致的肝功能严重损害的临床综合征,具有黄疸、凝血功能障碍、腹水、肝性脑病等一系列临床表现,病程进展迅速,短期内有较高的病死率[1]。对于经内科积极治疗等方法难以好转者,肝移植是最佳的治疗方案[2]。但不少ACLF患者在等待移植期间因病情加重死去,未能行肝移植术[3]。器官衰竭是ACLF患者主要特征之一,其中以肾衰竭最为常见[4]。有研究显示,肝衰竭患者病情进展时,胱抑素C(CysC)水平随之升高,而CysC估算肾小球滤过率(eGFR-CysC)更是判断急性失代偿期肝硬化患者进展为ACLF的重要预测因子[5]。另有研究表明,eGFR-CysC较肌酐估算肾小球滤过率(eGFR-Crea)能更准确和少偏差地估算肝移植术后儿童的eGFR[6]。相比于常规凝血指标,血栓弹力图(TEG)更能反映血液凝固和溶解全过程,展示凝血全貌[7]。有研究者认为,TEG可准确评估围术期肝移植患者凝血状态,指导围术期输血[8]。ACLF患者普遍存在凝血功能异常,既往研究指出,TEG能够准确反映患者体内存在的低水平“凝血再平衡状态”,对出血风险评价较为敏感[9]。因此,本研究着重探讨TEG联合eGFR-CysC对ACLF患者临床预后的预测价值,以期为评估ACLF预后提供及时、准确的理论支持。
对象与方法
一、 研究对象
选取2020年10月至2021年6月蚌埠医学院第一附属医院感染科收住的肝病患者,依据患者病情的不同,分为慢性肝炎组(26例)、肝硬化组(30例)、ACLF组(34例),病例的诊断均符合文献[2, 10-12]的相应标准。排除标准:年龄>75岁或<18岁者,存在心脑血管疾病、慢性肾脏疾病、血液疾病或其他严重系统疾病者,合并恶性肿瘤者,先天凝血功能紊乱或1个月内使用过抗凝药物者,妊娠期及哺乳期者,随访期间死于其他原因或失访者。本研究方案经医院伦理委员会批准(批件号:伦科批字[2022]第056号),患者或其授权家属均已签署知情同意书。
二、 观察指标
收集患者的一般临床资料及入院24 h内实验室数据,包括年龄、性别、白细胞计数、ALT、总胆红素、白蛋白、CRP、凝血酶原活动度(PTA)、凝血酶原时间(PT)、国际标准化比值(INR)、血清肌酐、TEG及eGFR-CysC等。TEG主要分析4种指标,分别为反映凝血因子功能的反应时间(R),反映纤维蛋白原功能的血块形成时间(K)、角度(α),以及反映血小板聚集功能的最大振幅(MA)。随访时间为30 d,根据ACLF组患者在30 d内是否并发急性肾损伤、感染、肝性脑病及上消化道出血分组分析;根据30 d后ACLF患者是否存活将分为生存组和死亡组,比较ACLF组内不同预后患者的实验室指标及终末期肝病模型(MELD)评分,分析ACLF预后的影响因素,比较影响因素与MELD评分预测ACLF患者预后的价值。
三、 统计学处理
所有数据采用SPSS 25.0进行分析。正态分布的计量资料以 表示,组间比较采用方差分析,进一步两两比较采用LSD-t法;非正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-Wallis H检验,2组间比较采用Mann-Whitney U检验;计数资料以例(%)表示,组间比较采用χ2检验;使用二元logistic回归(纳入法)分析影响ACLF患者预后的因素,并将相关指标联合为新变量,绘制受试者操作特征(ROC)曲线,采用MedCalc 20.0.3比较各曲线下面积(AUC)差异。P < 0.05为差异有统计学意义。
结果
一、3组患者的年龄及性别构成比较
慢性肝炎组、肝硬化组和ACLF组患者的年龄、性别构成接近(P均> 0.05)。见表1。
表1 3组患者的年龄及性别构成比较
组 别 例数 年龄/岁 性别/例
男 女
慢性肝炎组 26 48.1±8.9 20 6
肝硬化组 30 48.9±12.0 27 3
ACLF组 34 52.4±11.6 31 3
F/ χ2值 1.291 3.023
P值 0.280 0.221
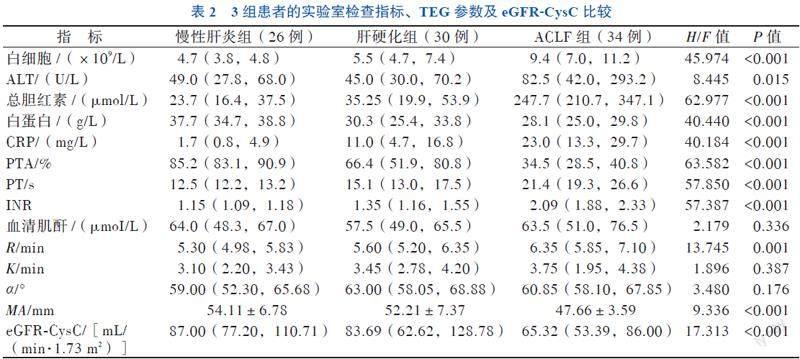
二、3组患者的实验室检查指标、TEG参数及eGFR-CysC比较
慢性肝炎组、肝硬化组和ACLF组患者的白细胞、ALT、总胆红素、白蛋白、CRP、PTA、PT、INR比较差异均有统计意义(P均< 0.05)。3组患者的R、MA和eGFR-CysC比较差异亦有统计学意义(P均< 0.05)。见表2。
三、ACLF组内有无并发症患者间的TEG参数及eGFR-CysC比较
ACLF组内,MA和eGFR-CysC在有无急性腎损伤(AKI)组间比较差异有统计学意义,R和MA在有无上消化道出血组间比较差异有统计学意义(P均< 0.05);有无感染和肝性脑病对TEG的影响相近(P均> 0.05)。见表3。
四、ACLF组内不同预后患者的实验室检查指标、TEG参数、eGFR-CysC及MELD评分比较
ACLF组内,死亡组与生存组患者的MA、eGFR-CysC和MELD评分组间比较差异均有统计学意义(P均< 0.05);其余指标在死亡组与生存组间比较差异均无统计学意义(P均> 0.05)。见表4。
五、ACLF患者预后影响因素分析
将MA和eGFR-CysC纳入二元logistic回归分析,结果示MA(OR=0.439,95%CI 0.231~0.833,P = 0.012)和eGFR-CysC(OR=0.931,95%CI 0.878~ 0.988,P = 0.018)是ACLF预后的危险因素。见表5。
六、MA联合eGFR-CysC、MELD对ACLF患者预后的预测价值分析
运用二元logistic回归建立MA联合eGFR-CysC的新模型(logit P = 43.313-0.824×MA-0.071×eGFR-CysC)。MA联合eGFR-CysC与MELD评分预测ACLF患者预后的AUC比较差异无统计学意义(Z = 1.262,P = 0.207),见表6、图1。
讨论
急性肾损伤(AKI)是ACLF患者的常见并发症,吴振平等[13]研究发现,AKI组ACLF患者近期(30 d)病死率高于无AKI组患者,亚太肝病学会(APASL)也提出AKI的发生、发展与ACLF患者近期预后相关[1]。因此,肾功能指标可能对预测ACLF患者预后有一定价值。改善全球肾脏疾病预后组织(KDIGO)制定的AKI诊断及分期以肌酐水平为主要参考指标[14]。eGFR也是依据肌酐水平计算而来,但多项因素均可影响肌酐水平,eGFR-Crea难以全面反映患者真实状态[15]。CysC作为新型标志物,不易受年龄、性别、种族、体重等因素影响[16]。在肝硬化患者中,eGFR-CysC对评估肾损伤及生存预测能力优于eGFR-Crea[15]。目前eGFR-CysC在肝衰竭患者预后中的研究较少,值得探讨。
本研究显示,3组患者的eGFR-CysC比较差异有统计学意义,这表明eGFR-CysC对判断慢性肝病疾病进展可能有一定的意义,且在ACLF患者中并发AKI组患者的eGFR-CysC低于未并发AKI组,说明基线eGFR-CysC对预测慢性肝病患者并发AKI能力较强,而在对ACLF患者生存预后的影响因素分析中,eGFR-CysC的P值小于0.05,OR值<1,进一步提示基线eGFR-CysC与ACLF患者预后有关,eGFR-CysC越高,ACLF患者死亡可能性越小,王鹭等[17]的多因素Cox分析发现基线eGFR-CysC能够预测HBV-ACLF患者短期(28 d)
预后,本研究与之一致。
本研究显示ACLF患者的PT和INR高于慢性肝炎组及肝硬化组,临床常用上述2种指标判断ACLF患者凝血功能异常、有无高出血风险,但纳入的ACLF患者仅有5例出现上消化道出血。考虑ACLF患者处于低出凝血平衡状态,即使PT和INR明显增加,患者并无较高出血风险。TEG仅需微量全血便可反映血液凝固动态变化全貌,已应用于多种疾病领域。本研究3组间TEG各指标的对比中,3组的R、MA比较差异均有统计学意义,R主要反映凝血因子在凝血过程中的综合作用,R延长表示凝血因子功能不佳;MA则反映血凝块最大强度及形成的稳定性,主要受血小板和纤维蛋白原影响,MA下降提示血小板功能减弱。
进一步的ACLF患者组内研究中,并发AKI组患者和死亡组患者MA均低于对照组,而R在组间比较差异均无统计学意义,既往研究提示MA下降和出血倾向升高密切相关[18]。肝脏合成和激活大量的凝血及抗凝血因子,同时也调节纤溶功能,ACLF患者因大范围的肝细胞损伤,导致促凝血和抗凝血因子合成不足,纤溶系统紊乱以及血小板生成素合成不足和针对血小板的免疫破坏,造成不同程度的凝血功能障碍[19]。MA可判断血小板质量及纤维蛋白原活性,反映血小板和纤维蛋白原间的作用,甚至可以预测ACLF患者是否发生大出血[20-21]。本研究中,有上消化道出血组患者MA低于无上消化道出血组患者,印证上述观点。在对ACLF患者预后影响因素的分析中,得出MA是ACLF患者临床预后的保护因素,即MA值下降,患者死亡风险升高。
MELD评分是目前应用最广泛的评价肝病严重程度及临床预后的模型之一[22]。本研究联合MA和eGFR-CysC,并引入MELD评分一同纳入预后对比进行分析,结果发现MA联合eGFR-CysC对ACLF患者临床预后的预测价值(AUC 0.933)略高于MELD评分(AUC 0.839),两者AUC比较差异无统计学意义,且MA联合eGFR-CysC的约登指数、特异度优于MELD评分,说明MA联合eGFR-CysC对预测ACLF患者预后的价值较好,并且当MA联合eGFR-CysC > 0.052時,患者死亡风险增加。
综上所述,eGFR-CysC和MA是ACLF患者临床预后的影响因素,2项指标易获取、计算简便,MA联合 eGFR-CysC对ACLF患者临床预后的预测能力略优于MELD。但本研究仅为单中心小样本量回顾性分析,尚存在局限性,还需继续扩大样本数据对结果加以验证。
参 考 文 献
[1] Sarin S K, Kedarisetty C K, Abbas Z, et al. Acute-on-chronic liver failure: consensus recommendations of the Asian Pacific Association for the Study of the Liver (APASL) 2014. Hepatol Int, 2014, 8(4): 453-471.
[2] 中华医学会感染病学分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊治指南(2018年版). 临床肝胆病杂志, 2019, 35(1): 38-44.
[3] Vinay, Sundaram, Jalan R, Wu T, et al. Factors associated with survival of patients with severe acute-on-chronic liver failure before and after liver transplantation. Gastroenterology, 2019, 156(5): 1381-1391.e3.
[4] Pereira G, Baldin C, Piedade J, et al. Combination and sequential evaluation of acute-on-chronic liver failure (ACLF) and hyponatremia and prognosis in cirrhotic patients. Dig Liver Dis, 2020, 52(1): 91-97.
[5] Markwardt D, Holdt L, Steib C, et al. Plasma cystatin C is a predictor of renal dysfunction, acute-on-chronic liver failure, and mortality in patients with acutely decompensated liver cirrhosis. Hepatology, 2017, 66(4): 1232-1241.
[6] Bluhme E, Malenicka S, Fischler B, et al. Comparison of cystatin C, creatinine, and iohexol clearance in pediatric liver transplantation-a retrospective cohort study. Pediatr Transplant, 2021, 25(6): e13993.
[7] Shaydakov M E, Sigmon D F, Blebea J. Thromboelastography. Treasure Island (FL): StatPearls Publishing, 2021.
[8] 孙赫,李晓航,张佳林.血栓弹力图评估肝移植患者围术期凝血状态.中国医科大学学报, 2018, 47(4):329-332.
[9] 江晓燕, 甘巧蓉, 李孝楼, 等. 血栓弹力图评价乙型肝炎病毒相关慢加急性肝衰竭患者出血风险及预后价值研究. 传染病信息, 2019, 32(1): 54-57.
[10] 王贵强, 王福生, 庄辉, 等. 慢性乙型肝炎防治指南(2019年版). 中国病毒病杂志, 2020, 10(1): 1-25.
[11] 中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2019年版). 中国病毒病杂志, 2020, 10(1): 26-46.
[12] 徐小元, 丁惠国, 李文刚, 等. 肝硬化诊治指南. 实用肝脏病杂志, 2019, 22(6): 770-786.
[13] 吴振平, 钟渊斌, 李小鹏, 等. 乙型肝炎病毒相关慢加急性(亚急性)肝功能衰竭患者中急性肾损伤的分析. 中华传染病杂志, 2016, 34(12): 713-716.
[14] 闫文娟, 张炯. 急性肾损伤的研究进展. 临床与病理杂志, 2019, 39(7): 1571-1575.
[15] Yoo J J, Kim S G, Kim Y S, et al. Estimation of renal function in patients with liver cirrhosis: impact of muscle mass and sex. J Hepatol, 2019, 70(5): 847-854.
[16] 吴松, 周依林, 李治君. 血清LCN2、Cys C水平对急性胰腺炎并发急性肾损伤的预测价值. 山东医药, 2021, 61(25): 6-9, 22.
[17] 王鹭, 吴晓娟, 蔡蓓, 等. 胱抑素C估算肾小球滤过率对人工肝治疗HBV相关性慢加急性肝衰竭短期预后的预测价值. 四川大学学报(医学版), 2021, 52(5): 862-867.
[18] Thakrar S V, Mallett S V. Thrombocytopenia in cirrhosis: impact of fibrinogen on bleeding risk. World J Hepatol, 2017, 9(6):318-325.
[19] 熊壯, 刘扬扬, 霍少凯, 等. 维生素K1治疗肝衰竭凝血功能障碍的研究进展. 临床肝胆病杂志, 2019, 35(9): 2099-2103.
[21] Premkumar M, Saxena P, Rangegowda D, et al. Coagulation failure is associated with bleeding events and clinical outcome during systemic inflammatory response and sepsis in acute-on-chronic liver failure: an observational cohort study. Liver Int, 2019,39(4):694-704.
[22] 周红宇, 皮小芳, 周国华, 等. 血清球蛋白/胆碱酯酶与失代偿期肝硬化肝损伤程度及并发症的关系分析. 新医学, 2021, 52(10): 778-781.
(收稿日期:2021-11-30)
(本文编辑:林燕薇)
