人工智能辅助消化内镜用于胃癌及癌前病变鉴别诊断临床价值分析
2023-05-29王君晁帅恒
王君,晁帅恒
胃癌是临床常见消化系统恶性肿瘤,其在我国各类癌症的发病率、死亡率排名中均排第3,给居民健康带来严重威胁[1]。实践表明,尽早检查、诊断是使胃癌患者获得良好预后的关键。消化内镜是临床主要胃部疾病检查手段,其可方便观察食管、胃、十二指肠球部和降部的黏膜形态,确定病变部位,而且可以取胃黏膜活检对病变部位定性分析,协助诊断上消化道炎症、溃疡、肿瘤等多种疾病[2]。临床广泛认同胃癌的发生发展遵循正常胃黏膜—慢性炎症—萎缩性胃炎—肠化生—癌前病变—胃癌的级联反应[3],常规胃镜下诊断依靠操作医师临床经验,难以做到同质化检查效能,存在一定局限性,较难鉴别癌前病变与早期胃癌,影响治疗选择及患者预后,因此探寻更为精准的诊断方法具有重要意义。随着人工智能发展,逐渐应用于医疗诊疗中,研究显示人工智能在肺结节良恶性判断、宫颈癌筛查等疾病中取得较好成效[4-5]。本研究将人工智能与消化内镜检查结合,探究其用于胃癌与癌前病变鉴别诊断中的价值,取得一定成果,现报告如下。
1 资料与方法
1.1 一般资料 回顾河南科技大学附属许昌市中心医院2020年1月至2021年12月收治的160例疑似胃癌及癌前病变患者资料,其中男95例,女65例;年龄31~85岁,平均年龄(55.12±10.21)岁。
1.2 选取标准 纳入标准:年龄18岁以上;接受常规内镜检查、人工智能辅助消化内镜检查、活检病理学诊断;临床资料完整。排除标准:合并严重心肺疾病、胸腹主动脉瘤、脑卒中等其他消化内镜禁忌证及无法耐受检查患者;近期接受上消化道手术;既往确诊胃癌及胃上皮内瘤变(GIN)。
1.3 检查方法
1.3.1 常规消化内镜检查 所有患者均于检查前1 d晚上21:00后禁食禁饮,于次日检查前2 h服用链霉蛋白酶颗粒(生产单位:北京泰德制药股份有限公司,批准文号:国药准字H20110030,规格:20 000单位)溶解去除胃壁黏液。所有患者均接受静脉麻醉,待患者睫毛反射消失后经口进行电子胃镜检查,常规观察患者食管、贲门、胃底、胃体等部位黏膜情况,定位病变部分进行多角度观察,取少量病变部位黏膜样本进行活检。
1.3.2 人工智能辅助消化内镜检查 人工智能辅助消化内镜检查前准备及麻醉方式同常规胃镜,在内镜医师观察患者胃黏膜病变部位时在常规检查基础上采用胃肠道人工智能辅助诊断系统(gastrointestinal artificial intelligence diagnostic system,GRAIDS)辅助检查,根据系统提醒定位活检部位、图像采集、指控管理。
1.4 统计学方法 本研究数据均用SPSS 24.0软件分析,其中计量资料采用均数±标准差(±s)表示;计数资料采用率[n(%)]表示,比较采用χ2检验或Fisher精确检验;以病理学结果为标准做四格表分析常规消化内镜和人工智能辅助消化内镜对胃黏膜病变的诊断效能及胃癌与癌前病变鉴别诊断效能,敏感度=真阳性例数/金标准总阳性例数×100%,特异度=真阴性例数/金标准总阴性例数×100%,准确率=(真阳性例数+真阴性例数)/总例数×100%,阳性预测值=真阳性例数/诊断方法总阳性例数×100%,阴性预测值=真阴性例数/诊断方法总阴性例数×100%,P<0.05表示差异有统计学意义。
2 结果
2.1 病理学结果 160例疑似胃黏膜病变患者经活检病理学诊断,其中GIN 102例,占比63.75%(102/160),胃癌38例,占比23.75%(38/160),其他非GIN 20例,占比12.50%(20/160),阳性率87.50%(140/160);其中GIN患者包括低级别上皮内瘤变(LGIN)75例,占比73.53%(75/102),高级别上皮内瘤变(HGIN)27例,占比26.47%(27/102)。
2.2 不同方法对胃黏膜病变诊断效能比较 常规消化内镜检出胃黏膜病变阳性123例,其对胃黏膜病变诊断敏感度83.57%,特异度70.00%,准确率81.88%,阳性预测值95.12%,阴性预测值37.84%;人工智能辅助消化内镜检出胃黏膜病变阳性132例,其对胃黏膜病变诊断敏感度92.86%,特异度90.00%,准确率92.50%,阳性预测值98.48%,阴性预测值64.29%,见表1;人工智能辅助消化内镜诊断胃黏膜病变的敏感度、准确率、阴性预测值高于常规消化内镜,差异有统计学意义(P<0.05),见表2。

表1 不同方法对胃黏膜病变检出结果比较(n)
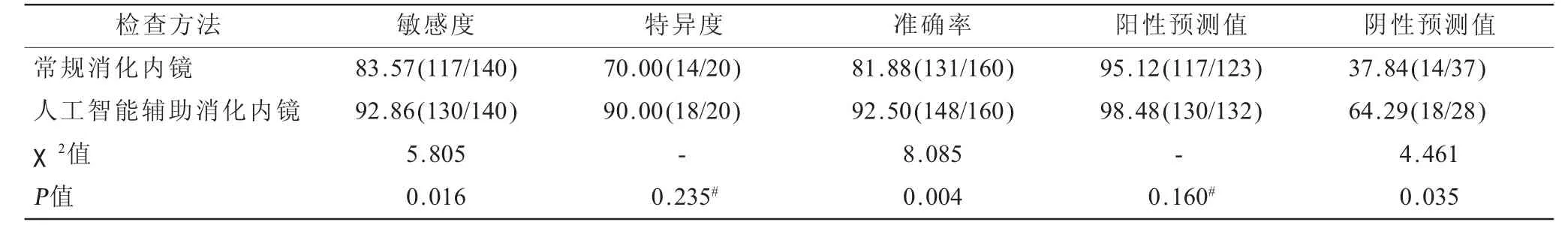
表2 不同方法对胃黏膜病变诊断效能相关参数比较单位:%
2.3 不同方法鉴别胃癌及GIN效能比较 常规消化内镜检出的123例病变阳性患者诊断胃癌30例,GIN 93例,其对胃癌及GIN鉴别诊断敏感度71.05%,特异度96.47%,准确率88.62%,阳性预测值90.00%,阴性预测值88.17%;人工智能辅助消化内镜检出的132例病变阳性患者诊断胃癌35例,GIN 97例,其对胃癌及GIN鉴别诊断敏感度86.84%,特异度97.87%,准确率94.70%,阳性预测值94.29%,阴性预测值94.85%,见表3;两种检查方法鉴别诊断胃癌及GIN的效能参数比较差异无统计学意义(P>0.05),见表4。
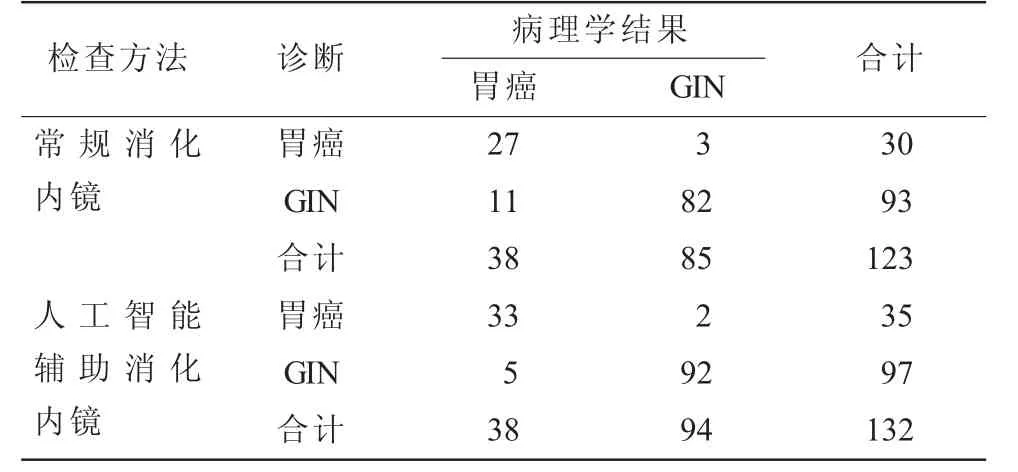
表3 不同方法对胃癌及GIN诊断结果(n)
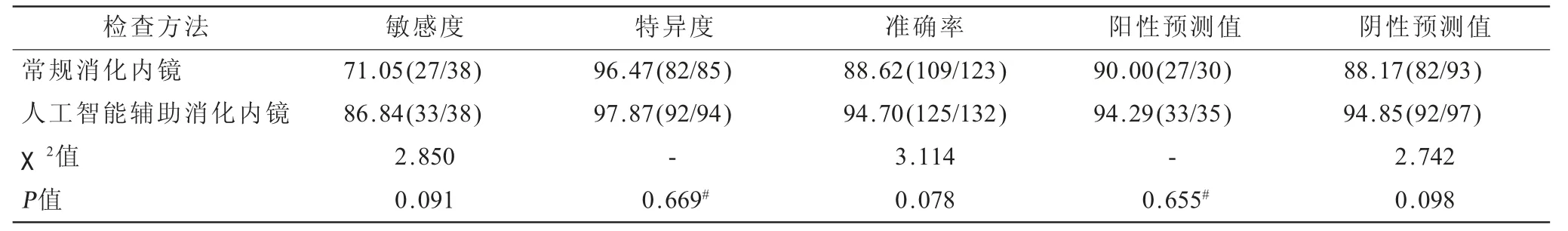
表4 不同方法鉴别诊断胃癌及GIN效能相关参数单位:%
3 讨论
据研究统计2016年我国新发癌症胃癌患者39.7万例,死亡28.9万例,仅次于肺癌和肝癌[6],虽然近年来发病率及死亡率呈下降趋势,但仍是威胁我国居民的主要癌症类型。胃癌是高发于胃黏膜上皮的恶性肿瘤,早期通常无特异性体征,发展到中晚期可出现类似胃溃疡、胃炎等胃部疼痛、食欲减退、上腹饱胀等症状,部分伴随黑便、出血[7]。我国早期胃癌患者占比仅约20%,多数患者就诊已为进展期,5年内生存率不足50%[8],早期诊疗是关键。消化内镜检查是胃癌的必须检查手段,其可确定肿瘤位置,获取黏膜组织行病理检查,结合物理染色、化学染色等多种方法可鉴别胃黏膜病变的良恶性并判断病灶边界范围。但消化内镜检查需要消耗大量人力物力,而且作为入侵式检查,患者接受度较低,因此难以进行大面积筛查,此外内镜检查操作尚未形成规范,基层医疗机构医师早癌意识薄弱、经验欠缺等多种因素均可导致胃癌诊疗效率低下[9],因此探索提高诊疗效率的方法对提高患者生存率至关重要。
虽然人工智能在临床诊断实践中尚处于初级阶段,但其已在多学科多疾病医学图像识别中展现巨大潜力。Tang等人[10]开发和验证用于检测早期胃癌的实时深度卷积神经网络系统,显示其诊断阳性病变的准确率(85.1%~91.2%)、灵敏度(85.9%~95.5%)、特异度(81.7%~90.3%)和AUC(0.887~0.940),较传统内镜医师检查诊断效率更高,再次说明人工智能在胃癌诊断中的远大前景。本研究比较常规内镜及基于人工智能辅助的内镜检查,结果显示人工智能辅助消化内镜诊断胃黏膜病变的敏感度、准确率、阴性预测值高于常规消化内镜(P<0.05),说明基于人工智能辅助可提高胃黏膜良恶性病变的准确性。一方面人工智能辅助检查可减少操作医师因疲劳导致的漏诊、误诊,而且可以弥补经验不足的诊断不确定,另一方面人工智能辅助检查诊断可利用多种模型,适应不同应用场景,例如基于特征提取+机器分类的模型可用于基层设备不先进的医疗机构,而基于深度学习的人工智能可用于条件较好的三级医院,优化检测准确率[11]。Correa级联反应是临床广泛认可的胃癌的发生发展模式[12-13],其以正常胃黏膜发展为胃癌划分为6个阶段,其中GIN是早期胃癌前阶段,包括LGIN和HGIN,其中HGIN患者进展为胃癌的风险显著更高,早期胃癌防控目标的关键应为避免进展为HGIN。临床对于GIN与早期胃癌治疗差异显著,GIN特别是LGIN被认为根除幽门螺杆菌有助于阻断进展为HGIN,而对于早期胃癌则首选内镜黏膜下剥离术治疗[14],本研究中常规消化内镜、人工智能辅助消化内镜鉴别诊断胃癌及GIN的效能参数比较差异无统计学意义(P>0.05),说明两种方法均可有效鉴别胃癌及GIN,考虑一方面是结合内镜染色观察本身具有较高诊断效能,李发旺等[15]的研究显示内镜下联合染色技术(电子染色+靛胭脂染色) 可明显提高早期胃癌和癌前病变的检出率,另一方面本研究结果中可看出基于人工智能辅助检查相关参数结果更好,但结果无显著差异考虑是因为纳入样本量较少,存在一定偏倚。
综上所述,在胃黏膜病变良恶性判断中基于人工智能辅助的消化内镜检查表现良好,可有效提高常规胃镜的胃黏膜病变检出效能,但在胃癌及GIN鉴别诊断中二者无显著差异,均表现较好。
