基于扩增子和宏基因技术探讨去卵巢大鼠肠道菌群的变化
2023-05-29丁冰倩徐琳琳王雪嫄赵欣王艳傅金英
丁冰倩,徐琳琳,王雪嫄,赵欣,王艳,傅金英,2
1.河南中医药大学,河南 郑州 450002;2.河南省中医院 妇产科,河南 郑州 450053
围绝经期是妇女自生育期的规律月经过渡到绝经的时期,此期主要表现为月经不规则、生殖器官萎缩、烘热汗出、情绪不稳定、血压易波动等,这些临床表现被称为围绝经期综合征(perimenopausal syndrome, PMS)[1]。随着我国老龄化社会的到来,人口平均寿命的增加,大部分女性绝经后还要生存很长一段时间,她们绝经后的身心健康和生存质量值得引起广泛关注。
肠道菌群是人体最重要、最庞大的微生态系统,其基因组总和比人类多100倍[2-3],机体的胃肠道中定植着大量的菌群,肠道菌群在机体代谢过程中起着重要作用,被称为“代谢器官”[4]。肠道菌群与机体互利共生,参与机体的脂质代谢以及机体免疫,并且肠道菌群的改变能够影响脂质和胆固醇的代谢,进而影响机体疾病的发生发展[5]。作为人体组成部分之一的肠道菌群,与PMS关系密切,可能和肠道有益菌群与腐败菌群比例发生变化有关[6]。
本研究旨在从去卵巢大鼠模型出发,通过去卵巢大鼠模型模拟围绝经期女性,探讨围绝经期大鼠与正常大鼠肠道菌群的差异,为临床认识及治疗PMS提供参考价值。
1 材料和方法
1.1 材料 12 只8 周龄SPF级SD雌性大鼠,购自华兴实验动物养殖场[动物许可证编号:SCXK(豫)2019-0002],饲养于河南中医药大学中心实验室;麻醉用品:水合氯醛(天津大茂化学试剂厂);造模术后抗感染药物:注射用青霉素钠(160万IU,国药准字:H13020655,华北制药股份有限公司)。ELISA试剂盒;全自动生化分析仪(深圳雷杜生命科技,设备型号:chemray240);核酸电泳仪(北京六一仪器厂,设备型号:DYCP-32C型琼脂糖水平电泳仪)。Covaris超声波破碎仪(Massachusetts,美国;设备型号:Covaris S2 system)。Qubit Fluorometric Quantification(Life Technologies,CA,美国;设备型号:Qubit 2.0)。生物分析仪(美国安捷伦公司;设备型号:Agilent 2100)。PCR仪(Bio-Rad,美国;设备型号:T100PCR)。测序仪(Illumina,San Diego,CA,美国;设备型号:Novaseq 6000)。
1.2 造模方法 12只SPF级SD雌性大鼠适应性喂养3 d,术前禁食不禁水12 h,4%水合氯醛腹腔注射麻醉,沿大鼠下腹正中切开,沿Y形子宫找卵巢,随机摘除6只大鼠双侧卵巢并止血,将子宫、输卵管等放回腹腔,缝合。术后腹腔注射青霉素钠每天20万IU/只,连续3 d。实验动物处置符合河南中医药大学颁布的实验动物伦理学标准(审查编号:PZHNSZYY-2021-032)。模型复制成功后,将12只大鼠分为2组,对照组(未做任何处理)和模型组(去除双侧卵巢)置于同一实验环境中喂养3周。
1.3 观察指标
1.3.1 实验大鼠体质量:将2组实验大鼠进行3周的喂养,每日称体质量,并计算造模前1天和造模3周后的体质量,对比2组间有无差异。
1.3.2 粪便标本采集及肠道菌群的检测:实验动物术后常规喂养3 周,活体进行大鼠粪便的采集。采集粪便时先进行大鼠肛周消毒,轻轻挤压大鼠尾巴根部直肠末端,待粪便排出收集于无菌EP管中,-80 ℃保存。16S rDNA高通量测序技术和宏基因测序技术对样本菌群组成进行分析。测序技术均由深圳微科盟科技集团有限公司提供。
1.3.3 实验大鼠血清指标检测:将实验大鼠喂养3周后,4%水合氯醛腹腔注射麻醉,解剖实验大鼠,进行大鼠腹主动脉采血,分离血清,采用ELISA试剂盒检测卵泡刺激素(follicle-stimulating hormone, FSH)、雌二醇(estradiol, E2)。
1.4 统计学处理方法 采用SPSS27.0软件进行统计分析,正态分布计量资料采用±s表示,采用t检验,计数资料比较采用χ2检验,肠道菌群采用秩和检验、Permanova分析等进行统计学分析。P<0.05为差异有统计学意义。
2 结果
2.1 实验大鼠体质量 造模前,模型组和对照组大鼠体质量差异无统计学意义[(208.8±4.5)gvs.(208.2±6.2)g,t=-0.212,P=0.836]。造模术后7 d内模型组体质量低于对照组,之后模型组体质量逐渐增加,术后第3周模型组大鼠体质量明显高于对照组,差异有统计学意义[(267.3±16.6)gvs.(305.2±24.6)g,t=3.120,P=0.011]。见图1。
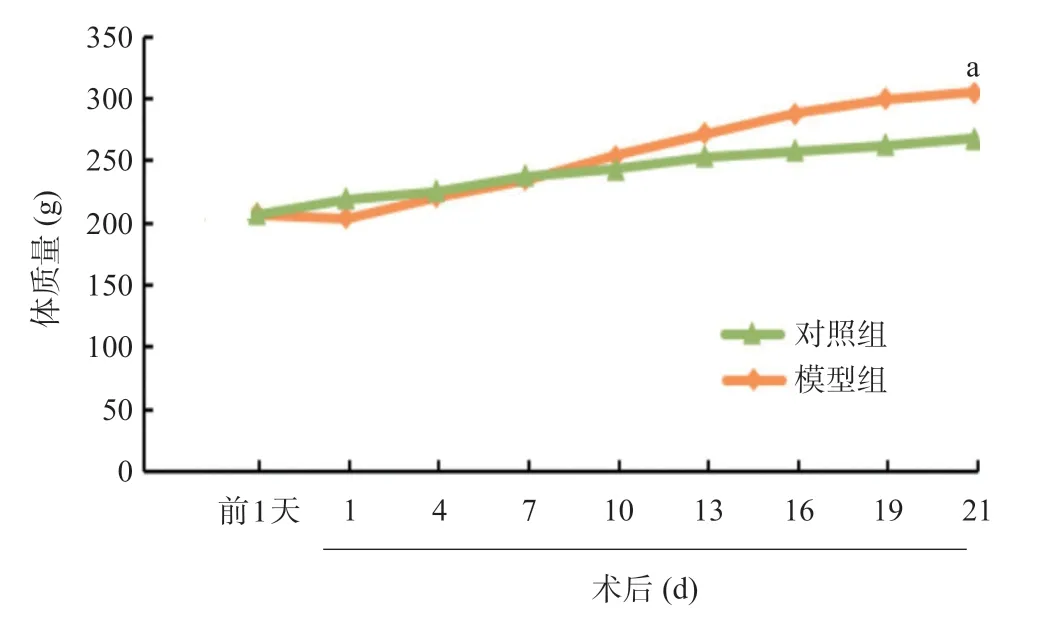
图1 两组大鼠体质量对比
2.2 实验大鼠FSH、E2水平 与对照组比,模型组大鼠血清FSH水平显著升高[(12.57±4.88)IU/Lvs.(38.03±6.40)IU/L,t=7.752,P<0.001],E2水平显著降低[(16.17±4.67)pmol/Lvs.(7.31±4.05)pmol/L,t=-3.511,P=0.006]。
2.3 基于16s rRNA对大鼠肠道菌群分析
2.3.1 大鼠肠道菌群共有物种分析:在样本中,根据物种是否存在来寻找分组之间的特有或共有的物种,我们绘制韦恩图分析不同样品组之间特有或共有的物种,通过对两组符合检测要求的样品的肠道菌群进行16S rDNA分析,两组共有物种为518个操作分类单位(operational taxonomic units, OTU),对照组特有物种为972个OTU,模型组特有物种为1 411个OTU。
2.3.2 Alpha多样性指数稀释性曲线:曲线以横坐标代表样本数目,纵坐标代表测序深度,物种累积曲线可以对测序深度是否充足进行判断,箱形图位置急剧上升表明是测序深度不够,需要增加测序深度,可以发现更高物种多样性;箱形图位置趋于平稳,则表示测序深度足够,可以进行数据分析。如图2结果显示,曲线末端上升趋势趋于平缓,说明本研究测序深度充足,足以涵盖整个群落结构。
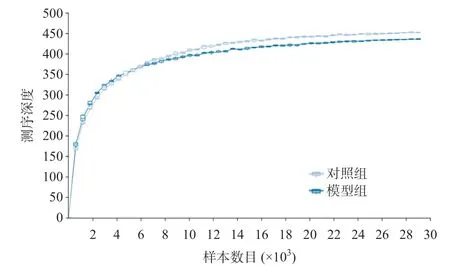
图2 Alpha多样性指数稀释性曲线
2.3.3 Alpha多样性指数统计分析:Alpha多样性指数通常用chao1、Observed_OTUs、Shannon、simpson等指数来评估样本的物种多样性,指数越高,表明样本的多样性越复杂。从对照组到模型组,物种多样性呈下降态势,但差异无统计学意义(P>0.05),说明组内肠道菌群的物种组成差异不大,见图3。
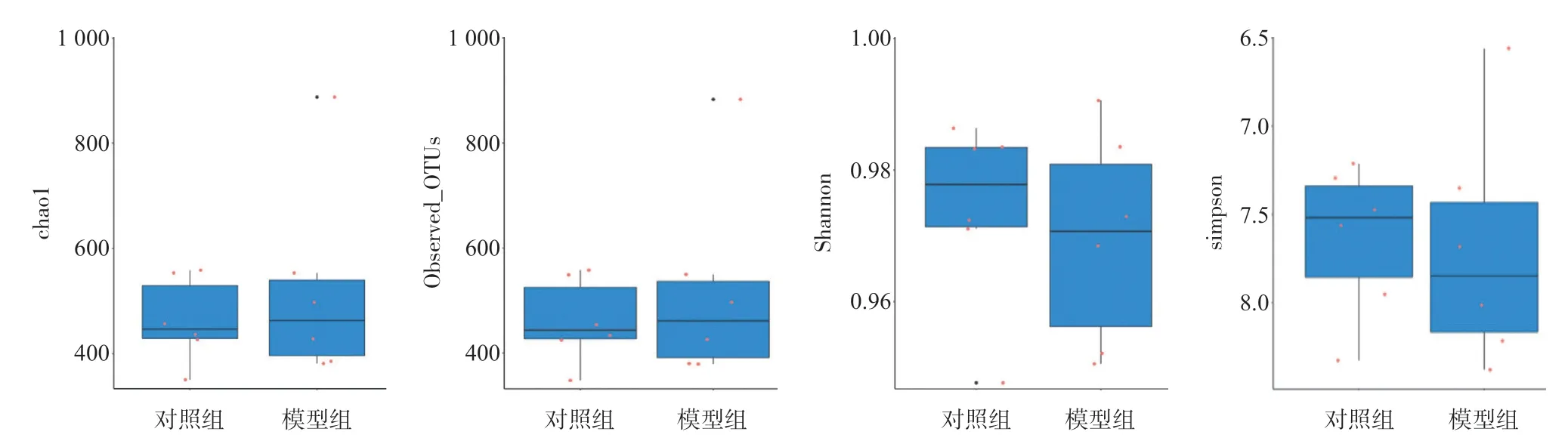
图3 Alpha多样性指数统计分析
2.3.4 Beta多样性指数统计分析:主成分分析(principal component analysis, PCoA)见图4,PC1:PC2表示对总体方差解释的百分比(21.1%:15.7%),组间Permanova差异分析显示,对照组和模型组间的物种结构差异有统计学意义(P=0.002),说明去卵巢前后肠道菌群物种结构发生显著变化。
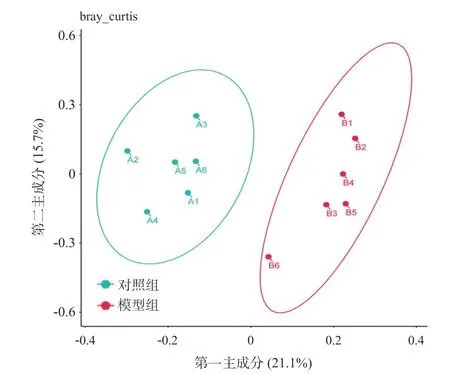
图4 样本Beta多样性指数分析
2.4 基于宏基因对肠道菌群物种多样性观察
2.4.1 对肠道菌群种水平的观察:在种水平,对照组与模型组相比,两组间丰度前20 物种在罗伊氏乳杆菌(Limosilactobacillus reuteri,对照组9.7%,模型组1.9%,Z=-2.082,P=0.037)、嗜酸乳杆菌(Lactobacillus acidophilus,对照组4.7%,模型组0.04%,Z=-2.562,P=0.010)、未分类普雷沃氏菌(unculturedPrevotellasp.,对照组4.6%,模型组0.03%,Z=-2.882,P=0.004)种差异有统计学意义(P<0.05),见图5。
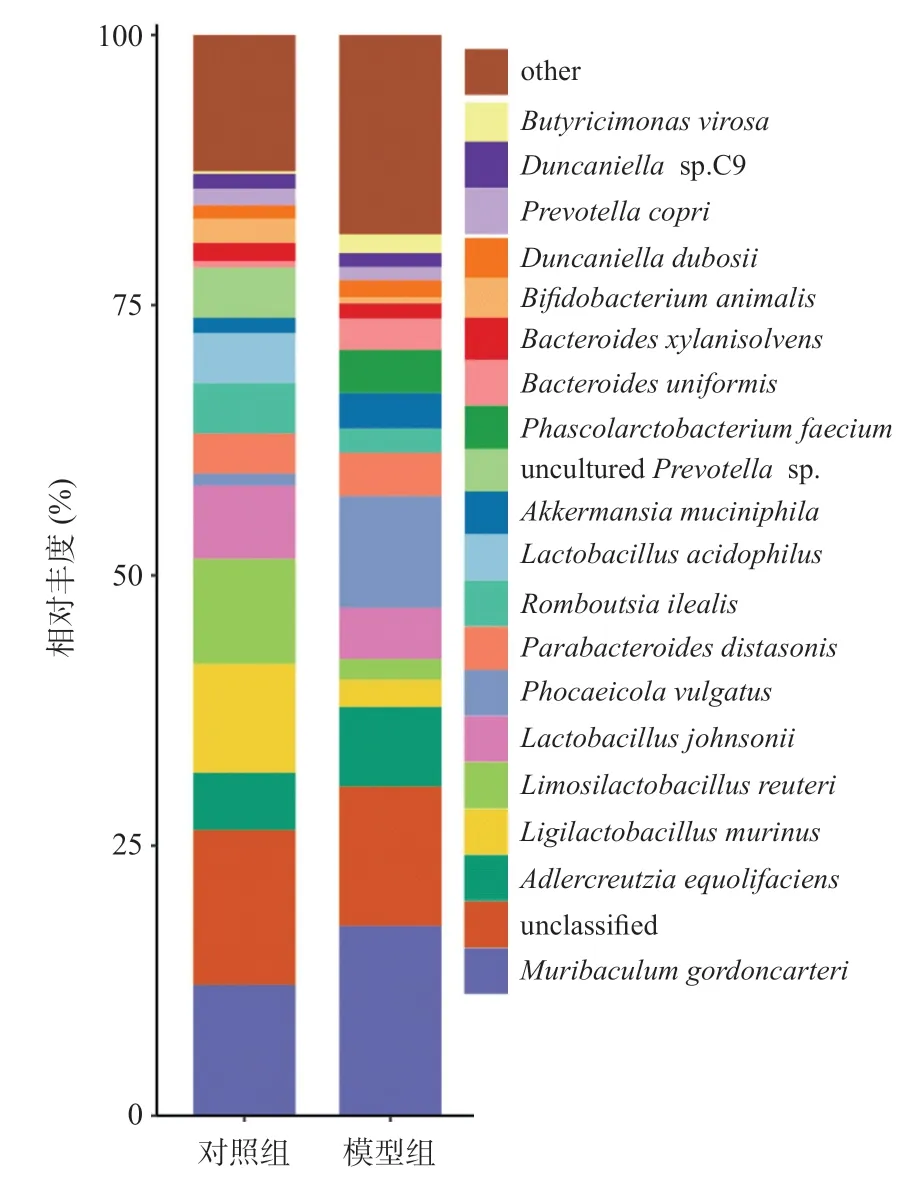
图5 种水平上肠道菌群相对丰度(前20的物种)
2.4.2 功能数据库注释(KEGG)
2.4.2.1 功能相对丰度概况:在KEGG Pathway数据库中,Level 1 层级中两组没有差异有统计学意义的功能(P>0.05),见图6A。在level 2层级上,碳水化合物代谢(Carbohydrate metabolism)、氨基酸代谢(Amino acid metabolism)通路中的功能基因表达较高,见图6B。

图6 不同层级功能相对丰度概况
2.4.2.2 功能相对丰度差异性分析:在Level 3水平(见图7),基于KEGG数据库,我们通过线性判别分析法(LEfSe,LDA>2,P<0.05)确定了两组中代谢通路的差异丰度,每横向柱代表一个通路,柱形的颜色对应分组的特征代谢通路ID,柱形的长度对应LDA值[8]。两组间共鉴定出27个丰度相对较高的代谢通路。模型组显著富集在苯丙氨酸、酪氨酸和色氨酸生物合成(map00400)、脂多糖生物合成(map00540)、泛酸盐和辅酶A生物合成(map00770)、新生霉素生物合成(map00401)、果糖和甘露糖代谢(map00051)、细胞凋亡(map04210)等通路。对照组显著富集在酮体的合成与降解(map00072)、牛磺酸和低牛磺酸代谢(map00430)、萘降解(map00626)、脂肪酸降解(map00071)、芳香族化合物的降解(map01220)等通路。

图7 KEGG的基本代谢通路LEfSe分析LDA柱形图
KO(KEGG Orthologous groups)LefSe组间差异比较结果显示,模型组在脂多糖生物合成通路中显著富集,说明注释到的功能基因在这通路中占据优势。脂多糖生物合成通路中模型组lpxA、lpxK和kdsB特征基因大部分来自Bacteroides vulgatus、Akkermansia muciniphila、Bacteroides dorei、Bacteroides massiliensis、Parabacteroidesdistasonis、Alistipes senegalensis,lpxA、lpxK也来源于Bacteroides xylanisolvens,kdsB也来源于Escherichia coli。见图8。
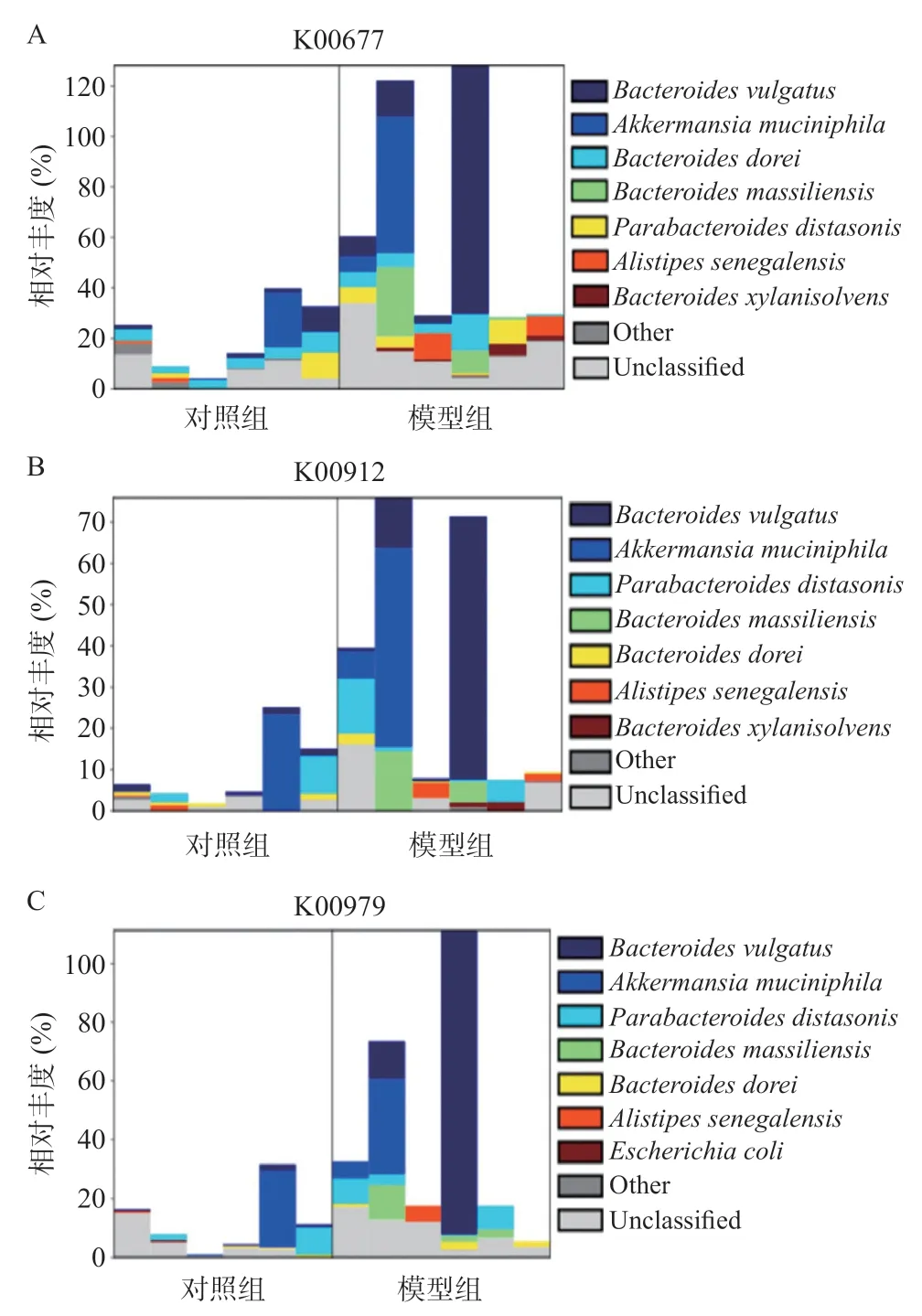
图8 特征基因分层柱状图
3 讨论
围绝经期是女性由中年步入老年的必经阶段,在此期间,由于卵巢功能衰退,体内雌激素水平急剧下降,导致糖脂代谢紊乱,从而增加了代谢综合征(metabolism syndrome,MS)的发生率[9-10]。MS可显著增加心血管疾病和糖尿病的患病风险[11]。吴立等[12]研究发现,围绝经期的女性容易发生糖脂代谢紊乱。本课题组前期的动物实验和临床实验研究也证实,围绝经期易出现体质量增加、脂代谢紊乱等问题[13-14],但其作用机制尚不明确。
肠道菌群是宿主代谢的重要调节因子之一,宿主和肠道菌群可以相互作用。研究显示[15],肠道菌群的变化与人体衰老相关,而在围绝经期这一由中年至老年的过渡时期,无论围绝经期女性是否有明显自觉不适症状,均需对她们的健康进行科学管理,以杜绝和减缓未来危害生命和生存质量的重大疾病的发生率。本研究通过模型组大鼠体质量显著高于对照组和实验大鼠血清学结果,来证明本实验造模方法的可行性。基于16S rDNA对大鼠肠道菌群进行分析,韦恩图显示两组间物种组成差异较大,但是模型组较对照组特有物种多,这一结果有待后续进一步研究。肠道菌群物种多样性观察中,Alpha多样性指数统计分析显示去卵巢前后肠道菌群的物种组成差异不大。Beta多样性指数基于Bray Curtis距离来进行PCoA分析,两组间的物种组成差异较大;然后对组间菌群进行Permanova分析,表明去卵巢前后大鼠的肠道菌群多样性存在显著差异。
宏基因技术将肠道菌群注释到种水平,与对照组相比,模型组Limosilactobacillus reuteri、Lactobacillus acidophilus和unculturedPrevotellasp.丰度显著下降。相关研究显示[16-20],Limosilactobacillus reuteri可以增加能量消耗、预防肥胖,并且可以降脂、降糖、抗炎、增强胰岛素敏感性。Prevotella为普雷沃氏菌,其丰度与脂多糖呈负相关,肥胖患者肠道中其物种丰度较低[21]。
MS与氧化应激升高之间存在很强的相关性。氧化应激是指机体在缺血、缺氧等不利因素的作用下,因活性氧浓度过高而导致细胞凋亡和组织损伤的病理生理反应,是心血管疾病、MS、心肌缺血和心肌梗死等一系列疾病的危险因素[22]。乳杆菌可以提高总抗氧化能力,并与胰岛素敏感性负相关[23],且与葡萄糖、总胆固醇和甘油三酯呈负相关,可抑制代谢炎症和促进能量消耗[24-25]。本研究结果显示,在种水平,绝经前大鼠肠道菌群较绝经后大鼠相比具有显著差异,这不仅为模型组大鼠体质量显著增加提供依据,还可通过研究绝经后大鼠的肠道菌群变化,为后期预防绝经后女性所引发的MS提供研究基础。通过观察两组大鼠在种水平肠道菌群的物种组成上的差异,推测这种肠道菌群特征的差异性也是绝经前和绝经后人群在生理和病理上出现一系列差异的原因之一。
对照组和模型组肠道菌群构成在一定程度上存在差异,这种差异是如何进一步导致了疾病的发生,就需要从功能的角度进一步研究。通过2组大鼠肠道菌群宏基因组的KEGG功能注释,在level 3层级上,脂多糖生物合成信号通路在模型组中显著富集。脂多糖生物合成途径被认为是对抗多重耐药革兰氏阴性菌的药物靶标,lpxA是脂多糖生物合成第一步催化酶的编码基因,可抑制革兰氏阴性菌的抗菌活性,可作为新的抗菌靶点[26]。脂多糖是革兰氏阴性菌细胞壁的特有成分,主要由类脂A、核心多糖和O-抗原组成,它为细菌提供了基本的渗透屏障功能,是赋予细菌抗生素抗性的关键结构[27]。脂多糖位于革兰氏阴性菌表面,负责维持外膜稳定性,这是细胞存活的先决条件[28]。此外,它是抵御有害环境因素的重要屏障。类脂A合成基因的缺失或抑制会明显影响细菌的正常生长。lpxK是类脂A生成途径中的第六种酶,另外,kdsB也参与脂多糖生物合成[28]。脂多糖是全身性低度炎症的主要原因之一,也被认为是西方饮食、炎症、肥胖和代谢紊乱之间的关键纽带[29]。肠道菌群作为人类的一大“能量代谢器官”也参与了MS的形成。由于肠道菌群发生紊乱,肠黏膜通透性增加,大量脂多糖通过与乳糜微粒结合或自然渗透入血引起内毒素血症。循环中脂多糖与脂多糖结合蛋白结合后传递信号给巨噬细胞表面的CD14分子从而激活Toll样受体(TLR4),引起免疫应答[30],释放大量的炎性因子,从而引起机体慢性炎性反应。围绝经期引起糖脂代谢紊乱可增加MS的发病,免疫学说认为炎症细胞因子水平可能在PMS发生发展中起重要作用[31]。可见,脂多糖生物合成通路中高丰度的lpxA、lpxK、kdsB的表达与PMS相关。
综上所述,与对照组大鼠相比,模型组大鼠肠道菌群显著减少,通过16S rDNA和宏基因测序技术,将物种水平鉴定到种水平,主要集中在Limosilactobacillus reuteri、Lactobacillus acidophilus和unculturedPrevotellasp.,两组大鼠肠道菌群的组成发生变化,可能是导致围绝经期前后出现生理病理学差异的作用机制。另外通过KEGG功能注释,模型组脂多糖生物合成信号通路为特征通路,提示与PMS密切相关。肠道菌群作为一个庞大且复杂的微生物群体,菌种间有着复杂的相互影响,在未来探索每个细菌种类具体的生理作用机制的同时,要从肠道菌群整体出发,将各种微生物的功能联系起来,才有可能阐明肠道菌群与绝经前后的关系。该研究为进一步采用敲除lpxA、lpxK和kdsB基因法验证PMS的研究奠定了基础。
