牡丹野生种根际土壤细菌群落特征分析
2023-05-29郭丽丽张晨洁沈佳佳张凯月何丽霞侯小改
郭丽丽,张晨洁,王 菲,沈佳佳,张凯月,何丽霞,郭 琪,侯小改*
(1.河南科技大学农学院/牡丹学院,河南 洛阳 471023;2.河南科技学院资源与环境学院,河南 新乡 453003;3.甘肃省农业技术推广总站,甘肃 兰州 730020)
牡丹(Paeonia×suffruticosa)属芍药科芍药属牡丹组(Sect.Moutan)多年生木本植物。根据花盘质地和形态可分为革质花盘亚组和肉质花盘亚组,革质花盘亚组包括1个栽培种牡丹和5个野生种,即卵叶牡丹(P.qiui)、稷山牡丹(P.jishanensis)、杨山牡丹(P.ostii)、紫斑牡丹(P.rockii)、四川牡丹(P.decomposita);肉质花盘亚组包括4个野生种,即紫牡丹或称滇牡丹(P.delavayi)、黄牡丹(P.lutea)、狭叶牡丹(P.potanini)和大花黄牡丹(P.ludlowii)[1]。牡丹组的9个野生种均为我国特有种[1],是杂交育种的亲本来源[2],在系统演化、生物多样性保护、新品种培育和改良等研究中具有重要作用,同时也具有极高的观赏价值、经济价值与科学研究价值[3-6]。
根际是土壤、根系以及微生物三者之间相互作用的关键区域[7],根际土壤微生物数量庞大,群落丰富且功能多样[8],在促进土壤养分转化、物质循环、能量流动等过程中发挥着重要作用[9-11]。在环境变化、人为干扰等多因素的影响下,根际土壤微生物群落常处于动态变化的过程中[12],其与植物之间的相互作用在植物生长发育中发挥积极作用,能够提高植物对环境的适应性和抗性[13]。因此,探究根际土壤微生物的群落结构和组成有利于理解土壤生态系统对植物生长和健康的影响[14]。
目前,关于牡丹根际微生物群落结构的研究相对较少,而且主要集中在栽培品种上,如耿晓东等[15]发现不同种植年限‘凤丹’(P.ostii‘Feng Dan’)根际真菌群落多样性表现为6年生>3年生>10年生;李昱莹等[16]报道了不同种植年限‘凤丹’根际土壤真菌群落多样性为10年生>5年生>32年生>4年生>2年生,而‘凤丹’根际土壤细菌多样性则随种植年限的延长而呈下降趋势[17]。此外,牡丹根际土壤中微生物总数量大于非根际土壤,其中细菌占主要优势[18]。Xue等[19]报道了牡丹种植年限和栽培品种对土壤微生物群落结构的影响。Yang等[5]对牡丹根和叶内生细菌多样性进行了分析,结果表明‘雪莲’(P.rockii‘Xuelian’)、‘花王’(P.suffruticosa‘Kaoh’)和‘正午’(P.suffruticosa×P.delavayivar.lutea‘High Noon’)牡丹根内细菌的OTU丰度高于叶内,优势菌群为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)。利用Illumina高通量测序技术对4个种源地四川牡丹根际土壤微生物和种子内生菌的组成研究发现,同一种源地根际土壤和种子中有70%以上的相同细菌序列,而相同的真菌序列最高约50%,且土壤有机碳、氮、磷含量等性质均会对根际土壤微生物及内生菌的组成结构产生一定影响[20]。大量研究表明牡丹根际微生物对维持牡丹健康和土壤肥力具有重要的生态学意义[5, 19, 21-23]。然而,牡丹野生种根际土壤微生物群落结构和多样性的研究尚鲜见报道。
本研究结合MiSeq高通量测序技术和生物信息学方法,对引种地的9个牡丹野生种根际土壤细菌群落特征进行分析,探究其根际土壤微生物群落结构和多样性与土壤理化性质的关系,旨在挖掘和培育有利于牡丹野生种健康生长的根际微生物菌群,为开展牡丹种质资源保护、新品种培育和种质创新提供理论基础和实践依据。
1 材料与方法
1.1 牡丹野生种基本信息
本研究选取9个牡丹野生种,分别于1992年(大花黄牡丹)、1998年(稷山牡丹、紫斑牡丹、四川牡丹、狭叶牡丹、紫牡丹和黄牡丹)和1999年(卵叶牡丹和杨山牡丹)从西藏林芝、山西稷山县、甘肃子午岭林区、四川马尔康县、四川雅江县、云南丽江、云南中甸县、湖北神农架和河南杨山引种到甘肃省农业技术推广总站(103°88′E,36°05′N),并采用统一的施肥、灌溉等措施对其进行日常管理。
1.2 根际土壤的采集
本研究所用的9种牡丹的根际土壤样品于2019年采自甘肃省农业技术推广总站。牡丹根际土壤采集方法参考Han等[24]方法,即每个野生种随机选取3株长势一致的植株,去除土壤表层植物残体,在每株牡丹主茎四周10 cm处利用土钻采集5个样点的土壤,每个采样点取1芯(直径5 cm,深度20 cm)。混匀后按四分法收集约200 g根际土壤并分为两份,其中一份置于-80 ℃冰箱保存,用于微生物群落特征的分析;另一份置于室内风干,用于土壤性质测定。
1.3 试验方法
1.3.1 DNA的提取和PCR扩增
采用EZNA©Soil DNA Kit试剂盒(Omega Bio-Tek,USA)对采集的27份根际土壤样品进行微生物组总DNA的提取,通过1%(质量分数,下同)琼脂糖凝胶电泳和超微量分光光度计(IMPLEN,德国)检测DNA的质量和纯度,高质量DNA样品置于-20 ℃储存备用。以细菌16S rRNA基因V3+V4区域338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)为引物[25],微生物总DNA为模板,使用Phusion酶进行PCR扩增,PCR反应体系如下:Pusion Hot start flex 2X Master Mix 12.5 μL、引物338F和806R各2.5 μL、DNA模板50 ng、加ddH2O至25 μL;反应条件为98 ℃ 30 s、98 ℃ 10 s、54 ℃ 30 s、72 ℃ 45 s、35个循环,72 ℃ 10 min,4 ℃保存。通过PCR在目标区域扩增产物上添加测序通用接头和样本特异性Barcode序列。PCR扩增产物通过1.5%琼脂糖凝胶电泳进行检测,使用AMPure XT beads回收试剂盒对目标片段进行回收,具体步骤参考试剂盒中的操作说明。
1.3.2 高通量测序
纯化后的PCR产物采用Quant-iT PicoGreen dsDNA试剂盒在Promega QuantiFluor荧光定量系统上对文库进行定量、混库。利用Illumina测序平台250 PE(杭州联川生物技术股份有限公司)及按照标准操作进行双端测序。
1.3.3 生物信息学分析
在特定的过滤条件下对原始数据进行质量过滤,使用Vsearch软件(V2.3.4)过滤嵌合体序列并进行质控分析,获得最终数据。使用Blast分类比对软件进行物种分析,使用UPARSE 8.0按照相似度97%将序列聚类成操作分类单元(OTUs),通过核糖体数据库项目(RDP)分类器将分类注释分配给每个OTU的代表性序列。所获得的细菌16S rRNA基因序列保存在国家生物技术信息序列读取档案中心(登记号PRJNA760268)。
1.3.4 根际土壤性质的测定
根际土壤样品经风干后,分别过0.150和0.850 mm筛以供土壤指标的测定。使用土壤酸碱度计进行土壤pH的测定,土壤有机质含量(soil organic matter,SOM)采用重铬酸钾滴定法测定,全氮含量(total nitrogen,TN)采用半微量开氏法测定,速效磷含量(available phosphorous,AP)采用0.5 mol/L NaHCO3浸提和钼锑抗比色法测定,速效钾含量(available kalium,AK)采用1 mol/L的NH4OAc浸提和火焰光度法测定[26]。
1.4 数据分析
对9个牡丹野生种根际土壤细菌的Alpha多样性(Chao1丰富度估计量、物种丰富度指数、测序深度指数、Shannon多样性指数、Simpson多样性指数)进行分析,以表示细菌种群的丰富度、多样性、优势度和均匀度。采用SPSS 26.0进行Beta多样性分析,其基于距离矩阵的主坐标分析(PCoA)以评价细菌群落的差异。采用OmicStudio(https://www.omicstudio.cn/tool)工具进行LEfSe(LDA Effect Size)分析用于验证样本中不同根际土壤细菌类群的差异性。利用OmicStudio工具中PICRUSt2功能预测云分析对9个野生种根际土壤细菌群落的功能进行预测。
采用SPSS 26.0对土壤性质的数据进行统计和单因素(One-way ANOVA)方差分析,通过新复极差法(Duncan)来比较各处理间差异的显著性,使用OmicStudio工具对优势细菌的相对丰度和土壤性质进行相关分析和冗余分析(redundancy analysis,RDA)并作图,利用Origin 2018进行作图。
2 结果与分析
2.1 牡丹野生种根际土壤性质特征
由牡丹根际土壤的性质(表1)可知,牡丹野生种在其引种地根际土壤pH分布在8.16~8.44,其中杨山牡丹根际土壤pH最高,与其他种呈显著差异(P<0.05);其次是狭叶牡丹、四川牡丹、紫斑牡丹、稷山牡丹和大花黄牡丹;黄牡丹、卵叶牡丹和紫牡丹的根际土壤pH最小,且与狭叶牡丹根际存在显著差异(P<0.05)。9种野生牡丹根际土壤有机质含量不同,四川牡丹和紫斑牡丹根际土壤有机质含量最高,黄牡丹、狭叶牡丹和稷山牡丹根际土壤含有的有机质最少,前两种与后3种间存在显著差异(P<0.05)。四川牡丹和黄牡丹根际土壤全氮含量最高,且显著高于紫斑牡丹和狭叶牡丹(P<0.05)。根际土壤速效磷含量表现为黄牡丹>卵叶牡丹>杨山牡丹>大花黄牡丹>狭叶牡丹>紫斑牡丹>四川牡丹>稷山牡丹>紫牡丹。大花黄牡丹根际土壤中速效钾含量最高,显著高于其他种;其次为黄牡丹与紫牡丹,显著高于除大花黄牡丹外的其他种;卵叶牡丹和狭叶牡丹根际土壤中速效钾含量显著低于除杨山牡丹外的其他种(P<0.05)。
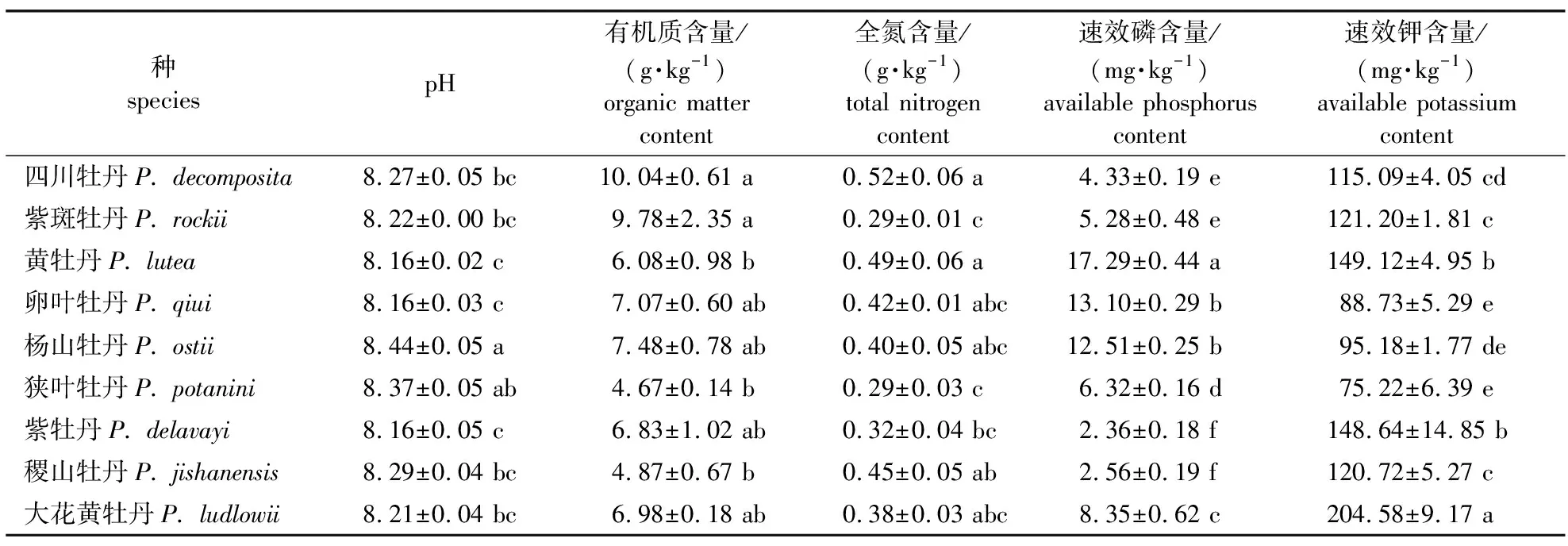
表1 牡丹野生种根际土壤的理化性质
2.2 根际土壤细菌群落结构与组成
9个牡丹野生种根际土壤细菌16S rDNA测序共获得606 536个原始序列片段,共计247.71 Mb。其中长度小于200 bp序列片段有3 997条,≥200~300、≥300~400、≥400~500 bp分别有5 558、165 721、431 260条。这些序列依次聚类到3 168、2 604、1 903、1 713、3 702、3 217、580、853和2 291个OTU单元。
2.2.1 多样性分析
在相似性≥97%的水平上对各样品的有效序列进行OTU聚类,筛选出OTUs的代表性序列,共获得60 092个OTUs,并利用R程序制作花瓣图(图1)。由图1可知,9个野生种样品所含OTU数目均由特异OTU数目和共有OTU数目组成,重叠区包含377个共有OTU数目。各样品所含特异OTU数目以稷山牡丹最多(114个),四川牡丹最少(18个)。
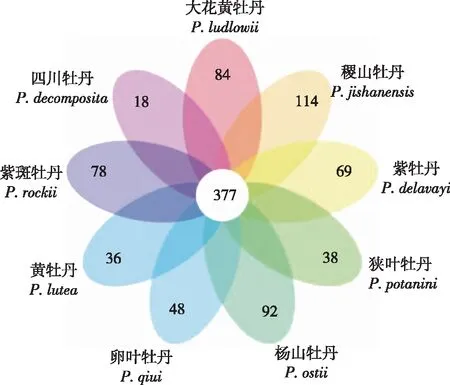
图1 牡丹野生种根际土壤样品的OTU分析Fig.1 OTU analysis of rhizosphere soil samples of wild tree peony
对牡丹土壤根际细菌群落进行Alpha多样性分析结果见表2。Chao1丰富度估计量和物种丰富度指数主要反映样本的物种丰富度信息,估计群落中包含物种的数目,由表2中Chao1和物种丰富度结果可知,9个牡丹野生种中杨山牡丹根际土壤细菌群落包含的物种数目最高,紫牡丹和稷山牡丹两个种根际土壤样本中物种数目含量最少,与除卵叶牡丹外的其他种间存在显著性差异(P<0.05)。Shannon和Simpson多样性指数同时反映样品中物种种类的数目,以及样品中不同种类的物种丰度的平均性或均匀性,在相同的测序深度下,狭叶牡丹、杨山牡丹、四川牡丹、大花黄牡丹、紫斑牡丹和黄牡丹根际土壤细菌的Shannon和Simpson多样性指数较高,且与紫牡丹和稷山牡丹差异显著,表明6个牡丹野生种多样性较其他种更高。测序深度指数能够反映样本低丰度OTU覆盖情况,9个样本的数值均大于0.85,表明测序深度已基本覆盖到样品中所有种,样本所构建的细菌文库能够比较有效地反映其多样性。
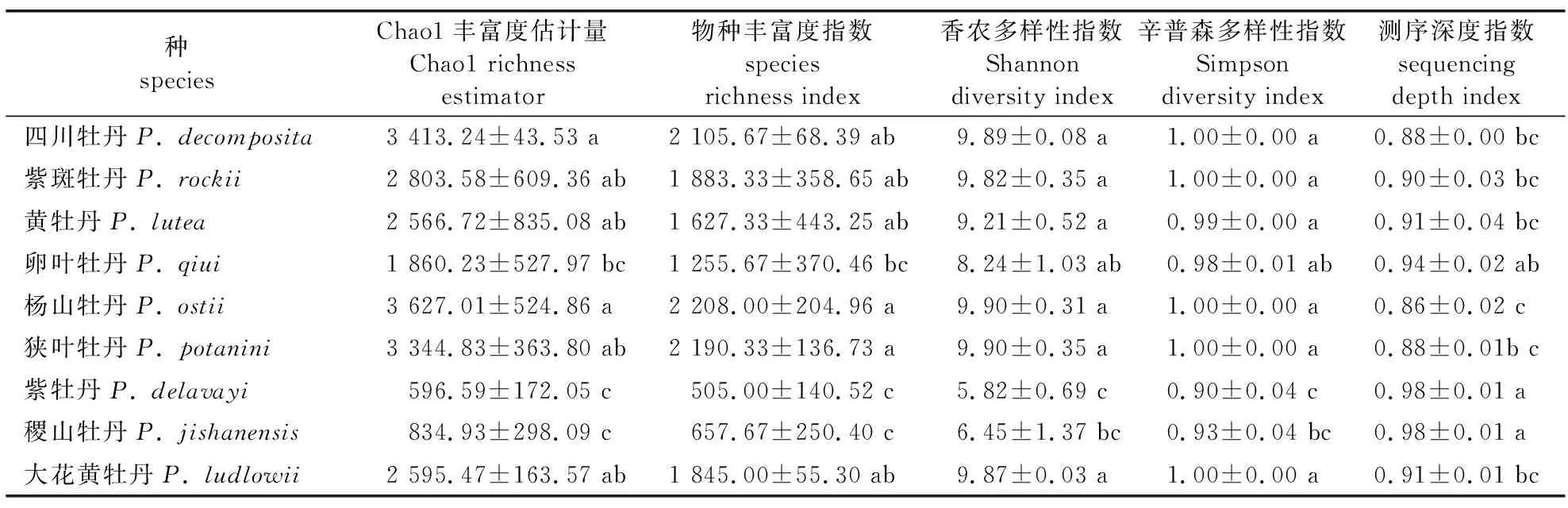
表2 牡丹野生种根际土壤样品的Alpha多样性分析
通过PCoA(图2)分析发现,各样本细菌群落组成具有明显差异。其中四川牡丹、紫斑牡丹、黄牡丹、杨山牡丹、狭叶牡丹和大花黄牡丹分布距离较近,说明其根际土壤中细菌群落结构相似;稷山牡丹、紫牡丹和卵叶牡丹与其他6组分布距离较远,表明三者根际土壤中细菌群落差异显著。

图2 基于Weight-UniFrac方法的牡丹野生种根际土壤样品PCoA分析Fig.2 PCoA analysis of rhizosphere soil samples of wild tree peony based on the Weight-UniFrac method
2.2.2 细菌群落结构组成分析
基于OTU分类结果,9个牡丹野生种根际土壤细菌16S rRNA基因序列被分为24门、84纲、154目、280科和603属。
9个牡丹野生种根际土壤样本的细菌群落微生物多样性的整体分布结果表明:在门水平上(表3),根际土壤样本的核心优势细菌群落主要由变形菌门(Proteobacteria,相对丰度9.35%~34.20%)、酸杆菌门(Acidobacteria,相对丰度12.59%~35.61%)、放线菌门(Actinobacteria,相对丰度9.07%~42.13%)和绿弯菌门(Chloroflexi,相对丰度3.12%~17.44%)组成,总占比为79.96%,剩下的14.21%涉及19个门。其中,芽单胞菌门(Gemmatimonadetes,相对丰度0.53%~4.71%)、拟杆菌门(Bacteroidetes,相对丰度1.06%~5.49%)、厚壁菌门(Firmicutes,相对丰度0.58%~12.83%)、硝化螺旋菌门(Nitrospirae,相对丰度0.28%~2.58%)、疣微菌门(Verrucomicrobia,相对丰度0.38%~1.72%)也表现出了较高的相对丰度。有5.83%的序列在门水平上不能进行分类。
在门水平上的单因素方差分析结果表明,不同细菌在不同牡丹野生种根际土壤中丰度存在显著差异。变形菌门在紫牡丹和稷山牡丹中丰度显著低于除卵叶牡丹外的其他种(P<0.05);酸杆菌门在四川牡丹中丰度最高,在紫牡丹和稷山牡丹中丰度较低,两者存在显著差异(P<0.05);紫牡丹和稷山牡丹中放线菌门丰度显著高于除卵叶牡丹外的其他种(P<0.05);绿弯菌门在紫牡丹中丰度最高(P<0.05),和四川牡丹、黄牡丹根际中丰度存在显著差异(P<0.05);四川牡丹、杨山牡丹和狭叶牡丹中芽单胞菌丰度较高,与紫牡丹和稷山牡丹存在显著差异(P<0.05);拟杆菌门在大花黄牡丹根际土壤中丰度最高,在卵叶牡丹、稷山牡丹和紫牡丹中丰度较低,前者与后三者间存在显著差异(P<0.05);厚壁菌门在稷山牡丹中丰度最高,与其他8个种差异显著(P<0.05);硝化螺旋菌门在大花黄牡丹根际土壤中丰度最高,在紫牡丹中丰度最低;疣微菌门在紫斑牡丹中丰度最高,在四川牡丹和稷山牡丹中丰度最低,差异显著(P<0.05)。
2.3 牡丹9个野生种根际土壤细菌差异分析
LEfSe分析结果(图3)表明,四川牡丹根际细菌群落中硝化螺旋菌门、酸杆菌门、贪铜菌属(Cupriavidus)、亚硝化螺菌属(Nitrosospira)、Gp22、Gp4、Gp17和Gp4等相对丰度较高且具有统计学意义;紫牡丹中绿弯菌门、放线菌门、小单孢菌属(Micromonospora)、暖绳菌属(Caldilinea)等存在显著差异;在大花黄牡丹中起到重要作用的细菌类别为硝化螺旋菌门、黄杆菌属(Flavobacterium)、嗜热光合细菌属(Roseiflexus)、根瘤菌属(Chelativorans)和Gp3;黄牡丹中起到重要作用的细菌为变形菌门、甲基弯菌属(Methylosinus)和假单胞菌属(Pseudomonas);杨山牡丹中为芽单胞菌门;卵叶牡丹中马杜拉放线菌属(Actinomadura)相对丰度较高。
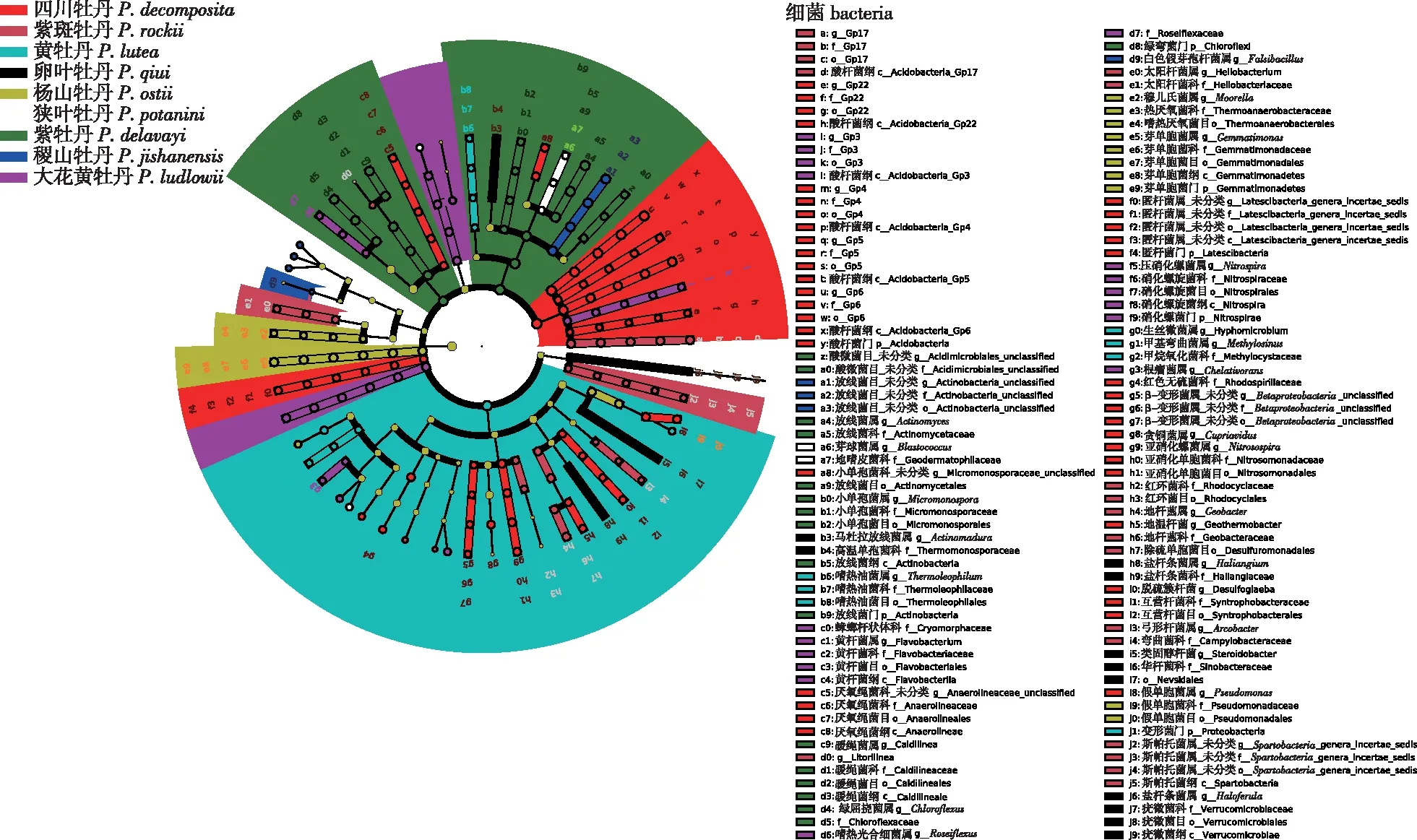
不同的圈层从内向外辐射,代表物种的7个分类级别,每个节点代表该级别下的物种分类;彩带的颜色代表植物种;不同节点的字母代表的具体细菌种类标记在图的右侧。Different circles radiate from inside to outside, representing seven classification levels of species, and each node represents the classification of species under this level; the color of the ribbon represents the plant species; the bacterial species represented by the letters of different nodes are marked on the right side of the figure.
2.4 牡丹9个野生种根际土壤细菌功能预测
利用PICRUSt软件进行细菌功能预测。选取丰度排名前35的第3层级功能及它们在每个样品中的丰度信息绘制热图(图4)。不同样本根际细菌群落的功能预测多集中在代谢、遗传信息处理和环境信息处理相关通路上,如转录因子、一般功能预测、ABC转运体、DNA修复和重组蛋白、双组分系统、分泌系统、核糖体、嘌呤代谢、未知功能、细菌运动蛋白、转录因子、肽酶、嘧啶代谢、氨基酸相关酶、染色体、核糖体合成、其他离子偶联转运蛋白、氧化磷酸化、精氨酸和脯氨酸代谢、丙酮酸代谢、原核生物中的碳固定途径等。与紫牡丹、黄牡丹和大花黄牡丹相比,杨山牡丹根际细菌中差异功能最为显著,狭叶牡丹次之。

色带相应颜色与热图矩阵数据相映射,靠近正值颜色(红色)即为正相关,靠近负值颜色(蓝色)即为负相关。The corresponding color of the color band is mapped to the heat map matrix data, and the color close to the positive value (red) is positive correlation and the color close to the negative value (blue) is negative correlation.
2.5 土壤环境因子与根际土壤细菌群落的关系
相关性分析(图5)发现,牡丹根际土壤有机质含量与细菌中变形菌门、酸杆菌门、匿杆菌门和纤维杆菌门(Fibrobacteres)相对丰度呈极显著正相关(P<0.01),与芽单胞菌门和硝化螺旋菌门相对丰度呈显著正相关(P<0.05);与放线菌门、绿弯菌门和candidatus Saccharibacteria相对丰度呈极显著负相关(P<0.01),与厚壁菌门(Tenericutes)呈显著负相关(P<0.05)。土壤速效钾含量与拟杆菌门相对丰度呈极显著正相关(P<0.01),与变形菌门和硝化螺旋菌门相对丰度呈显著正相关(P<0.05);与放线菌门呈显著负相关(P<0.05)。

**.P<0.01;*.P<0.05;色带相应颜色与热图矩阵数据相映射,靠近正值颜色(红色)即为正相关,靠近负值颜色(蓝色)即为负相关。The corresponding color of the color band is mapped to the heat map matrix data, and the color close to the positive value (red) is a positive correlation and the color close to the negative value (blue) is a negative correlation.
冗余分析(图6)表明,第一、二排序轴分别解释了土壤细菌群落结构变化的0.687%和37.640%。5个环境因子分布在3个象限中,其中pH落在第一象限,与落在第二、三象限的4种土壤环境因子(全氮、速效磷、速效钾和有机质含量)呈负相关。9个牡丹野生种根际土壤微生物中放线菌门和绿弯菌门与pH因子呈正相关,与全氮、速效磷、速效钾和有机质含量呈负相关;酸杆菌门和变形菌门与全氮、速效磷、速效钾和有机质含量呈正相关,与pH呈负相关。9个牡丹野生种与环境因子的箭头越近,表明其与该环境因子的正相关性越大,反之负相关性越大。四川牡丹和紫斑牡丹根际土壤微生物与土壤有机质和全氮含量呈正相关;黄牡丹、杨山牡丹和大花黄牡丹的土壤根际微生物与土壤全氮、速效磷、速效钾和有机质含量呈正相关;狭叶牡丹的土壤根际微生物与土壤速效钾和速效磷含量呈正相关;紫牡丹的根际土壤微生物与土壤pH呈显著正相关。
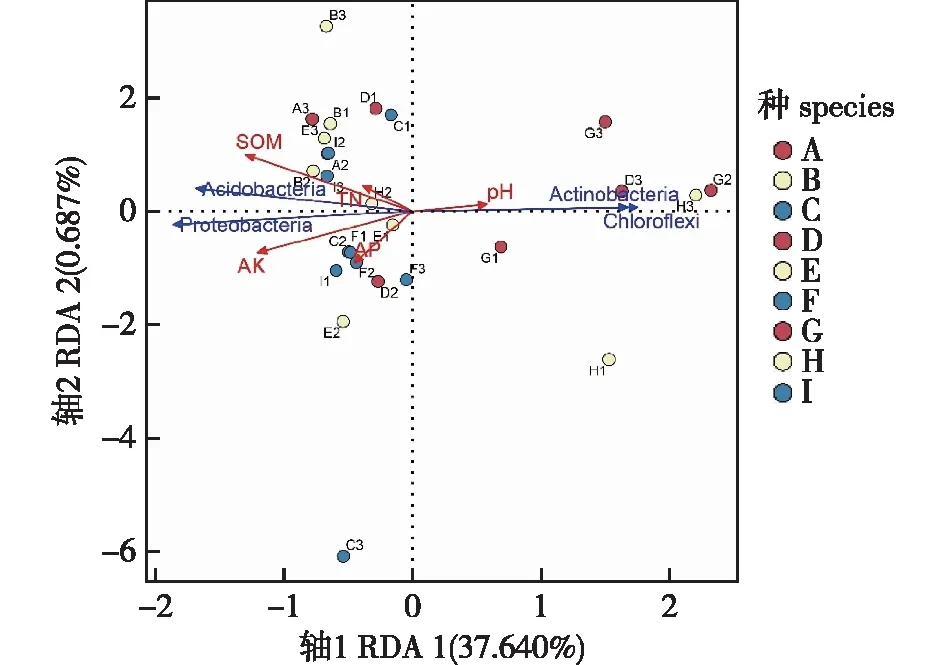
红色箭头表示环境因子,蓝色箭头表示门水平上根际土壤细菌(top 4),长短代表其在排序空间内的变化量,箭头所处象限代表其与排序轴之间相关性的正负。The red arrows represent environmental factors, the blue arrows represent rhizosphere soil bacteria (top 4) at the phylum level, the length represents its variation in the sorting space, and the quadrants where the arrows are located represent the positive and negative correlations between them and the sorting axis. A. 四川牡丹P. decomposita; B. 紫斑牡丹P. rockii; C. 黄牡丹P. lutea; D. 卵叶牡丹P. qiui; E. 杨山牡丹P. ostii; F. 狭叶牡丹P. potanini; G. 紫牡丹P. delavayi; H. 稷山牡丹P. jishanensis; I. 大花黄牡丹P. ludlowii. 数字表示重复。The number represents repetition. pH. 酸碱度potential of hydrogen; SOM. 有机质soil organic matter; TN. 全氮total nitrogen; AP. 速效磷available phosphorous; AK. 速效钾available K.Proteobacteria.变形菌门;Acidobacteria .酸杆菌门;Actinobacteria.放线菌门; Chloroflexi.绿弯菌门。
3 讨 论
野生植物种质资源的保护及利用是育种工作者面临的重要问题之一,不仅要收集和保护野生种质资源,还要通过不断研究将其合理地利用到育种中[27]。根际土壤微生物群落作为根际微生物系统的重要组成部分,驱动着土壤系统中各种生物进程,能够分解有机物,对植物生长发育起重要作用[28-29]。微生物在根际大量繁殖,构成一个旺盛的生物活动区,对植物生长发育具有很大影响,例如,加快有机质的分解、促进营养元素的转化、刺激植物的生长、避免土传病原菌的侵染等[30]。本研究采集了9个牡丹野生种根际土壤样品,分析其理化特性,并利用分子生物学和高通量测序技术对根际土壤细菌群落多样性进行研究。9个牡丹野生种分别于1992年、1998年和1999年引种到甘肃省农业技术推广总站,经过长达20多年的统一管理和驯化,已适应引种地的生长环境[31],其土壤细菌群落特征因受到不同种牡丹根系的影响而产生差异,具有种间可比性。结果发现杨山牡丹根际土壤pH最高。孙晓刚等[32]在研究土壤pH对牡丹生长和光合特性影响时发现,不同pH的土壤对植株生长产生明显的影响。然而在四川牡丹和紫斑牡丹根际土壤中有机质含量最高,在黄牡丹、狭叶牡丹和稷山牡丹根际土壤中含量最少,土壤有机质具有提供植物生长的各种养分,增强土壤的保水保肥能力和缓冲性等作用。氮磷钾含量在9个种牡丹中存在差异。此外,9个牡丹野生种根际细菌群落结构组成虽有一定的相似性,但也存在差异。9个野生种根际细菌数量最多的4个门分别为变形菌门、酸杆菌门、放线菌门和绿弯菌门。这与李怡等[33]研究发现刚竹属3个竹种根际土壤微生物土壤细菌群落相一致。Chen等[34]在高原淡水湖和上坡土壤细菌群落的研究中也得出相同的结果。对多种植物根际土壤细菌研究也发现上述菌门是优势菌门,表明植物根际土壤微生物优势菌门组成具有高度相似性[35-39]。已有牡丹相关根际微生物研究表明,变形菌门和放线菌门是不同品种牡丹根际细菌群落中共有的优势菌门[17, 24]。除了这些具有促进生长发育的优势菌门外,牡丹野生种根际中还具有较高丰度的酸杆菌门和绿弯菌门,推测这和牡丹野生种耐酸和耐热的生长习性有关。
Alpha多样性分析发现,杨山牡丹根际细菌群落数目最高。Beta分析结果表明稷山牡丹、紫牡丹和卵叶牡丹根际微生物群落结构与四川牡丹、紫斑牡丹、黄牡丹、杨山牡丹、狭叶牡丹和大花黄牡丹存在差异。上述结果表明不同牡丹野生种根际细菌群落的Alpha及Beta多样性不同,且结构和丰富度是动态变化的。狭叶牡丹和四川牡丹产于四川西部,生长在海拔2 800~3 700 m的山坡灌丛中;稷山牡丹分布于陕西延安,生长在山坡疏林中;杨山牡丹为江南种,是中原牡丹品种群祖先之一。因此,推测根际菌群结构可能与其适宜生长环境有关。
差异分析发现,牡丹野生种根际细菌群落中的酸杆菌门和亚硝化螺菌属(四川牡丹)、绿弯菌门(狭叶牡丹)、硝化螺旋菌门(大花黄牡丹)、假单胞菌属(黄牡丹)及芽单胞菌门(杨山牡丹)等有益菌种在生态系统中扮演耐酸、耐热、矿化有机物等重要角色[40-43],今后有望分离有益菌种应用于实践,这些细菌在牡丹生长过程中与其他植物一样发挥着重要作用。基于PICRUSt2功能预测,发现不同样本根际细菌群落的功能预测多集中在代谢、遗传信息处理和环境信息处理相关通路上,表明野生种牡丹根际细菌在这些途径和效应中发挥重要作用。土壤环境因子与根际土壤细菌群落的相关性分析结果表明,对牡丹野生种根际细菌群落影响较大的土壤环境因子主要是有机质和速效钾。冗余分析结果表示,四川牡丹和紫斑牡丹根际土壤细菌受土壤有机质和全氮影响较大,黄牡丹、杨山牡丹和大花黄牡丹受土壤全氮、速效磷、速效钾和有机质影响,对狭叶牡丹影响较大的是土壤速效钾和速效磷,对紫牡丹影响较大的是土壤pH。
4 结 论
本研究分析了9个牡丹野生种在其引种地的根际土壤理化特性,并利用Miseq高通量测序技术探究了土壤细菌群落组成和物种丰度。土壤pH、有机质、全氮、速效磷和速效钾含量在不同种牡丹根际存在显著差异。野生种根际土壤细菌群落组成和物种丰度非常丰富,但不同种间存在显著差异。变形菌门、酸杆菌门、放线菌门和绿弯菌门是主要优势菌门,相对丰度之和可达79.9%。酸杆菌门、绿弯菌门、硝化螺旋菌门、芽单胞菌门、亚硝化螺菌属和假单胞菌属等有益菌种在不同种间存在差异。根际细菌群落功能预测多集中在代谢、遗传信息处理和环境信息处理方面。对牡丹野生种根际细菌群落影响较大的土壤环境因子为有机质和速效钾。研究结果对有效利用微生物资源和保护野生植物种质资源具有重要的理论意义,为改良牡丹野生种的土壤环境、实现优质种质资源广谱性种植奠定基础。
