基于宏基因组学解析高温大曲微生物群落与功能的异质性
2023-05-28张芮刘文虎张立强杨阳魏阳王松涛冉茂芳王世宽沈才洪
张芮,刘文虎,张立强,杨阳,魏阳,王松涛,冉茂芳,王世宽,沈才洪*
(1.四川轻化工大学生物工程学院,四川自贡 643000;2.泸州品创科技有限公司/国家固态酿造工程技术研究中心,四川泸州 646000;3.泸州老窖股份有限公司,四川泸州 646000)
大曲是传统白酒酿造的重要原料之一,起到糖化、发酵、酒化和生香的作用,对白酒的出酒率和酒质有极大的影响[1-3]。根据曲坯中心最高发酵温度的不同,大曲分为低温大曲(45~50 ℃)、中温大曲(50~60 ℃)和高温大曲(60~65 ℃),其中,高温大曲用于酱香型白酒的生产。高温大曲以小麦为主要原料,经自然堆积发酵而成,原料粉碎、水分含量、发酵温度、安曲方式、发酵方式、过程管控等是影响高温大曲质量的重要因素,上述因素的差异导致曲药表面呈现黑褐色(黑曲)、黄褐色(黄曲)和生麦色(白曲)[4-6]。正常情况下,高温大曲发酵过程中所产黄曲的占比最高,占总产量的70 %~80 %,黑曲和白曲分别占10%和10%~20%。黑曲通常出现在发酵房中央,白曲通常出现在顶层或靠近门窗的位置[7]。由不同因素产生的3种高温大曲的微生物群落结构各不相同,黄曲和黑曲中的优势菌分别为克罗彭斯特菌属(Kroppenstedtia)和嗜热子囊菌属(Thermoascus),白曲中的主要细菌及真菌类群分别为海洋芽孢杆菌属(Oceanobacillus)和嗜热真菌属(Thermomyces)[8]。黑曲、黄曲和白曲之间的理化性质和生物酶活力存在显著差异,黑曲的酸度最高,黄曲最低;白曲的糖化力和酯化力最高,黑曲的最低[9]。Deng等[10]利用扩增子测序手段对采集自不同地区、不同颜色的高温大曲进行研究,发现克罗彭施泰特氏菌属(Kroppenstedtia)、芽孢杆菌属(Bacillus)和嗜热子囊菌属(Thermoascus)为高温大曲中的优势微生物,此外,黑曲中的主要菌群还包括糖多孢菌属(Saccharopolyspora)和嗜热真菌属(Thermomyces),黄曲中的优势菌群还包括未分类的散囊菌目(Eurotiales)真菌,表明黑曲、白曲和黄曲的理化指标、酶活力及功能微生物群落结构差异显著。
目前,高温大曲的研究已经成为热点,涉及了功能微生物、理化指标和风味差异等方面,但对功能微生物功能层面的研究相对较少。本文基于宏基因组学,对同批次黑、黄、白色高温大曲微生物群落与功能组成进行比较分析,进一步预测引起3种高温大曲品质差异的代谢途径,为深入阐明高温大曲的异质性奠定了基础,以期指导3种高温大曲在酱香型白酒生产中的应用。
1 材料与方法
1.1 样品
高温大曲样品采自贮曲仓不同位置且贮存了3个月的白曲(White_Daqu)、黄曲(Yellow_Daqu)和黑曲(Black_Daqu)各3 块。分别粉碎混匀后,装于无菌自封袋中,贮存于-20 ℃待测。
1.2 试验方法
1.2.1 DNA 提取和宏基因组测序
称取10g 高温大曲样品,用中通量组织研磨仪(鼎昊源,中国)结合液氮冷冻研磨成细粉。采用土壤DNA 试剂盒(Omega,美国)提取DNA,并用1 %琼脂糖凝胶电泳检测DNA 提取质量,采用Nano‐Drop2000 微量分光光度计(Thermo Scientific,美国)检测DNA 纯度和浓度。合格的DNA 样品用干冰寄送至上海美吉生物医药科技有限公司使用HiSeqTM X Ten 系统(Illumina,美国)进行宏基因组测序。
1.2.2 序列处理和注释
使用SOAPnuke(v1.5.6)[11]对下机原始数据进行质控过滤:去除包含不确定碱基(N 碱基)的序列,去除含50%以上低质量碱基(Q<20 的碱基)的序列,去除含测序接头的序列,去除长度<50 bp 的序列,使用snap-aligner (v1.0beta.23)[12]和samtools(v1.8)[13]过滤宿主序列,将有效数据用于后续生物信息学分析。
使用MegaHit(v1.1.2)对上述有效数据进行组装,通过MetaGeneMake(v2.1.0)[14]对组装序列进行开放阅读框(Open Reading Frames,ORFs)预测。使用CD-HIT(v4.7)[15]将相似度在95%以上且比对区域大于90 %的序列聚类为一个单元,以去除重复的冗余序列,构建样品非冗余基因集(Unigene Catalog)。使用Bowite2(v1.2.2)[16]将样品的高质量序列与基因集比对,采用Pathoscope(v1.0)[17]将序列重新分配至“最可能来源”的基因。
使用DIAMOND(v0.8.3.6)[18]将编码基因映射至NR 数据库(Non-redundant Protein Sequences from GenPept,Swissprot,PIR,PDF,PDB,and NCBI RefSeq)和KEGG 数据库(Kyoto Encyclopedia of Genes and Genomes),获得相应基因的注释信息。基于NR 数据库比对结果,使用MEGAN(v6)[19]进行微生物物种信息注释,并计算该物种的丰度。
2 结果与分析
2.1 测序数据统计
黑曲、黄曲、白曲高温大曲样品中提取的DNA经宏基因组测序,共获得693,414,364 条序列(77,046,040±3,473,586 条,Mean±SD,n=9),合计104.7 Gbp 的原始数据,其中97.5 %的序列为高质量序列,共计101.7 Gbp。高质量序列经过Megahit 软件单拼共得1,060,673 条重叠群序列(Contigs),经过MetaGene 软件共预测得1,649,504 个开放阅读框,经CD-HIT 软件聚类得714,190 个基因组成的非冗余基因集,基因平均长度为492 bp,表明测序质量可以用来表征3种高温大曲样本的微生物群落结构。
2.2 微生物群落结构与差异分析
非冗余基因集中共有501,795 个基因(70.3 %)在NCBI NR(v 20200604)数据库中具有明确的物种注释信息,分布于467 个目(Order)、2071 个属(Genus)中。主坐标分析显示(图1A),黑曲和黄曲的微生物群落结构相近,在PCoA 1 轴上无法区分两者,且均与白曲差异明显。ANOSIM 相似性分析(图1B)也显示3种高温大曲微生物群落组成差异显著(R=0.74,P=0.002),这种差异反映出造成它们理化性质、酶活、代谢物等方面差异的微生物基础[20-21]。
黑曲、黄曲中微生物群落以真菌为主,真菌属累计相对丰度分别为93.9 %、96.3 %,罗萨氏菌属(Rasamsonia)、曲霉属(Aspergillus)、丝衣霉属(Byssochlamys)、篮状菌属(Talaromyces)、青霉菌属(Penicillium)为优势真菌,均属于散囊菌目,在两者中的相对丰度分别为72.8 %和80.1 %。黑曲中丝衣霉属(Byssochlamys)相对丰度显著高于黄曲(T检验,P<0.05),黄曲中篮状菌属(Talaromyces)、青霉菌属(Penicillium)相对丰度显著高于黑曲。黑曲和黄曲中细菌群落结构相似,相对丰度极低,优势高温放线菌属(Thermoactinomyces)相对丰度仅2.0 %左右;黑曲中链孢子菌属(Desmospora)相对丰度显著高于黄曲,其他细菌属相对丰度无显著差异(T 检验,P>0.05)。
白曲中微生物群落以细菌为主,细菌属累计相对丰度达66.6 %,真菌属相对丰度仅33.3 %(图1C和图1D)。白曲中以克罗彭施泰特氏菌属(Kroppenstedtia,相对丰度19.6%)、链孢子菌属(Desmospora,相对丰度10.7 %)、枝芽孢菌属(Virgibacillus,相对丰度8.5 %)、芽孢杆菌属(Bacillus,相对丰度3.5 %)等细菌为主,相对丰度普遍高于黑曲和黄曲。对于真菌群落结构,白曲中罗萨氏菌属、曲霉属、丝衣霉属、篮状菌属、青霉菌属的相对丰度累计为21.1 %,显著低于黑曲和黄曲。值得注意的是,白曲中横梗霉属(Lichtheimia,相对丰度1.9 %)、根霉属(Rhizopus,2.5 %)相对丰度明显高于黑曲、黄曲,且两者均属于毛霉目(Mucorales)。上述研究结果与已有的文献报道相一致[22-24]。
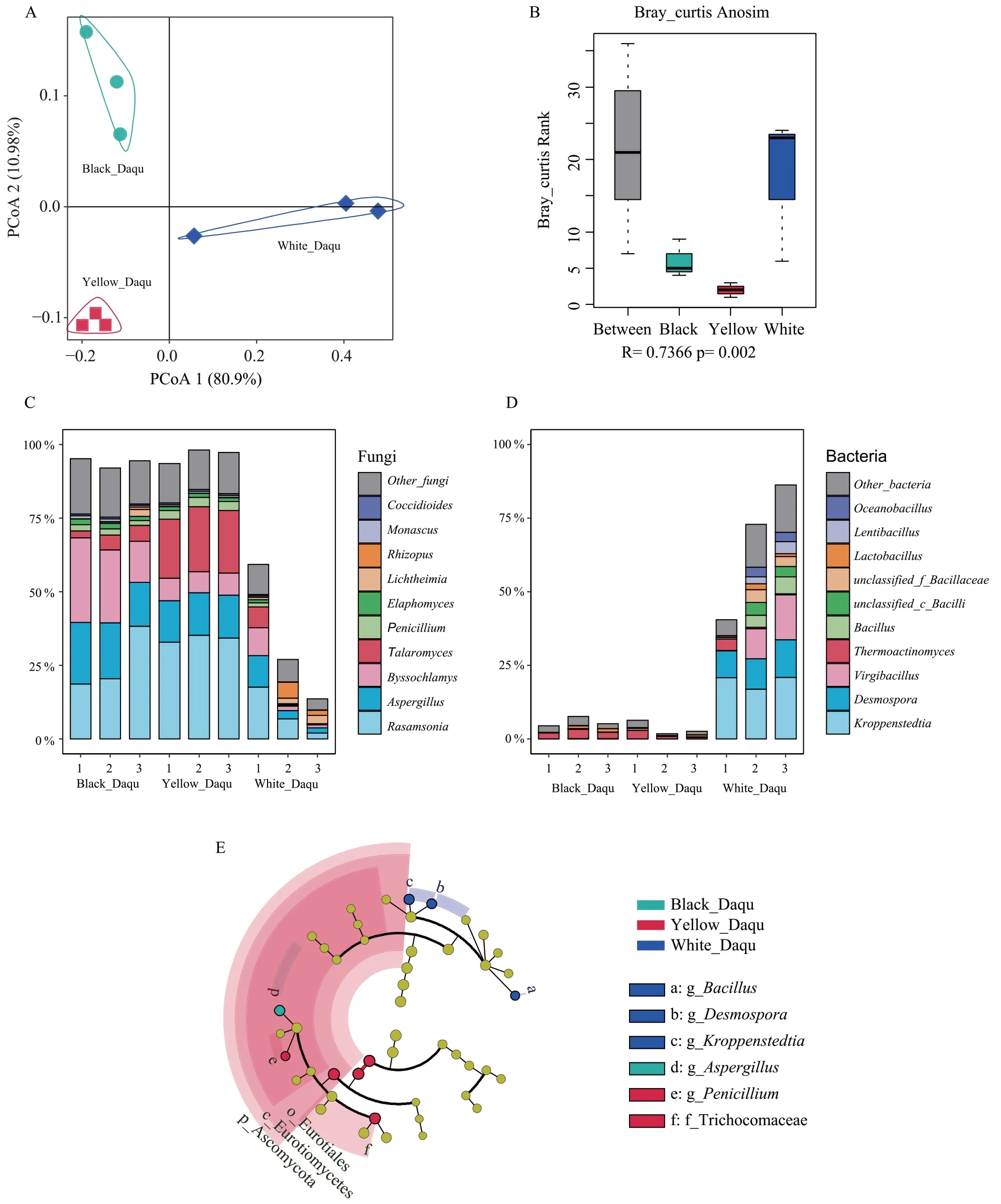
图1 高温大曲微生物群落结构
进一步探究了不同高温大曲的标志性微生物,采用相对丰度排名前二十的微生物属进行线性判别分析(Linear Discriminant Analysis-Effect Size,LEfSe)(图1E)。结果显示,黑曲的标志性微生物为曲霉属,黄曲的标志性微生物为青霉菌属和散囊菌目等,白曲的标志性微生物包括克罗彭施泰特氏菌属、链孢子菌属和芽孢杆菌属。表明黑曲和黄曲之间的差异主要归结于真菌群落组成的异质性,白曲中更加丰富多样的细菌群落使其明显区别于黑曲和黄曲。
2.3 基于CAZy 数据库的碳水化合物活性酶组成与差异分析
非冗余基因集中共有11,825 条基因(1.7 %)在碳水化合物活性酶数据库(Carbohydrate-active En‐zymes Database,CAZy)中具有明确的功能注释信息,共计395 个碳水化合物活性酶,包括208 个糖苷水解酶(Glycoside Hydrolases,GHs),73 个糖基转移酶(Glycosyl Transferases,GTs),44 个多糖裂合酶(Polysaccharide Lyases,PLs),15 个碳水化合物酯酶(Carbohydrate Esterases,CEs),31 个碳水化合物结合模块(Carbohydrate-Binding Modules,CBMs),24个辅助氧化还原酶(Auxiliary Activities,AAs)。如图2A 所示,黑曲和黄曲中碳水化合物活性酶基因累计丰度分别为17,333.3 和16,830.0(TPM),显著低于白曲(TPM:18,384.8)(图2A)。
如图2B 所示,GHs 是高温大曲中种类最多、基因丰度最高的碳水化合物活性酶类[25],黑曲、黄曲和白曲中的GHs 基因丰度依次降低,可能造成三者中还原糖含量、高温条件下的美拉德反应和褐变反应存在差异,进而形成3种高温大曲的颜色差异。根据GHs 基因的物种贡献度信息,黑曲和黄曲的GHs 主要源于罗萨氏菌属、丝衣霉属、曲霉属等,后者中的GHs 基因还来源于篮状菌属、嗜热真菌属等。黑曲和黄曲中绝大部分GHs 基因源于散囊菌目真菌,白曲中的GH 基因源于芽孢杆菌目(Bacil‐lales)和散囊菌目,其中,芽孢杆菌目主要包括链孢子菌属、克罗彭施泰特氏菌属、枝芽孢菌属等。同GHs 基因相似,黑曲和黄曲中的AAs 基因也主要源于散囊菌目真菌,白曲中的AAs 基因源于芽孢杆菌目和散囊菌目。
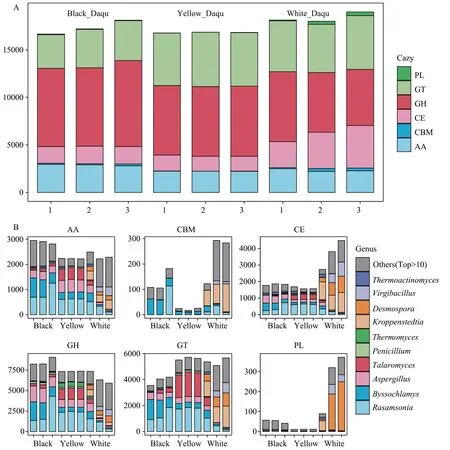
图2 高温大曲碳水化合物活性酶组成
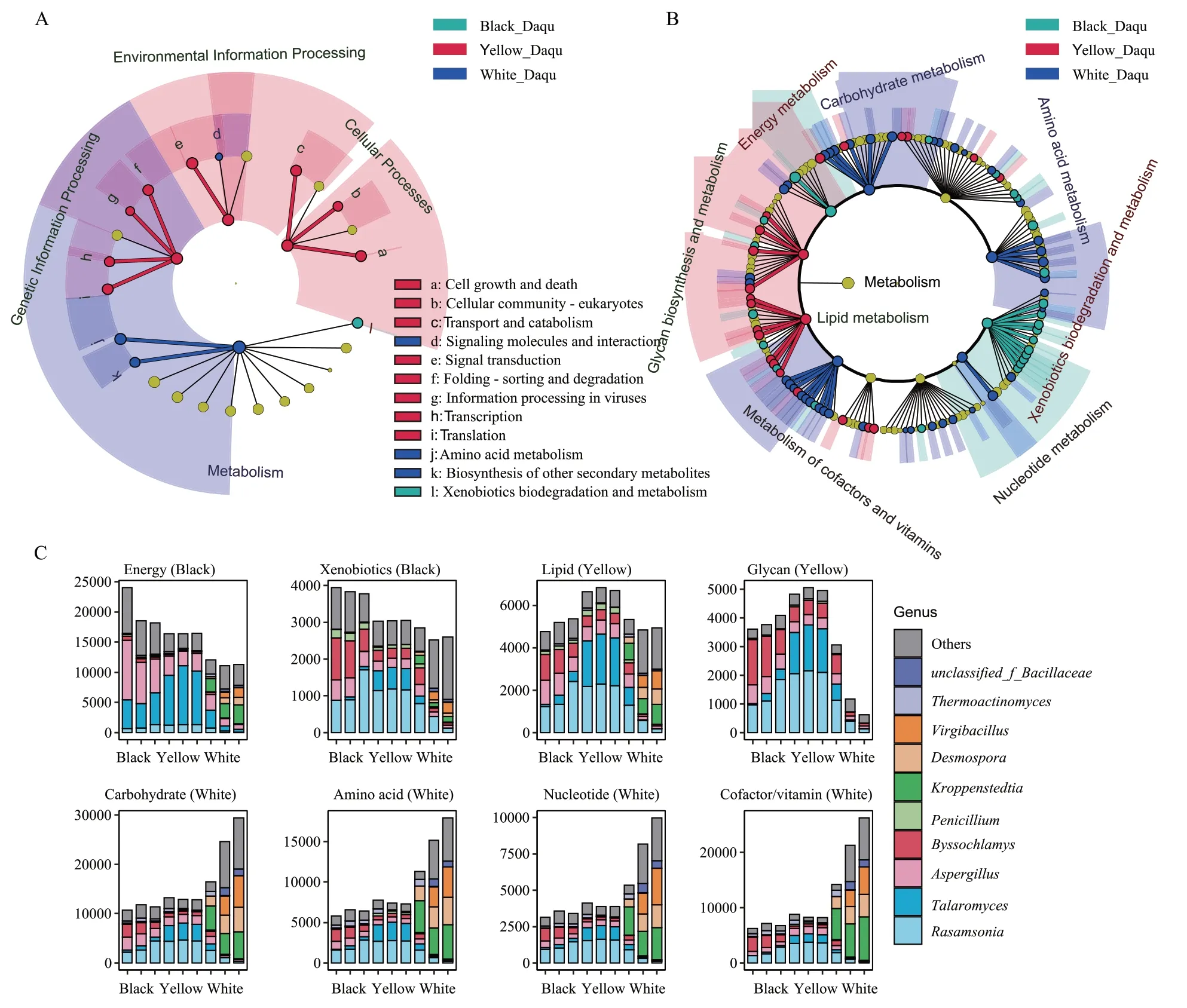
图3 高温大曲微生物群落的代谢功能差异
黑曲、黄曲和白曲中的GTs 基因丰度较高,随着大曲颜色变浅,GTs 基因丰度升高。黑曲和黄曲中的GTs 基因主要来源于罗萨氏菌属、篮状菌属、丝衣霉属、曲霉属等,白曲中主要源自克罗彭施泰特氏菌属、链孢子菌属、枝芽孢杆菌属等细菌。相对丰度最高的克罗彭施泰特氏菌属、链孢子菌属、枝芽孢菌属等细菌也使得白曲中CEs 和PLs 基因丰度高。白曲中较高丰度的GTs、CEs、PLs 基因可能是其糖化力、液化力、酯化力比黑曲和黄曲高的原因之一。
2.4 基于KEGG 数据库的微生物群落功能组成与差异分析
非冗余基因集中共有193,772 条基因(27.1%)在KEGG 数据库(v 94.2)中具有明确的功能注释信息,共计10006 个KO(KEGG Orthology)。将这些KO 映射到与微生物活动相关的途径(KEGG Path‐way),即代谢(Metabolism)、遗传信息处理(Genet‐ic Information Processing)、环境信息处理(Environ‐mental Information Processing)、细胞过程(Cellular Processes)。与碳水化合物活性酶总基因丰度类似,随着高温大曲颜色变浅,KEGG 途径的总TPM基因丰度依次升高。
基于KEGG Pathway Level 1(L1)、Level 2(L2)基因丰度的LEfSe 分析如图3A 所示。黑曲的标志性微生物活动途径为异源物生物代谢和降解(Xe‐nobiotics Biodegradation and Metabolism),微生物群落可能代谢更多的异源物质,产生多种代谢物,并有助于提升黑曲的香气浓郁度。黄曲的标志性微生物活动途径为遗传信息处理、环境信息处理、细胞过程(L1),黄曲中与基因、环境信息处理相关的代谢活动较为旺盛。白曲的标志性微生物活动途径为氨基酸代谢(Amino Acid Metabolism)、其他次级代谢产物的合成(Biosynthesis of Other Second‐ary Metabolites)等。
进一步基于KEGG Pathway L2、Level 3(L3)基因丰度的LEfSe 分析如图3B 所示。黑曲中与能量代谢(Energy Metabolism)相关的氧化磷酸化途径基因丰度最高,主要源于曲霉属、篮状菌属等真菌(图3C),推测黑曲中的能量代谢活动最为旺盛,释放大量的生物热,使黑曲拥有更高的发酵温度。黑曲中的标志性代谢途径也包括异源物生物代谢和降解(L2)的10 个L3 途径,基因主要源于丝衣霉属、罗萨氏菌属、曲霉属等真菌,涉及大量的芳香族化合物代谢,表明此类丝状真菌可能促进黑曲中芳香族化合物的积累。黄曲的标志性代谢途径主要是脂质代谢(Lipid Metabolism)、聚糖的生物合成与代谢(Glycan Biosynthesis and Metabolism),主要为罗萨氏菌属、篮状菌属等真菌的功能活性。
白曲中丝状真菌相对丰度较低,其能量代谢、异源物生物代谢和降解、脂质代谢、聚糖的生物合成与代谢下的L3 途径等的基因丰度低于黑曲和黄曲,可能导致白曲的代谢活力较低,进而使白曲的发酵温度和香气浓郁度较低。白曲的标志性代谢途径主要分布于碳水化合物代谢(Carbohydrate Metabolism)、氨基酸代谢、核苷酸代谢(Nucleotide Metabolism)、辅助因子和维生素代谢(Metabolism of Cofactors and Vitamins),相关基因主要源于克罗彭施泰特氏菌属、枝芽孢菌属、链孢子菌属等细菌。
综上所述,黑曲和黄曲的优势微生物主要为多种丝状真菌,其参与次级代谢的能力较强,可能有利于提高酱香型白酒风味的多样性和丰富度。黄曲的微生物群落具有较强参与遗传信息处理、环境信息处理、细胞过程的能力,说明黄曲微生物群落可能具有良好的适应能力,新建窖池试生产、酒醅发酵异常时可作为通用高温大曲使用。白曲中大量存在的细菌群落能广泛参与基础代谢,比如丙酮酸代谢(Pyruvate Metabolism)、三羧酸循环(Citrate Cycle)等,因此,在酱香型白酒堆积发酵阶段,可适当提高高温大曲中白曲的比例,利用白曲中丰富的细菌群落以及更高的液化力、糖化力,加速微生物基础代谢水平,缩短堆积时间,提高生产效率。
3 结论
本试验应用宏基因组学深入分析了黑曲、黄曲和白曲的微生物群落与潜在功能的差异。研究结果表明,黑曲和黄曲中优势微生物均属于散囊菌目,黑曲中主要以罗萨氏菌属、曲霉属、丝衣霉属等真菌为主,这些真菌拥有较多的GHs、AAs 基因以及与能量代谢、异源物生物代谢和降解相关的生物酶基因;黄曲中主要以罗萨氏菌属、篮状菌属、曲霉属等真菌为主,它们携带较多的GHs、GTs,以及与脂质代谢、聚糖合成和代谢等相关的生物酶基因;白曲中主要以芽孢杆菌目细菌为主,如克罗彭施泰特氏菌属、链孢子菌属、枝芽孢菌属、芽孢杆菌属等,这些细菌含有较多的GTs、CEs、PLs 基因,可能使白曲拥有较高的糖化力、液化力、酯化力。此外,芽孢杆菌目细菌还具有较强的碳水化合物代谢、氨基酸代谢、核苷酸代谢以及代谢辅助因子和维生素的能力。本文进一步明确了高温大曲微生物群落与功能组成的异质性,为不同类型高温大曲的工艺研究及应用场景提供了参考。
