EGR2调控慢性鼻窦炎伴鼻息肉患者Th17/Treg失衡的分子机制
2023-05-27简恒恒马祖霞
冯 桦,简恒恒,李 雪,马祖霞
(遵义医科大学第三附属医院,遵义市第一人民医院 耳鼻咽喉科,贵州 遵义 563000)
慢性鼻窦炎是耳鼻咽喉头颈外科的常见疾病之一,根据伴有息肉与否又可分为慢性鼻窦炎伴鼻息肉(chronic rhinosinusitis with nasal polyps,CRSwNP)及慢性鼻窦炎不伴鼻息肉(chronic rhinosinusitis without nasal polyps,CRSsNP)。其中,CRSwNP的术后复发率及临床症状评分都更高,所以一直是学界研究的重点[1-2]。CRSwNP常见致病因素包括免疫、遗传以及感染等,但具体发病机制尚不清楚。最新研究显示,Th17/Treg细胞失衡是CRSwNP发病的重要机制之一[3-4]。Th17/Treg是1对重要的促炎/抗炎免疫调节细胞,二者在分化上相互制约,在功能上相互拮抗,对CRSwNP患者的炎症反应与免疫防御具有重要作用[5-6]。闫智永等[7]在检测变应性鼻炎小鼠组织中相关特异性细胞因子的表达时,发现Th17特异性细胞因子IL-17表达水平明显增高,而Treg特异性细胞因子FoxP3含量显著降低。Ma等[8]研究不仅证实了CRSwNP患者鼻息肉组织中Th17表达水平明显增高,还证实了CRSwNP患者外周血DCs中Th17水平也是明显升高的。此外,她们还进一步发现早期生长反应因子2(early growth response protein 2,EGR2)可能是导致CRSwNP患者Th17细胞升高的关键调控因子。但目前有关EGR2调控CRSwNP患者Th17/Treg细胞失衡的机制尚不明确,仍需进一步研究。
1 对象与方法
1.1 对象 选取2021年7月—2022年9月在遵义医科大学第三附属医院耳鼻咽喉头颈外科拟行鼻内镜手术的CRSwNP患者作为实验组,同期因鼻中隔偏曲、单纯上颌窦囊肿接受手术的患者作为对照组。根据SPT结果将实验组分为伴变应性体质的慢性鼻窦炎伴鼻息肉组(Atopi CRSwNP)和不伴变应性体质的慢性鼻窦炎伴鼻息肉组(Non-atopic CRSwNP)。所有研究对象均需排除真菌性鼻窦炎、上颌窦后鼻孔息肉及全身重大疾病史等,且在术前1个月停止全身或者局部使用类固醇激素和停止使用抗过敏药物等。本研究已获得本院伦理委员会的批准(伦理号:2022-141),所有患者均签署了知情同意书。
1.2 主要试剂 Naïve CD4+T cell 免疫磁珠试剂盒(德国Miltenyi Biotec公司);Negative Control siRNA(德国QIAGEN公司);siEGR2(德国QIAGEN公司;Anti-EGR2 antibody(英国Abcam公司);Anti-IL-17A antibody(英国Abcam公司);Human IL-17A ELISA Kit(英国Abcam公司);Human TGF-β1 ELISA Kit(英国Abcam公司);Anti-FOXP3 antibody(英国Abcam公司)。
1.3 主要仪器 MACS(磁珠分选)分选仪(德国Miltenyi Biotec公司);UV-7504分光光度仪(上海欣茂公司);血球计数池(上海安信光学仪器制造有限公司);凝胶成像分析仪(Fusion Solo成像系统) (法国VilBer公司);生物显微镜(日本Olympus公司)。
1.4 临床信息收集 症状评估:采用视觉模拟量表(visual analogue scale,VAS)。鼻窦CT评分:Lund-Mackay。鼻内镜评分:Lanza-Kennedy。过敏原检测(SPT):<25%阳性对照风团或和阴性对照风团相同即为(-),25%~50%阳性对照风团(+),50%~100%阳性对照风团(++),100%~200%阳性对照风团(+++),>200%阳性对照风团(++++)。根据风团面积大小判定是否为SPT皮试阳性或者阴性(以组胺为准),比率≥(++)属于SPT阳性。
1.5 免疫印迹法测定鼻息肉组织中EGR2、IL-17A、FOXP3、p-STAT3和STAT3蛋白表达 蛋白酶抑制剂10 μL加至RIPA 1 mL裂解液,匀浆后4 ℃冰上静放30 min,12 000 rpm下离心15 min,取2 μL上清液行蛋白定量。配置BSA标准品,2 μL标准品吸入并置于96孔板中,再加ddH2O 18 μL,空白对照组内加入ddH2O 20 μL,BCA液200 μL,37 ℃ 30 min,562 nm下进行吸光度的相关测定。之后再等量加loading buffer,煮蛋白。每个样品上样10 μL,两侧加Maker,电泳。PDVF膜浸泡,除气泡,转膜90 min。一抗液中放置15 h,一抗稀释液洗干净后孵二抗。滴ECL发光液,凝胶成像仪拍照。
1.6 酶联免疫吸附测定(Elisa)法测定患者外周血中EGR2、TGF-β1和IL-17A的表达 外周血离心取血清,ELISA Kit室温下平衡,取出实验板,根据试剂盒说明书操作。100 μL标准品溶液中加100 μL稀释液,然后吸100 μL,再加100 μL稀释液,反复7次。每孔加100 μL梯度标准品、空白品和样品,37 ℃温育1 h。每孔加100 μL Biotinylated Detection Antibody(A液),37 ℃孵育1 h。缓冲清洗3次后除去缓冲液。每孔加100 μL B液,37 ℃孵育30 min,然后清洗5次。每孔加90 μL TMB底物溶液,37 ℃孵育15 min。避光并定期监测,直到达到最佳显色效果,加停止反应液。450 nm酶标仪测定每孔光密度(OD值),绘制标准曲线,计算浓度。
1.7 淋巴细胞分离液(Ficoll)密度梯度离心法分离外周血单核细胞(PBMCs) 将血样本倒入无菌30 mL BD管中,同时倒入大BD管中,加等体积的PBS溶液进行稀释;另准备无菌玻璃管,倒入人淋巴细胞分离液,吸取稀释后血液加入。4 ℃下离心,将PBMC细胞层吸出转移至新BD管,加入PBS溶液至快满处,常温离心,1 450 rpm,10 min,弃上清,各管中加入1/3管量的PBS溶液至其中一管中,吹匀后吸入量管中,再加PBS溶液至快满处。常温离心,1 450 rpm,10 min,弃上清,此时BD内的细胞为PBMCs。一部分PBMCs用于ELISA检测EGR2表达,剩余的PBMCs用于CD4+T细胞分选。
1.8 CD4+T细胞分选PBMCs计数 每l×107个细胞加入80 μL 4 ℃预冷的磁珠分选缓冲液将PBMCs重悬。每1×107个细胞加入CD4阳选磁珠,4 ℃孵育15 min。向PBMCs重悬液中加入2 mL磁珠分选缓冲液,离心弃上清,再500 μL分选缓冲液重悬细胞沉淀。将磁珠分选柱吸附于磁珠分选磁极上,加500 μL磁珠分选缓冲液润洗分选柱。500 μL磁珠分选缓冲液冲洗3遍分选柱,将磁珠分选柱从分选柱上取下,设置在一个15 mL的无菌离心管中。 在分选柱中加入1 mL分选缓冲液,迅速推下配套的活塞,使缓冲液通过分选柱并收集到离心管中。在1 000 rpm下离心10 min,去除上清液以获得正选富集的CD4+T细胞,用l mL PBS溶液重悬,收集10 μL用于计数。
1.9 CD4+T细胞培养及EGR2 siRNA干扰 无血清1640培养基重悬naïve T细胞,并计数,调细胞浓度为2×106/mL;将细胞液加到24孔细胞培养板,分为两组,即阴性对照组(negative control)和siRNA组,Negative control组转染错义序列组序列siRNA,siRNA组转染siEgr2, Sense:5′-GCUGCUAUCCAGAAGGUAU-3′; Anti-sense: 5′-CGACCUCGAAAGUACCCUA-3′。转染时,更换OPTI-MEM培养基,采用Lipofectamine转染试剂盒并按说明书提示进行转染,加入siRNA 4 h后,去掉培养基,加入无血清的1640培养基培养。最后两组均加入Anti-CD3(0.5 μg/mL)、Anti-CD28(1 μg/mL)抗体激活及诱导细胞。
1.10 免疫印迹法测定细胞EGR2、IL-17A、FOXP3、p-STAT3和STAT3蛋白表达水平 去掉孔中的培养液,每孔加100 μL预冷的NP-40细胞裂解液(含蛋白酶抑制剂和磷酸酶抑制剂),冰上裂解20 min,将孔中液体转移至EP管中,离心12 000 rpm,10 min,4 ℃,后续步骤同1.5。
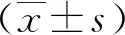
2 结果
2.1 临床资料比较 3组患者的年龄、性别构成比之间无差异(P>0.05)。相较于Control组,Non-atopic CRSwNP组和Atopic CRSwNP组的VAS评分、CT评分以及鼻内镜评分更高(P< 0.05);相较于Non-atopic CRSwNP组,Atopic CRSwNP组的VAS评分、CT评分以及鼻内镜评分更高(P< 0.05,表1)。Control 组和Non-atopic CRSwNP组的过敏原SPT试验为“-”,而Atopic CRSwNP组的过敏原SPT试验为“+”。

表1 患者临床资料比较
2.2 鼻息肉及鼻部粘膜组织中EGR2、IL-17A和FOXP3的表达水平比较 与Control组相比,Non-atopic CRSwNP组和Atopic CRSwNP组患者鼻息肉组织中EGR2以及FOXP3的表达明显更低,而IL-17A表达明显增高(P<0.05);与Non-atopic CRSwNP组相比,Atopic CRSwNP组患者鼻息肉组织中EGR2以及FOXP3表达更低,而IL-17A表达更高(P<0.05,图1~3)

a:与对照组比较,P<0.05;b:与Non-atopic CRSwNP,P<0.05。

a:与Control组比较,P<0.05;b:与Non-atopic CRSwNP组比较,P<0.05。

a:与对照组比较,P<0.05;b:与Non-atopic CRSwNP组比较,P<0.05。
2.3 外周血中EGR2、TGF-β1和IL-17A的含量比较 与Control组相比,Non-atopic CRSwNP组和Atopic CRSwNP组患者外周血中EGR2和TGF-β1含量降低,而IL-17A含量增加(P< 0.05);与Non-atopic CRSwNP组相比,Atopic CRSwNP组患者外周血中EGR2和TGF-β1含量降低,而IL-17A含量增加(P<0.05,图4)

a:与对照组比较,P<0.05;b:与Non-atopic CRSwNP组比较,P<0.05。
2.4 外周血中EGR2与TGF-β1、IL-17A含量的相关性分析 3组患者外周血中EGR2的含量与TGF-β1的含量之间呈正相关(r=0.616,P<0.05),而与IL-17A的含量之间呈负相关(r=-0.587,P<0.05,图5)。

图5 外周血中EGR2与TGF-β1、IL-17A含量的相关性分析
2.5 鼻息肉及鼻部粘膜组织中p-STAT3和STAT3的表达水平比较 3组患者鼻组织中STAT3表达没有统计学差异。与Control组相比,Non-atopic CRSwNP组鼻组织中p-STAT3表达更高(P<0.05);与Non-atopic CRSwNP组相比,Atopic CRSwNP组鼻组织中p-STAT3表达更高(P<0.05,图6)

a:与对照组比较,P<0.05;b:与Non-atopic CRSwNP组比较,P<0.05。
2.6 敲低T细胞中EGR2后p-STAT3、STAT3、FOXP3、IL-17A的表达变化 SiRNA成功敲低T细胞中EGR2的表达(P<0.05,图7)。相较于Negative Control组,SiRNA组STAT3表达没有统计学差异,而p-STAT3表达增加(P<0.05,图8)。相较于Negative Control组,SiRNA组EGR2和FOXP3表达降低,而IL-17A表达增加(P<0.05,图9~10)。

a:与对照组比较,P<0.05。
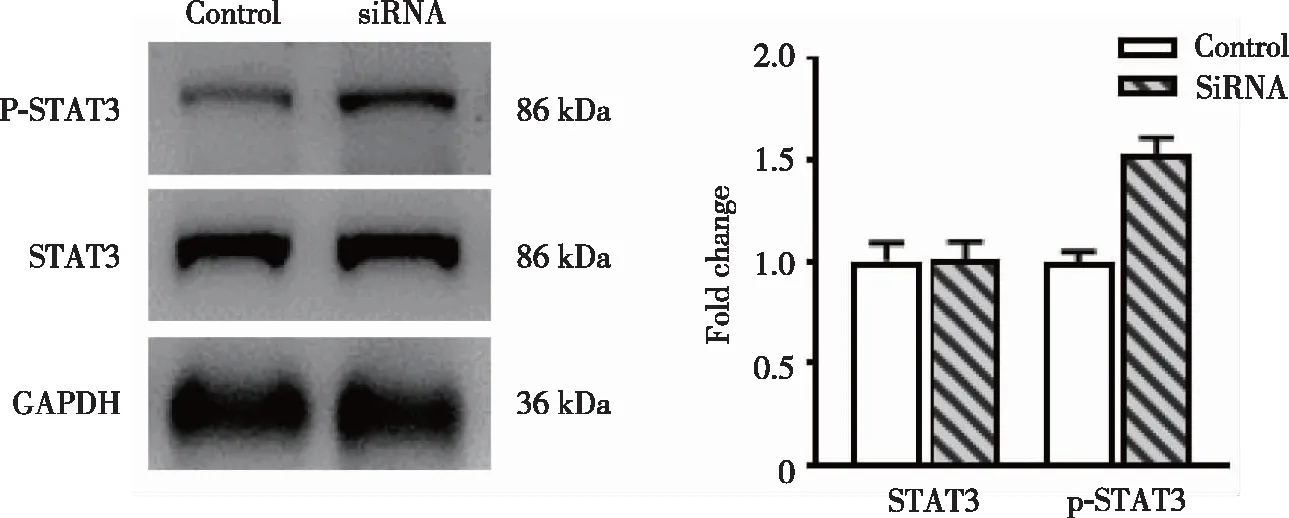
a:与对照组比较,P<0.05。

a:与对照组比较,P<0.05。
a:与对照组比较,P<0.05。
3 讨论
Th17/Treg细胞失衡在CRSwNP发病中具有重要作用,Th17可活化募集中性粒细胞、嗜酸性粒细胞以及巨噬细胞等炎症细胞,加重炎症反应;而Treg细胞则可抑制免疫应答以及炎症反应,维持机体免疫稳态[8-9]。胡玥等[10]研究发现,鼻息肉组织中Th17表达水平明显增高,而Treg表达水平显著降低。Van Bruaene等[11]研究也发现,CRSwNP患者鼻息肉组织中Foxp3阳性细胞数和Foxp3的mRNA较CRSsNP以及正常鼻黏膜组织有显著下调,同时发现IL-17的表达水平显著提高。以上结果均显示,Th17表达增加以及Treg表达减少所导致的Th17/Treg细胞失衡是CRSwNP发病的重要机制。一方面,Th17一旦通过血液循环到达鼻粘膜,就会释放出更多的炎症因子,导致身体的全身和局部免疫和炎症反应,使鼻粘膜损伤加剧。另一方面,由于外周血中Treg细胞明显减少,其免疫抑制和免疫调节功能不足以抵消Thl7细胞介导的高炎症作用,引起炎症反应加重,这种双重方向性的变化加剧了鼻粘膜的损伤,从而引发了炎症反应、局部组织损伤和粘膜重塑,推动了疾病CRSwNP发生发展[12-14]。本研究同样也发现CRSwNP患者鼻息肉组织和外周血中IL-17A含量明显增加,而鼻息肉组织中的FOXP3和外周血中的TGF-β1含量却明显减少,本研究同时证实了CRSwNP患者息肉组织以及外周血中都存在显著上调的Th17细胞和显著下调的Treg细胞,Th17/Treg细胞失衡在机体局部和外周的免疫平衡中均发挥作用,是导致CRSwNP发病的关键因素。同时,本研究还发现Atopic CRSwNP较Non-atopic CRSwNP存在更为严重的Th17/Treg细胞失衡,提示变应性因素可能促进Th17/Treg细胞失衡,推动CRSwNP进程,增加病情的严重度。
生长发育早期反应因子(early growth response protein,EGR)属于转录因子家族成员的即刻反应因子,EGR家族包括EGR1、EGR2、EGR3以及EGR4[15]。EGR2是EGR家族一员,主要涉及调控细胞的生长、增殖、分化与凋亡及其他过程的研究[16]。EGR2不只是针对T细胞的负反馈调节因子,同时还与T细胞的凋亡有关,较早对EGR2进行研究的是神经系统及肌肉运动,最近在免疫系统中还发现了EGR2的介入[17]。Morita等[18]研究表明,EGR2敲除的模型鼠出生数周内,检测到大量淋巴细胞快速入侵袭较多个器官并检测到血清Th17细胞的过量表达。淋巴细胞活化分子(signalling lymphocytic activationmolecule,SLAM)家族Ly108基因对狼疮样综合征最易感,并且Ly108还可以通过诱发EGR2的生成来参与免疫调节,同时发现EGR2敲除模型鼠体内有大量Th17细胞过量表达,并向多个脏器浸润,最后表现为狼疮样综合征[19]。在以硬皮病患者为研究对象的体外实验过程当中,发现此类病人CD4+T细胞被刺激后激活,其中的EGR2呈下调表达,且IL-17表达上调[20]。由此可见,EGR2的低表达可诱导CD4+T细胞过度分化为Th17,使得Th17/Treg细胞之间失衡,加重炎症反应,最终导致自身免疫性疾病的发生发展。本研究结果显示,CRSwNP患者鼻息肉组织和外周血中EGR2含量都明显降低,且相关性分析还发现EGR2的含量与TGF-β1的含量呈正相关,与IL-17A的含量呈负相关,提示EGR2在CRSwNP患者的局部鼻息肉组织和外周血中的低表达可引起Th17/Treg细胞失衡,导致全身和局部炎症反应加重。此外,本研究还发现,Atopic CRSwNP患者的EGR2表达相对更低,TH17在Atopic CRSwNP患者表达相应更高,故Th17/Treg细胞失衡也更严重,提示变应性因素可能通过EGR2的低表达来加重Th17/Treg细胞失衡,从而加重疾病。
最新研究表明,EGR2是激活转录活化因子3(signal transducers and activators of transcription 3,STAT3)的一个负性调控基因[21]。STAT3广泛存在于多种细胞的胞浆中,非磷酸化状态的STAT3以稳定的反向并联状态存在于胞浆中,当STAT3被激活磷酸化后可传递胞外信号分子的信息至胞核,上调维甲酸相关孤核受体γt (RORγt)的表达,从而增强Th17细胞的分化增殖[22]。体内外实验均已经证明,STAT3信号通路功能被抑制后将显著减少Th17细胞的分化作用,导致实验性自身免疫性脑炎以及大肠炎的发生[23]。同时,STAT3的磷酸化还会导致Treg细胞数量减少,免疫抑制作用减弱[24]。有研究者在牛皮癣患者中发现,外周血的Treg细胞受到pSTAT3的调节,pSTAT3削弱Treg细胞的免疫抑制作用,并抑制其分化增殖[25]。Béziat等[26]研究也发现,aGVHD模型鼠T淋巴细胞中STAT3表达明显上调,而将STAT3表达缺陷的naive CD4+T细胞注射至模型鼠体内,能显著增加Treg细胞的数量,减轻aGVHD导致的损害。以上研究均说明,STAT3的过度磷酸化将导致Th17细胞分化增加以及Treg细胞分化减少,打破Th17/Treg细胞平衡,最终引发炎症反应加重。本研究中,3组患者的鼻组织中STAT3含量无差异,但是CRSwNP两组患者的p-STAT3较对照组明显增加,且Atopic CRSwNP组较Non-atopic CRSwNP组的p-STAT3含量也更高,提示STAT3的磷酸化可能通过介导Th17/Treg细胞失衡参与了CRSwNP疾病的发生发展,且变应因素可能通过增加STAT3磷酸化而加重Th17/Treg细胞失衡。为了进一步验证EGR2是否通过调控STAT3的磷酸化水平介导Th17/Treg细胞失衡,我们通过培养CD4+T细胞,并加入Anti-CD3和Anti-CD28诱导细胞激活及分化。当通过加入EGR2 SiRNA敲低T细胞中EGR2后,我们发现,相较于Negative Control组,SiRNA组的STAT3含量无差异,但p-STAT3含量增加;同时,SiRNA组的EGR2以及FOXP3含量降低,而IL-17A含量增加。以上结果提示,EGR2的表达降低会导致STAT3的磷酸化水平增加,而p-STAT3又会诱导CD4+T细胞过度分化为Th17细胞以及抑制Treg细胞的产生,进而引起Th17/Treg细胞失衡。
综上所述,Th17/Treg细胞失衡会导致免疫炎症反应的增强和免疫抑制效应的减弱,长期刺激鼻腔局部粘膜组织,引起组织受损与重塑反复发生,最终导致CRSwNP的发生。而本研究进一步发现了Th17/Treg细胞失衡的分子机制可能是由于EGR2的低表达引起了STAT3磷酸化水平增加,从而诱导CD4+T细胞过度分化为Th17细胞以及抑制Treg细胞的生成,导致Th17/Treg细胞失衡。
