偶联斑蝥素的纳米介孔碳靶点“钩钓”载体平台研究
2023-05-27熊丽娟袁晓艳张建永
熊丽娟,何 清,袁晓艳,张 艳,张建永,余 明
(遵义医科大学 药学院,贵州 遵义 563099)
斑蝥为芫青科昆虫南方大斑蝥(mylabris phalerata pallas)或黄黑小斑蝥(mylabris cichorii linnaeus)的干燥体。已被证明具有明确的抗癌疗效,是我国发现最早的具有抗肿瘤作用的传统中药之一,入药始载于《神农本草经》,具有破血逐瘀、散结消癥、攻毒蚀疮之功,药用历史可以追溯到公元前1世纪[1]。斑蝥素(cantharidin)是一种单萜烯类化合物(图1),为斑蝥中主要活性成分。现有临床研究表明,斑蝥素及其衍生物具有良好的抗肝癌作用,同时可增加机体免疫力,已被开发成上市药物,围绕其开发的衍生药物斑蝥素酸钠等抗肝癌效果也较好[2-4]。然而斑蝥素抗肝癌作用的药效机制、分子靶点至今尚不明确,大大限制其在临床的使用。目前,针对斑蝥素及其衍生物的抗肝癌作用机制的研究主要集中在蛋白相关性的研究,包括阻滞细胞周期、诱导细胞凋亡、抑制癌细胞迁移、诱导自噬和内质网应激等[5-7],未能深入和确切地揭示斑蝥素发挥抗肝癌作用与增强机体免疫力的作用机制。斑蝥素分子直接作用靶点的探明可能是揭示斑蝥素发挥抗肝癌作用的关键突破口,获取并且鉴定斑蝥素的分子作用靶点将有助于深入了解斑蝥素与肝肿瘤细胞增殖、转移、凋亡的相关机制,进而阐释斑蝥素抗肝癌的分子作用机理,从而为斑蝥素的临床安全使用提供依据。虽然目前有大量报道阐明蛋白磷酸2A(PP2A)是斑蝥素抗肝癌潜在作用靶点[8-9],但也有大量研究发现,斑蝥素作为PP2A抑制剂,在PP2A过表达的SMMC-7721细胞中仍有显著的肿瘤抑制作用[10],故PP2A有可能并非斑蝥素的唯一分子作用靶点,因此有必要开展斑蝥素抗肝癌靶点的鉴定研究。

图1 斑蝥素
分子靶点“钩钓”技术是目前应用十分广泛的药物分子靶点识别方法[11]。分子靶点“钩钓”技术基于蛋白质可与药物分子发生特异性结合的原理,将药物分子通过化学反应连接到固相微球表面的功能基上,进而将靶点蛋白捕获并富集到固相微球表面,使之得以分离、纯化和鉴定的一种靶点鉴定方法[12]。其中固相载体材料通过共价键合药物而有效实现药物与靶点蛋白的富集,目前基于该技术,人们已经成功地捕获了一些药物的直接作用靶点,并基于此靶点阐明该药物的分子作用机制。例如,通过制备键合首荟通便胶囊药材总提取物的磁性固相微球,获得首荟通便胶囊的潜在作用靶点蛋白(CNOT4、GSK3β等138个靶点蛋白)[13];通过构建一种表面键合有肉苁蓉苯乙醇苷的琼脂糖固相微球,获得了肉苁蓉脑保护作用相关靶点蛋白(HSP90、78GRP等18个靶点蛋白)等[14]。该技术的关键点在于药物与固相载体平台的有效键合或偶联且不影响该药物药效。但目前尚无针对斑蝥素特性与结构特征(单萜烯结构)且键合斑蝥素后将其用于分子作用靶点“钩钓”的固相载体材料。因此,针对斑蝥素分子结构直接作用靶点“钩钓”的固相载体材料亟需开发,为斑蝥素抗肝癌分子作用靶点“钩钓”奠定平台基础。
基于此,本实验拟设计合成一类可用于偶联斑蝥素的纳米碳材料,对材料相关结构进行表征,并研究其与斑蝥素的偶联作用,以及偶联斑蝥素后固相载体平台的生物相容性和抗肝癌活性评价,为斑蝥素抗肝癌分子作用靶点“钩钓”与鉴定研究提供一定的实验基础。
1 材料与方法
1.1 仪器 DF-101S集热式恒温加热磁力搅拌器(巩义市予华股份有限公司);85-2恒温磁力搅拌器(郑州市亚荣仪器有限公司);SHB-IIIA循环水式多用真空泵(郑州长城科工贸有限公司);VERTEX70傅里叶变换红外光谱仪(德国BRUKER公司);JW-BK122W静态氮吸附仪(北京精微高博科学技术有限公司);Zesscars扫描电子显微镜(德国carzeiss公司);OTF真空管式高温烧结炉(合肥科晶材料技术有限公司);DZF-250真空干燥箱(上海亚荣有限公司);AL204电子天平(梅特勒-托利多仪器上海有限公司);311二氧化碳培养箱(美国Thermo公司);XD-202倒置显微镜(中国南京江南永新光学有限公司)。
1.2 试剂 甲醛(安耐吉化学,纯度37%);苯酚(安耐吉化学,纯度37%);嵌段共聚物Pluronic F127(安耐吉化学,分析纯);氢氧化钠(成都金山化学试剂有限公司,分析纯);硝酸(安耐吉化学,分析纯);乙醇(上海泰坦科技股份有限公司,分析纯);斑蝥素(CTD)(成都埃法生物科技有限公司,纯度98%);聚乙烯吡咯烷酮(PVP)(河北百灵威超精细材料有限公司,分析纯);N-羟基琥珀酰亚胺(NHS)(安耐吉化学,纯度98%);二甲基亚砜(安耐吉化学,99.7%);DMEM-12(1∶1)培养基(中国大连每轮生物技术有限公司);0.2%胰蛋白酶(美国GIbco公司);PBS缓冲液(中国大连仑生物技术有限公司);胎牛血清(美国Sigma公司);CCK-8试剂盒[东仁化学科技(上海)有限公司]。
1.3 偶联斑蝥素介孔碳的制备
1.3.1 介孔碳的制备 (1)MCN-COOH-1的合成:取苯酚1.20 g、4.20 mL甲醛溶液(37%)以及30.0 mL(0.1 mol/L)的氢氧化钠溶液加入250 mL圆底烧瓶中,在69 ℃反应0.6 h得低阶酚醛树脂碳质前驱体。接着将溶解有1.92 g三嵌段共聚物泊洛沙姆F127(Mw=12600,PEOl06PP070PE0106)的30.0 mL去离子水加入到低阶酚醛树脂中;两者混合均匀后,在69 ℃的搅拌3 h后加入100 .0 mL水,继续反应12~16 h,得到前驱体溶液Solution P。随后取25.0 mL Solution P、40.0 mL的水混匀后在130 ℃水热反应12 h。待釜温降至室温,抽滤水热后的产物,取滤饼,并用去离子水和乙醇分别洗涤3次,最后于50 ℃下烘干得深棕色粉末。将该深棕色粉末置于真空管式气氛炉中,在氮气保护下,于700 ℃ (升温速率5 ℃/min)焙烧1 h,得到介孔碳初胚。进一步将该初胚与一定量的30%硝酸在70 ℃下回流12 h后,抽滤,取滤饼,并用去离子水洗涤3次至中性,烘干得氧化介孔碳MCN-COOH-1。(2)MCN-COOH-2的合成:取苯酚6.00 g、21.0 mL甲醛溶液(37%)以及90.0 mL(0.1 mol/L)的氢氧化钠溶液于69 ℃反应0.6 h得低阶酚醛树脂。接着将溶解有0.30 g三嵌段共聚物Pluronic F127和0.10 g CTAB的20.0 mL乙醇溶液加入到20.0 mL低阶酚醛树脂中;两者混匀后,在69 ℃搅拌3 h。之后在搅拌条件下加入100.0 mL水后继续反应12~16 h。随后取25.0 mL上述混合溶液与40.0 mL的水混匀后在130 ℃水热处理12 h,之后进行分离、干燥、焙烧、硝化即得氧化介孔碳MCN-COOH-2。
1.3.2 氨基功能化的介孔碳偶联斑蝥素制备 将制备的介孔碳(MCN-COOH-1与MCN-COOH-2)分别与 1-乙基3(3-二甲基氨基丙基)盐酸碳二酰亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)和斑蝥素(CTD)分散体加入10.0 mL DMSO于70 ℃反应12 h后,抽滤,取滤饼,乙醇和去离子水将滤饼各洗涤3次,干燥后得MCN-COOH-1@NH2@CTD和MCN-COOH-2@NH2@CTD。
1.4 结构表征和性能测试
1.4.1 结构表征方法 通过静态氮吸附仪(JW-BK122W)测定不同合成工艺所制得的介孔碳材料的比表面积与相关孔结构参数;利用FT-IR(德国BRUKER公司生产的VERTEX70)测试偶联斑蝥素前后介孔碳的化学组成;采用SEM(德国carzeiss公司生产的Zesscars)观察合成介孔碳偶联斑蝥素前后的表面形貌。
1.4.2 介孔碳偶联斑蝥素的细胞毒性 (1) CCK-8法测定空白纳米载体的细胞毒性:首先,将HepG2细胞接种在96孔板中(1.0×105个/mL)并孵育24 h。正常对照组和调零组各孔加完全培养基100 μL,MCN-COOH和MCN-COOH@NH2实验组各分4个不同的浓度,在同一板上加入浓度10、20、40、60 μg/mL的完全培养基各100 μL;在37 ℃下进一步孵育24 h。为了检测细胞活性,首先去除培养基,接着用PBS洗涤,然后向每孔加入完全培养基90 μL+CCK-8 10 μL,继续放回细胞培养箱中培养2 h;置酶标仪,检测波长450 nm时各孔吸光度比值(A),记录并保存结果。(2) 介孔碳偶联斑蝥素对HepG2细胞的增殖抑制作用:采用CCK-8法初步评价纳米载药复合体MCN-COOH-1@NH2@CTD和MCN-COOH-2@NH2@CTD对HepG2细胞的增殖抑制作用。MCN-COOH-1@NH2@CTD给药组和MCN-COOH-2@NH2@CTD给药组分别加入浓度5 μg/mL的完全培养基各100 μL;37 ℃恒温细胞培养箱中孵育12 h。
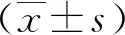
2 结果
2.1 介孔碳比表面积和孔结构特征 样品介孔孔径主要分布在2~6 nm,同时存在微孔结构(表1)。MCN-COOH-1的等温线显示为典型IV型等温线,且相对压强 P/P0<0.1时,样品MCN-COOH-1的氮气吸附量急剧增加,表明存在大量的微孔;当压强P/P0在0.5~0.9时,曲线出现明显升温滞回环,这说明所制备的介孔碳材料中具有介孔孔隙的存在[15]。介孔碳MCN-COOH-2为典型的I型等温线,且当相对压强 P/P0<0.1时,样品MCN-COOH-2的氮气吸附量急剧增加,表明存在大量的微孔;当相对压强 P/P0在0.2~0.8,样品MCN-COOH-2氮气吸附量的增长极为缓慢,说明存在少量的介孔(图2)。结合介孔碳的孔结构参数分布(表1)可知,MCN-COOH-1与MCN-COOH-2孔结构中均存在介孔结构。

表1 不同投料比的介孔碳的孔结构参数

图2 不同投料比介孔碳的吸附等温线和孔径分布
2.2 介孔碳偶联斑蝥素前后表面官能团 由图3A 所示,载药前的介孔碳MCN-COOH-1FT-IR图谱中主要特征峰出现在~3 700-3 800 cm-1、~2 996 cm-1、~1 600-1 790 cm-1、1 517 cm-1、~661 cm-1处,分别对应O- H 伸缩振动峰、芳环上C-H 伸缩振动峰、C=O 伸缩振动峰、C=C骨架振动峰、芳环上C-H面外弯曲振动峰[16-17],这说明MCN-COOH-1中含有苯环、酚羟基、羰基等基团。从图3A可知,载药后的MCN-COOH-1@NH2@CTD在3 424.6 cm-1处有N-H伸缩振动峰,1 639 cm-1处有C=O伸缩振动峰,1 225 cm-1处有C-N伸缩振动峰,说明载药后的MCN-COOH-1@NH2@CTD具有O=C-N。而斑蝥素特征官能团为CH3,C-O-C,CO-O-CO[18],在图3A中,MCN-COOH-1@NH2@CTD在2 990 cm-1处有C-H伸缩振动,在1 897 cm-1和1 683 cm-1处均有C=O伸缩振动,在1 007 cm-1处有C-O-C伸缩振动,具有CTD的特征官能团峰。此外,负载CTD后,最大吸收峰分别转移至~3 438、~1 890、~1 679 cm-1处,MCN-COOH-1@NH2@CTD吸收峰出现微弱的红移和蓝移[16],上述说明MCN-COOH-1成功与斑蝥素通过酰胺化进行共价键偶联。如图3B所示,载药前的介孔碳MCN-COOH-2主要特征峰出现在~3 855 cm-1、~3 060 cm-1、~1 715 -1 580 cm-1、~1 205 cm-1、~1 092 cm-1、~579.7 cm-1处,分别对应O-H 伸缩振动峰、芳环上C-H 伸缩振动峰、C=O 伸缩振动峰、C=C骨架振动峰,C-O伸缩振动峰,芳环上C-H面外弯曲振动峰,说明MCN-COOH-2含有苯环、酚羟基、羰基。载药后的MCN-COOH-2@NH2@CTD中未出现酰胺的特征峰,无斑蝥素的特征峰或者其他多余的吸收峰,这说明斑蝥素与MCN-COOH-2未发生偶联。
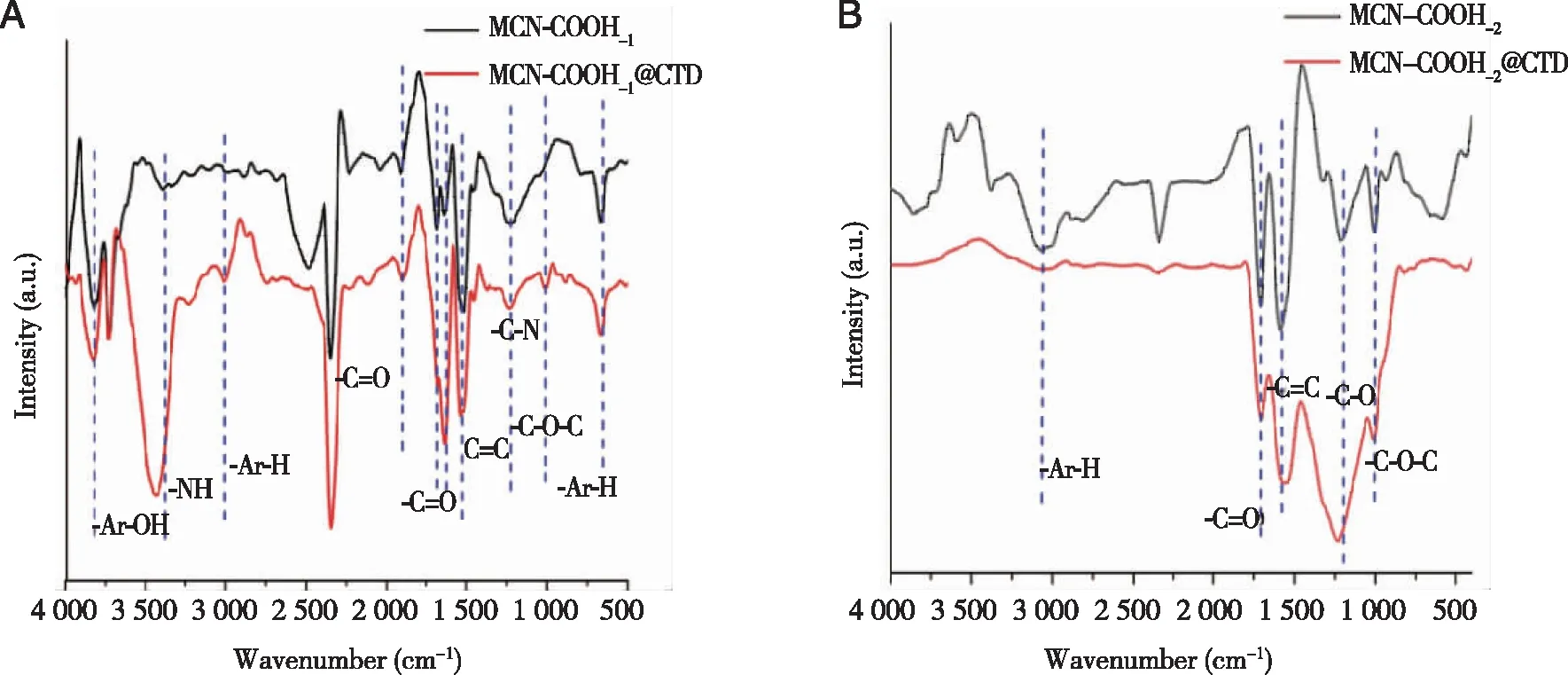
图3 载药前后介孔碳的FT-IR图谱
2.3 介孔碳偶联斑蝥素前后微观形貌 为进一步观察介孔碳载药前后的情况确证介孔碳与CTD的偶联与负载,本研究采用SEM 对其载药前后微观形貌进行分析。图4为介孔碳载药前后的微观形貌图。由图4A可观察到,MCN-COOH-1表面光滑,颗粒呈球形,球形颗粒部分可见孔隙,球形颗粒有交联团聚现象。在图4B中,载药后斑蝥素的MCN-COOH-1@NH2@CTD碳球表面黏附有纳米颗粒,说明MCN-COOH-1与CTD间也有负载作用。从图4C中可看到,MCN-COOH-2形貌较为规则,表面光滑,基本无粘连情况,有明显的孔道结构。载上斑蝥素后碳球孔道消失,碳球表面包裹着纳米颗粒,说明MCN-COOH-2与CTD有负载作用(图4D)。结合FT-IR结果分析可知,MCN-COOH-1载药方式为偶联和负载,MCN-COOH-2为负载。

A:MCN-COOH-1;B:MCN-COOH-1@NH2@CTD;C:MCN-COOH-2;D:MCN-COOH-2@NH2@CTD。
2.4 空白纳米载体的细胞毒性 HepG2细胞与10~60 μg/mL MCN-COOH以及MCN-COOH@NH2共孵育24 h后,均表现出较高的细胞活力(超过90%),这表明MCN和MCN-NH2对HepG2细胞的毒性很小,材料安全(图5)。这证实了MCN-COOH和MCN-COOH@NH2具有良好的生物相容性。这对于后续斑蝥素靶点“钩钓”具有重要意义。
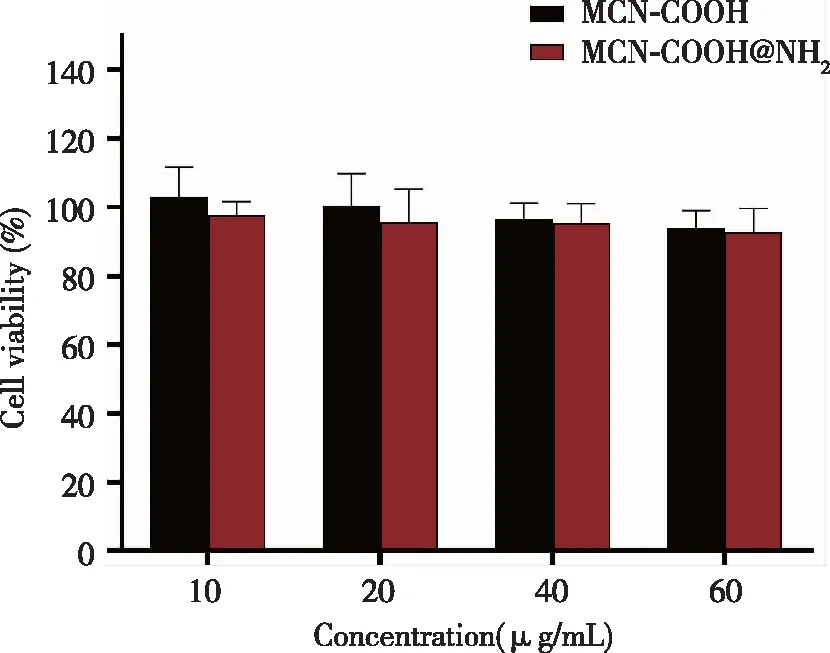
图5 MCN-COOH和MCN-COOH@NH2对HepG2细胞的毒性
2.5 介孔碳偶联斑蝥素对HepG2细胞的增殖抑制作用 药物浓度在5 μg/mL时,MCN-COOH-1@NH2@CTD对HepG2细胞的增殖抑制作用强于MCN-COOH-2@NH2@CTD,且差异具有统计学意义(P<0.05,图6)。

*:MCN-COOH-1@NH2@CTD与MCN-COOH-2@NH2@CTD比较,
3 讨论
分子靶点“钩钓”技术的关键点在于药物与固相载体平台的有效键合或偶联且不影响该药物药效。斑蝥素属于单萜烯类化合物,无法通过“光偶联”“C-C键合”等技术与固相载体材料进行键合。因此本研究设计以活化的氨基功能化介孔碳与斑蝥素通过“酰胺化”进行共价偶联,并验证键合斑蝥素后对其药效活性的影响。首先,本研究以低阶酚醛树脂作为碳源,F127为软模板,借助水热合成法制备了比表面积适宜、孔径为2.955 nm的羧基修饰介孔碳。通过FT-IR和SEM分析可知,MCN-COOH-1与斑蝥素的结合方式为偶联和负载,MCN-COOH-2与斑蝥素的结合方式为负载。由此也证明,MCN-COOH-1羧基活化剂EDC存在条件下与NHS发生交联反应,同时与斑蝥素进行有效偶联,而介孔碳的介孔结构可实现斑蝥素的有效吸附。其次,本研究通过体外斑蝥素活性成分芯片的生物相容性与抑制细胞增殖作用实验验证了斑蝥素活性成分芯片具有生物安全性与药效活性。结果显示,10~60 μg/mL MCN-COOH以及MCN-COOH@NH2与HepG2细胞共孵育24 h后,均表现出较高的细胞活力(超过90%);药物浓度在5 μg/mL时,MCN-COOH-1@NH2@CTD对HepG2细胞的增殖抑制作用强于MCN-COOH-2@NH2@CTD。因此,所合成的介孔碳材料具有良好的生物安全性,无论与斑蝥素进行键合或者负载作用进行结合均对其药效活性影响不大。
综上所述,本文合成的介孔碳为后续斑蝥素分子直接作用靶点群“钩钓”提供了有效的固相载体平台。
