FHA结构域蛋白TagH对霍乱弧菌肠道定植能力及致病力的影响
2023-05-27贾城壹王小素
贾城壹,范 婵,卢 琴,王小素,闵 迅,黄 健
(1.遵义医科大学附属医院 医学检验科,贵州 遵义 563099;2.遵义医科大学 检验医学院,贵州 遵义 563099;3.遂宁市中心医院 检验科,四川 遂宁 629099)
霍乱弧菌是一种生存于水生环境的革兰氏阴性菌,根据表面O抗原结构不同,可分为200多种血清型[1]。其中O1和O139型霍乱弧菌主要导致流行性霍乱,这主要与它们表达霍乱毒素(cholera toxin,CT)和毒素共调节菌毛(toxin coregulated pilus,TCP)有关[2-3]。由于非O1/非O139群霍乱弧菌缺少CT和TCP毒素[4-5],因此不会引起流行性霍乱,但可引起胃肠炎和肠外侵袭性感染如脑膜炎[6]、菌血症、皮肤和软组织感染[7]等。近年来,非O1/非O139群霍乱弧菌引起的肠外侵袭性感染病例呈上升趋势,且显著高于O1和O139型霍乱弧菌侵袭性感染的报告病例数[8]。但目前关于非O1/非O139群霍乱弧菌的致病分子机制知之甚少。
溶血素HlyA(hemolysin A,HlyA)属于细胞外成孔毒素家族,是霍乱弧菌的一个重要毒力因子,主要由El Tor生物型和非O1/非O139群菌株分泌[9],其具有多种生物活性,包括细胞毒性、肠毒性[10]、心脏毒性、溶血活性[11]和致死性等。本课题组前期研究证实,HlyA是非O1/非O139群霍乱弧菌肠外侵袭致病的决定因子[12]。我们还证实Ⅵ型分泌系统(Type VI secretion systems,T6SS)中的叉头相关结构域(forkhead-associated domain,FHA)蛋白TagH通过转录因子HlyU和Fur在转录水平协同调控hlyA的表达,并在翻译后水平通过蛋白酶PrtV调控HlyA的降解[12]。蛋白酶PrtV(vibrio cholerae protease,PrtV)属于金属肽酶M6家族成员,可降解哺乳动物血纤维蛋白溶酶原Ⅲ和细胞外基质复合物,也是霍乱弧菌的一个重要毒力因子[13]。本研究比较了tagH基因敲除菌株(ΔtagH菌株)、ΔtagHΔhlyA双敲菌株、ΔtagHΔprtV双敲菌株和野生菌株在小鼠肠道定植和致病力上的差异,以探究TagH对细菌毒力的影响,并初步明确溶血素HlyA和蛋白酶PrtV在此过程中的作用。
1 材料与方法
1.1 实验菌株 非O1/非O139群霍乱弧菌HN375野生菌株(中国典型培养物保藏中心编号CCTCCAB2010414)为本实验室保存。ΔtagH敲除菌株、ΔtagHΔhlyA双敲菌株和ΔtagHΔprtV双敲菌株为本课题组前期构建[12]。
1.2 实验动物 3~5天龄CD1乳鼠(性别随机)和4~6周龄雌性CD1小鼠购自重庆腾鑫生物技术有限公司,均为SPF级,动物实验操作符合本校伦理委员会要求。
1.3 方法
1.3.1 细菌生长曲线实验 将野生菌株(wild-type,WT)、ΔtagH菌株、ΔtagHΔhlyA菌株和ΔtagHΔprtV菌株分别接种于哥伦比亚羊血琼脂平板,于37 ℃培养箱过夜培养,次日分别挑取单菌落于生理盐水中调至0.5麦氏浓度,再以1∶1 000比例接种于LB液体培养基中,在37 ℃、200 rpm恒温摇床中增菌培养,每小时检测其OD600nm值,同时做3个生物学重复,计算值为平均值。根据结果比较各菌株的生长速率差异。
1.3.2 乳鼠肠道定植实验 将CD1乳鼠称重、编号,共分为5组(PBS阴性对照组、WT菌株组、ΔtagH菌株组、ΔtagHΔhlyA菌株组和ΔtagHΔprtV菌株组),每组24只(8只/笼,共3笼),共计120只。用异氟烷吸入麻醉后,使用灌胃针将50 μL菌量为1×107CFU的各菌悬液按组进行灌胃,阴性对照组直接灌胃50 μL的1×PBS。灌胃完毕后,观察乳鼠是否有呛咳、呕吐等症状约10 s,如无异常放回饲养箱。在分别灌胃感染3、6、18 h后,用吸入过量异氟烷方式处死乳鼠,收集整个肠道称重后进行研磨,将匀浆液稀释102~104倍后,取50 μL涂布于链霉素(100 μg/mL)平板,次日进行菌落计数比较各菌肠道定植能力。
1.3.3 小鼠灌胃感染实验 将CD1小鼠称重、编号,共分为5组(PBS阴性对照组、WT菌株组、ΔtagH菌株组、ΔtagHΔhlyA菌株组和ΔtagHΔprtV菌株组),每组16只(8只/笼,共2笼),共计80只。实验前4 h禁食禁水,用异氟烷吸入麻醉后,使用灌胃针先将100 μL 8.5%(W/V)NaHCO3溶液注入胃中,再立即将100 μL菌量为1×109CFU的各菌悬液按组进行灌胃,阴性对照组直接灌胃100 μL的1×PBS。灌胃完毕后,观察乳鼠是否有呛咳、呕吐等症状约10 s,如无异常放回饲养箱。其中每组8只小鼠在灌胃感染18 h后检测血液白细胞数目和回肠病理情况,另外8只小鼠观察7 d内的生存状况,统计生存率。
1.3.4 血细胞分析仪检测外周血白细胞数目 各菌株行小鼠灌胃感染18 h后,经异氟烷麻醉后,采集500 μL血液注入EDTA-K2+抗凝管后颠倒混匀,于希森美康Xs-500i血细胞分析仪上进行白细胞数测定。
1.3.5 ELISA法检测血清IL-6、IL-8和TNF-α水平 各菌株行小鼠灌胃感染18 h后,经异氟烷麻醉后,采集500 μL血液注入1.5 mL EP管中,37 ℃孵育30 min后于离心机中4 000 rpm离心10 min。取血清进行细胞因子白介素-6(IL-6)、白介素-8(IL-8)和肿瘤坏死因子α(TNF-α)的检测。酶标板上分别设置空白孔、标准孔和样本孔。空白孔中不加入任何样本和试剂,各孔设置3个复孔。标准孔中准确加入各试剂盒标准品原液两倍梯度稀释后的标准品待测液,各孔设置1个复孔。样本孔中先加入40 μL样本稀释液后,再加入10 μL小鼠血清,各孔设置3个复孔。加样结束后轻轻晃动混匀,用封板膜将酶标板封板后置于37 ℃温育30 min,再用稀释20倍的浓缩洗涤液洗板5次后拍干。除空白孔外每孔加入酶标试剂50 μL,用封板膜封板后置于37 ℃温育30 min,再用稀释20倍的浓缩洗涤液洗板5次后拍干。每孔依次加入50 μL的显色剂A和显色剂B,轻轻晃动混匀,37 ℃避光孵育10 min后,再加入50 μL终止液,10 min内于酶标仪测定各孔OD450nm吸光度值。根据标准曲线和吸光度值进行各细胞因子浓度换算后比较分析。
1.3.6 回肠段病理组织切片的制备 各菌株行小鼠灌胃感染18h后,将小鼠吸入大量异氟烷麻醉处死,立即取一小块回肠组织于4%多聚甲醛溶液中浸泡固定48 h,依次于80%、90%、95%、100%乙醇中梯度脱水后,将组织浸入溶解的石蜡中进行包埋,蜡块凝固修整后切片,将切片在40 ℃的水上展平后铺片,置于60 ℃恒温箱中烤片30 min以融化组织间隙的石蜡。用两道二甲苯脱蜡后,依次在95%、85%、75%乙醇中浸泡2 min后水洗5 min,用苏木精染色15 min后,于1%盐酸酒精作用2 s后水洗1 min,置于5%氨水溶液中浸泡5 s,再置于水中30 min,待切片颜色返蓝后用伊红染液染色30 s,自然风干后用中性树脂封片,光学显微镜下观察切片,并用Image J软件分析每组肠绒毛长度。
1.3.7 小鼠生存率的统计 各菌株行小鼠灌胃感染18 h后,将小鼠放回原饲养环境并提供充足水粮,连续观察7 d左右,记录小鼠死亡数量和时间,统计小鼠生存率。
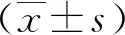
2 结果
2.1 细菌生长曲线实验 为排除不同菌株生长速率差异对小鼠定植能力和致病力的影响,我们进行了生长曲线实验观察各菌株生长状况(图1)。结果显示,WT菌株、ΔtagH菌株、ΔtagHΔhlyA菌株和ΔtagHΔprtV菌株在培养后的第3小时进入指数生长期和第11小时左右进入平台期,生长曲线几乎趋于一致,生长速度无明显差异。

图1 细菌生长曲线
2.2 乳鼠肠道定植实验 肠道定植是霍乱弧菌致病过程的一个重要环节[14],为探究各菌株在鼠肠道中的感染定植能力,在不同菌株灌胃感染乳鼠后,我们进行了肠道定植菌量计数分析。结果显示,在各菌株分别感染3、6、18 h后,随着感染时间的延长,各菌株肠道定植菌量均逐渐增加(图2)。与WT菌株相比,ΔtagH菌株的肠道定植菌量在各时间段均明显增加(P<0.01),ΔtagHΔhlyA菌株在6、18 h时的肠道定植菌量高于ΔtagH菌株(P<0.05),ΔtagHΔprtV菌株在3 h时的肠道定植菌量较ΔtagH菌株降低(P<0.05)。

A:各菌株感染组3 h的定植菌量;B:各菌株感染组6 h的定植菌量;C:各菌株感染组18 h的定植菌量;*、**、***:P <0.05、P <0.01、P <0.001。
2.3 小鼠灌胃感染实验 为了进一步探究WT菌株、ΔtagH菌株、ΔtagHΔhlyA菌株和ΔtagHΔprtV菌株在小鼠肠道中感染致病能力的差异,我们进行了小鼠灌胃感染实验。
2.3.1 各组小鼠血液中白细胞水平比较 为探究各菌株感染小鼠所引起的炎症反应强度差异,在不同菌株灌胃感染小鼠18 h后,我们对小鼠血液中的白细胞进行了计数。结果显示,ΔtagH菌株感染组小鼠血液中的白细胞数较WT菌株感染组明显增高(P<0.05),ΔtagHΔhlyA菌株感染组的白细胞数较ΔtagH菌株感染组明显下降(P<0.05),ΔtagHΔprtV菌株感染组的白细胞数与ΔtagH菌株感染组相近(P>0.05,图3)。

*:P <0.05;ns:P>0.05。
2.3.2 各组小鼠血液中细胞因子水平比较 在不同菌株灌胃感染小鼠18 h后,我们对小鼠血液中的IL-6、IL-8和TNF-α的浓度进行检测。与PBS阴性对照组相比,WT菌株感染组小鼠血清中IL-6水平显著增加(P<0.05);ΔtagHΔhlyA菌株感染组小鼠血清IL-6水平与WT菌株感染组相比显著下降(P<0.05);其余各组间无显著差异(4A)。与PBS阴性对照组和WT菌株感染组相比,ΔtagH菌株感染组小鼠血清中IL-8水平显著升高(P<0.05);ΔtagHΔprtV菌株感染组小鼠血清IL-8水平与PBS对照组相比也显著增加(P<0.05),其余各组间无显著差异(图4B)。与PBS阴性对照组相比,ΔtagH菌株感染组小鼠血清中TNF-α水平显著增加(P<0.05),其余各组间无显著差异(图4C)。

A:各菌株感染组小鼠血清中IL-6水平;B:各菌株感染组小鼠血清中IL-8水平;C:各菌株感染组小鼠血清中TNF-α水平;*:P <0.05。
2.3.3 各组小鼠回肠组织感染情况比较 为探究各菌株感染小鼠对肠道组织的损伤情况,在感染小鼠18 h后,我们对小鼠回肠段组织进行病理切片观察。结果显示,与WT菌株感染组相比,ΔtagH菌株感染组小鼠肠黏膜糜烂更严重、绒毛显著缩短、白细胞数量更多并且充血更明显,ΔtagHΔhlyA菌株感染组情况较ΔtagH菌株感染组明显减弱,ΔtagHΔprtV菌株感染组情况与ΔtagH菌株感染组相似(图5、6)。
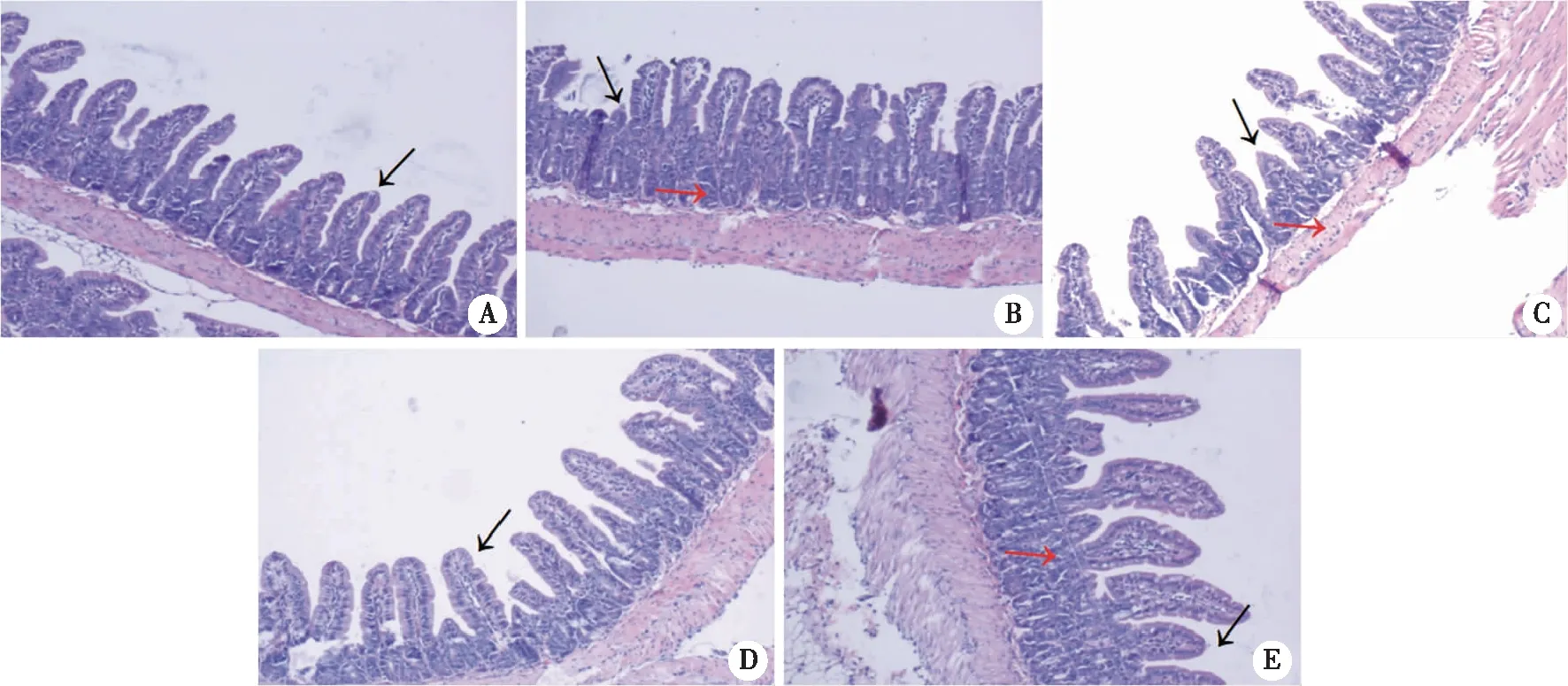
A:PBS阴性对照组;B:WT菌株感染组;C:ΔtagH菌株感染组;D:ΔtagHΔhlyA菌株感染组;E:ΔtagHΔprtV菌株感染组;黑色箭头指示肠绒毛;红色箭头指示中性粒细胞浸润;×100。

****:P <0.000 1。
2.3.4 各组小鼠生存率比较 我们同时对小鼠的7 d的生存情况进行分析,结果显示,WT菌株感染组、ΔtagH菌株感染组、ΔtagHΔhlyA菌株感染组、ΔtagHΔprtV菌株感染组的小鼠生存率分别为62.5%、75%、100%和75%(图7)。

图7 各菌株感染组小鼠生存率曲线
3 讨论
FHA结构域是经典的磷酸肽识别结构域[15],可专一性地识别苏氨酸磷酸化位点,参与了细菌生长代谢过程,如细胞形态的调节、III型分泌系统、细菌与宿主相互作用和信号转导等[16-17]。目前认为FHA结构域与其伴侣蛋白间的相互作用过程受蛋白磷酸化水平可逆调控[18-19],而阻止FHA结构域与磷酸肽分子之间的相互作用有可能成为新型抗菌药物研发的重要靶点。有趣的是,许多T6SS基因簇也表达含有FHA结构域的蛋白,通常FHA结构域蛋白与丝氨酸-苏氨酸激酶和丝氨酸-苏氨酸磷酸酶组成苏氨酸磷酸化系统,通过其苏氨酸磷酸化作用能够调节T6SS组装。霍乱弧菌T6SS中含FHA结构域蛋白的编码基因为tagH,其定位于T6SS基因簇中。有研究显示:敲除tagH基因后,T6SS系统的标志性蛋白Hcp不能被分泌,提示tagH基因敲除会显著抑制T6SS功能[20]。本课题组前期研究显示,TagH在翻译后水平通过蛋白酶PrtV负调控溶血素HlyA进而影响非O1/非O139群霍乱弧菌肠外侵袭及致病力[12]。为了引起腹泻性霍乱,霍乱弧菌必须有效地在小肠内定植。本研究主要探究TagH对非O1/非O139群霍乱弧菌小鼠肠道定植能力和致病力的影响以及这种影响是否依赖于霍乱弧菌溶血素HlyA和蛋白酶PrtV。
本研究首先通过细菌生长曲线实验验证各菌株的生长速度一致并无明显差异,进而排除后续小鼠定植和致病力是由于细菌自身生长速度差异所导致的。在乳鼠肠道定植实验中,我们发现,当敲除tagH基因时,相比WT菌株,ΔtagH菌株的定植能力明显增强,说明tagH基因是影响霍乱弧菌定植能力的重要基因。为了进一步探究溶血素HlyA和蛋白酶PrtV对ΔtagH菌株定植能力增强的贡献,我们在敲除tagH基因的基础上进一步敲除hlyA基因和prtV基因。实验结果显示,ΔtagHΔhlyA菌株的肠道定植菌量高于ΔtagH菌株,提示溶血素HlyA可能对细菌定植可能有负性影响。Olivier等的研究发现,溶血素不会增强霍乱弧菌初始定植或早期生长[21]。因此,关于HlyA在霍乱弧菌定植过程中的作用还有待进一步探究。此外,ΔtagHΔprtV菌株的定植能力与ΔtagH菌株比较只在3 h时明显减弱,提示PrtV可能仅在早期定植中有一定的作用。
肠黏膜屏障是胃肠道抵御细菌攻击最重要的结构,霍乱弧菌分泌的肠道内毒素引起炎症反应可能是细菌致病的重要机制[22]。本实验经灌胃途径感染成年小鼠,我们发现ΔtagH菌株感染组小鼠白细胞数较野生株显著增高,提示ΔtagH菌株引起小鼠炎症反应更重。而ΔtagHΔhlyA菌株感染组小鼠白细胞数较ΔtagH菌株感染组明显下降。结果提示HlyA是ΔtagH菌株诱导小鼠炎症反应加重的主要原因,与欧刚卫的研究结果一致[23]。组织病理结果也提示ΔtagH菌株感染组肠组织损伤程度最强,ΔtagHΔhlyA菌株感染组肠组织损伤程度较ΔtagH菌株显著减弱。此结果也提示HlyA是ΔtagH菌株毒力增强的主要原因,即TagH对细菌毒力的调控依赖于HlyA。此外,本研究发现ΔtagHΔprtV菌株感染组与ΔtagH菌株感染组小鼠的白细胞计数相近,组织病理结果显示两组小鼠的组织损伤程度相近,提示TagH对细菌毒力的调控基本不受蛋白酶PrtV的影响。
综上所述,本研究结果提示TagH抑制霍乱弧菌的肠道定植能力和肠道致病力,其调控作用主要依赖于霍乱弧菌溶血素HlyA,而对蛋白酶PrtV的依赖性不高。本研究结果为进一步了解TagH蛋白调控霍乱弧菌毒力的分子机制提供重要的实验证据。
