猫爪草醇类提取物对小鼠骨髓来源巨噬细胞极化的影响
2023-05-27刘芊伊刘利萍蒙祖迪卫麟娜高雪涵罗军敏
亓 凯,刘芊伊,刘利萍,蒙祖迪,卫麟娜,高雪涵,宋 涛,罗军敏
(遵义医科大学 免疫学教研室,贵州 遵义 563099)
巨噬细胞是机体内重要的免疫细胞,在抗病原微生物、抗肿瘤、炎症损伤中发挥重要的调节功能。近年来,巨噬细胞在感染免疫过程中所发挥的作用成为研究者关注的焦点。巨噬细胞在不同诱导刺激下可产生极化,从而表现出较强的表型和功能的可塑性与异质性。目前根据其状态和功能的不同分为:经典活化型(M1)和替代活化型(M2)[1]。M1型巨噬细胞由IFN-γ、脂多糖等Th1型细胞因子诱导而来,分泌大量的炎症因子,如IL-1、NO等;M2型巨噬细胞由IL-4、IL-13等Th2型细胞因子诱导活化,分泌抗炎因子,如IL-10、TGF-β等[2]。当机体受到感染或炎症等理化因素刺激时,巨噬细胞多表现出 M1表型,释放 TNF-α,IL-1β等因子来发挥固有免疫功能;因此,机体调控产生M2型巨噬细胞分泌大量的 IL-10和 TGF-β 等发挥免疫抑制功能,促进组织修复、血管生成和维持内环境稳态[3-4]。巨噬细胞可根据其不同的表型来发挥相应的功能,针对巨噬细胞极化的调控策略可成为感染性疾病临床治疗新的切入点[5]。
猫爪草(ranunculi ternati radix, RTR)为毛莨科植物小毛莨的块根,功能主治化痰散结,解毒消肿[6]。近年来研究表明猫爪草具有抗肿瘤、抗结核以及调节机体免疫功能的药理作用[7-9]。研究表明,猫爪草治疗浅表淋巴结结核的效果较好,不良反应发生率较低[10]。杨牧之等[11]研究发现猫爪草提取物可以提高小鼠腹腔巨噬细胞的活性,从而影响机体的免疫效应。也有研究显示猫爪草可提高巨噬细胞的吞噬功能从而加强免疫活性[12]。目前有关猫爪草的相关免疫作用机制尚未阐明,是否影响巨噬细胞极化尚不清楚。本实验用猫爪草醇类提取物体外刺激小鼠骨髓来源巨噬细胞(bone marrow-derived macrophages, BMDM),检测巨噬细胞极化相关标志物的表达,鉴定巨噬细胞的极化表型,为猫爪草进一步的临床应用奠定实验研究基础。
1 材料与方法
1.1 实验药物 RTR醇类提取物购于小草植物科技有限责任公司,原产地广西,批号:XC20151205,规格:10∶1。
1.2 实验动物 BALB/c小鼠,6~8周,雌性,购于重庆医科大学动物实验中心。
1.3 实验所用试剂 DMEM培养基和FBS购于Gibco公司;小鼠重组GM-CSF购于Peprotech公司;CCK-8试剂盒购自东仁化学科技(上海)有限公司;RNA逆转录、qPCR试剂盒购于TaKaRa公司;PCR引物合成由生工生物工程公司完成;IL-10、iNOS、TGF-β和TNF-α ELISA试剂盒购自eBioscience 公司。
1.4 获取BMDM 6~8周大的BABL/C小鼠,取股骨及胫骨骨髓细胞,用DMEM完全培养基(含有20 ng/mL GM-CSF),37 ℃、5% CO2培养7 d,收集贴壁细胞,流式细胞术检测巨噬细胞标志物F4/80和CD11b表达情况鉴定体外培养巨噬细胞的纯度。
1.5 CCK8检测BMDM活性 收集培育7 d的BMDM,密度为每孔3×104个铺于96孔板中,孵育箱培养24 h使其贴壁,将10、50、100、150、200、500 μg/mL不同浓度RTR诱导BMDM 24 h,并设空白对照孔,每组3个复孔。CCK8检测BMDM的活性。
1.6 qRT-PCR检测BMDM细胞因子的转录水平 收集BMDM,TRIzol法提取总RNA,按照TaKaRa说明书所述,以总RNA为模板,将mRNA反转录为cDNA,反应条件为37 ℃ 15 min,85 ℃ 5 s。以cDNA为模板构建qRT-PCR反应体系,95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 30 s,40个循环,引物序列见表1。

表1 引物序列
1.7 ELISA检测BMDM细胞因子的分泌水平 收集细胞的培养上清,用ELISA检测TNF-α、IL-10、TGF-β细胞因子的分泌。按照试剂盒说明书加样,置于37 ℃温育60 min,加入稀释30倍的洗涤液洗板5次,加显色剂A、B,37 ℃避光显色5~15 min后加入终止液,终止反应。450 nm波长检测吸光度(OD)值并检测细胞因子浓度。
1.8 流式细胞术检测BMDM细胞标志物的表达 取BMDM,收集于流式管中,分别加入F/480抗体、NOS2抗体与CD206抗体各1 μL,4 ℃避光共孵育30 min,洗去游离的抗体,重悬后,流式细胞仪检测NOS2与CD206的表达情况。
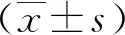
2 结果
2.1 RTR醇类提取物对BMDM活性及形态的影响 细胞培养7 d后,F480+/CD11b+阳性率达90.6%,鉴定为BMDM(图1A);以不同浓度梯度RTR刺激BMDM 24 h,CCK-8检测其活性变化,确定100 μg/mL的RTR为后续实验最佳的刺激浓度(图1B);RTR刺激BMDM 24 h后,光镜下观察巨噬细胞为梭状、伪足较长,呈M1型,未刺激组的M0型巨噬细胞呈椭圆形(图1C)。

A:FCM检测BMDM细胞标志物的表达;B:CCK-8检测RTR醇类提取物刺激BMDM最佳浓度;C:光镜下观察BMDM、RTR醇提取物形态变化,×20;*、**:与对照组比较,P<0.05、P<0.01;n=3。
2.2 RTR醇类提取物对BMDM细胞因子转录水平的影响 分别用IFN-γ、IL-4、RTR 刺激BMDM 0、12、24、36、48、72 h,RTR醇类提取物组与对照组相比,M1型标志物IL-6、iNOS、TNF-α的mRNA表达水平升高(图2A)。另一方面,M2型标志物IL-10、Arg-1、TGF-β的表达水平降低(图2B)。
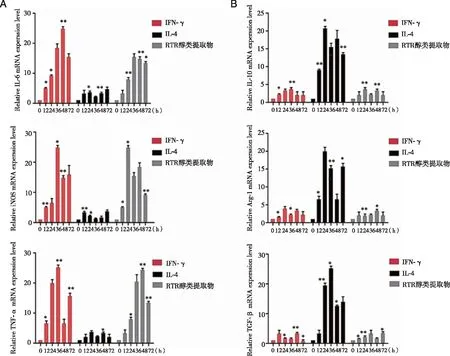
*、**:与对照组比较,P<0.05、P<0.001;n=3。
2.3 RTR醇类提取物对BMDM细胞因子分泌水平的影响 RTR刺激BMDM 48 h后检测细胞上清液中细胞因子的表达,与M0型巨噬细胞相比TNF-α、iNOS相对表达水平较对照组显著增加(图3A、B)。TGF-β、IL-10相对表达水平明显降低(P<0.05,图3C、D)。表明RTR刺激后的BMDM与M1型极化相关。

*、**:与对照组比较,P<0.05、P<0.01;n=3。
2.4 RTR醇类提取物对BMDM 极化相关膜分子表达的影响 RTR醇类提取物刺激BMDM后,F4/80+NOS2+细胞占比随刺激时间逐渐升高,于36 h达到峰值,F4/80+CD206+细胞占比未发生明显改变,表明BMDM发生M1型极化(图4)。
3 讨论
根据不同的微环境,巨噬细胞可分化为 M1、M2两种不同的表型。M1型巨噬细胞又被称为经典激活的巨噬细胞(classically activated macrophage),激活后分泌活性氧中间产物和还原性一氧化氮合酶等大量的炎性细胞因子,促进炎症的发展,从而清除病原体,调节并促进Th1型免疫应答;M2型巨噬细胞被称为替代激活的巨噬细胞(alternatively activated macrophage),激活后高表达炎症抑制因子,抑制炎症反应,促进组织修复等[13]。因此,探索巨噬细胞极化的相关机制有利于阐明疾病的发生发展,为临床用药提供理论支持。近年来有大量研究报道中草药及其活性成分对巨噬细胞的影响,从而揭示巨噬细胞极化与治疗疾病的关联[14-16]。猫爪草是我国民间用于抗结核的传统药物,对于结核分枝杆菌具有明显的抑制作用[17-18]。研究表明猫爪草可以抑制结核杆菌生长,促进巨噬细胞分泌TNF-α[19]。但目前研究中猫爪草是否能够调控巨噬细胞表型、功能改变未见报道。
为了明确RTR的免疫功能与机制,本研究采用RTR醇类提取物诱导BMDM,观察RTR醇类提取物与巨噬细胞极化的关联。首先从形态学观察,M0型巨噬细胞以圆形、椭圆形为主,RTR醇类提取物诱导后,细胞形态呈梭状且伪足较长,与 M1型巨噬细胞形态相近。进一步检测RTR醇类提取物诱导后 巨噬细胞极化相关mRNA的表达水平,发现M1型极化相关IL-6、iNOS、TNF-α的mRNA表达显著上调,且M2型极化相关IL-10、Arg1、TGF-β的 mRNA表达明显下调;另一方面ELISA结果显示TNF-α、iNOS的分泌明显增加,而TGF-β、IL-10的分泌降低。上述结果表明,猫爪草可以刺激M1型极化相关炎症因子的转录表达与分泌,与文献报道的M1型巨噬细胞极化后的功能相符合[20]。为了明确猫抓草刺激后BMDM极化表型的改变,通过FCM检测极化相关标志物的表达,发现M1型极化相关标志物NOS2表达在RTR诱导36 h后明显升高,而M2型极化相关标志物CD206无明显变化,表明猫抓草具有刺激BMDM向M1型极化的活性。
基于猫爪草调节免疫功能的优势,本研究发现猫爪草醇类提取物能够诱导M1型巨噬细胞极化。为猫爪草相关研究明确了其抗结核、抗肿瘤相关药理药效,并为进一步研发猫爪草制剂在临床疾病的防治及应用提供基础实验依据。
