个体化预测前列腺癌患者癌因性疲乏列线图风险模型
2023-05-26陈小梅黄严金
陈小梅 黄严金

[摘要] 目的 探討前列腺癌患者癌因性疲乏(cancer-related fatigue,CRF)发生的危险因素,建立CRF风险预测模型。方法 收集2018年7月至2021年12月厦门市海沧医院诊治的329例前列腺癌患者,应用单因素和Logistic多因素回归分析筛选CRF高危因素,采用R软件绘制列线图模型并验证其效能。结果 前列腺癌患者的CRF发生率38.9%:多因素分析结果表明,年龄、抑郁、雄激素剥夺疗法、放疗、化疗是CRF发生的独立危险因素。CRF列线图模型受试者工作特征曲线下面积0.750(95%CI:0.694~0.806),校正曲线表明预测曲线和实际曲线基本一致,Hosmer-Lemeshow检验结果为χ2=8.959,P=0.256。决策曲线分析显示该模型具有较高的净收益。结论 本研究构建的列线图具有良好的预测效能,能够有效判断前列腺癌CRF的高危人群并及早制定预防措施。
[关键词] 前列腺癌;癌因性疲乏;危险因素;列线图
[中图分类号] R737 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.09.003
Establishment of a nomogram model for individualized prediction of cancer- related fatigue in prostate cancer patients
CHEN Xiaomei, HUANG Yanjin
Department of Urological Surgical, Xiamen Haicang Hospital, Xiamen 361026, Fujian, China
[Abstract] Objective To investigate the risk factors of cancer-related fatigue (CRF) in patients with prostate cancer, and to establish a risk prediction model for CRF. Methods A total of 329 patients with prostate cancer diagnosed and treated in Xiamen Haicang Hospital from July 2018 to December 2021 were collected. Univariate analysis and logistic multivariate regression analysis were used to screen the high risk factors of CRF. The R software was used to draw a nomogram model and verify its efficacy. Results The incidence of CRF in prostate cancer patients was 38.9%. Multivariate analysis showed that age, depression, androgen deprivation therapy, radiotherapy, and chemotherapy were independent risk factors for CRF. The area under the receiver operating characteristic curve of nomogram model was 0.750 (95%CI: 0.694~0.806). The calibration curve showed that the predicted curve was basically consistent with the actual curve. The Hosmer-Lemeshow test result was χ2=8.959, P=0.256. The decision curve analysis showed that the model has a higher net benefit. Conclusion The nomogram constructed in this study has good predictive performance, which can effectively determine the high-risk groups of prostate cancer CRF and formulate preventive measures as soon as possible.
[Key words] Prostate cancer; Cancer-related fatigue; Risk factor; Nomogram
随着雄激素剥夺疗法(androgen deprivation therapy,ADT)、放射疗法、化学疗法和手术治疗技术水平的提高,前列腺癌5年生存率可高达75%~94%[1-3]。关于前列腺癌的高发病率及生存率、患者的生活质量研究受到广泛关注。
癌因性疲乏(cancer-related fatigue,CRF)是所有肿瘤患者经历的普遍、令人痛苦的症状之一,表现为持续的身体、精神和(或)情绪疲劳感,严重影响患者的生活质量[4]。美国国立综合癌症网将CRF定义为“一种痛苦的、持续的、主观的乏力感/疲倦感,与肿瘤或肿瘤治疗相关,干扰正常的功能[5]。本研究旨在分析前列腺癌患者的CRF危险因素,建立列线图模型以评估CRF的发生风险。
1 资料与方法
1.1 一般资料
![]() 选取2018年7月至2021年12月厦门市海沧医院诊治的前列腺癌患者329例作为研究对象,依据是否出现CRF分为CRF组(n=128)和非CRF组(n=201)。纳入标准:①穿刺活检或手术病理明确诊断为前列腺癌;②初次进行前列腺癌治疗;③神志清楚,配合良好,可独立完成各项调查问卷表;④对本研究知情,自愿参加本研究;⑤临床病理资料完整。排除标准:①同时合并其他部位的恶性肿瘤;②病情严重,预期寿命≤6个月。本研究通过厦门市海沧医院医学伦理委员会审批(伦理审批号:KY-2020012)。
选取2018年7月至2021年12月厦门市海沧医院诊治的前列腺癌患者329例作为研究对象,依据是否出现CRF分为CRF组(n=128)和非CRF组(n=201)。纳入标准:①穿刺活检或手术病理明确诊断为前列腺癌;②初次进行前列腺癌治疗;③神志清楚,配合良好,可独立完成各项调查问卷表;④对本研究知情,自愿参加本研究;⑤临床病理资料完整。排除标准:①同时合并其他部位的恶性肿瘤;②病情严重,预期寿命≤6个月。本研究通过厦门市海沧医院医学伦理委员会审批(伦理审批号:KY-2020012)。
1.2 评价标准
1.2.1 焦虑和抑郁状态评价 采用焦虑自评量表(self rating anxiety scale,SAS)和抑郁自评量表(self rating depression scale,SDS)评估患者首次入院时的焦虑和抑郁状态,两个量表均由20个条目构成,每个条目评分1~4分,各个条目分值相加为总粗分,总粗分乘以1.25后取整数部分为标准分,分值越高表明症状越严重。SAS总分<50分为正常,≥50分表明存在焦虑;SDS总分<53分表明正常,≥53分为抑郁[6]。
1.2.2 代谢综合征 需至少满足以下5个指标中的3个:①腰围≥90cm;②三酰甘油>150mg/dl(1.7mmol/L);③高密度脂蛋白<40mg/dl(1.0mmol/L);④空腹血糖>110mg/dl(6.1mmoL/L);⑤收缩压≥130mmHg(1mmHg=0.133kPa)或舒张压≥85mmHg[7]。
1.2.3 骨质疏松评价 采用双能X线吸收仪评估首次入院时骨质疏松状况,测量腰椎1~4椎体、股骨颈、股骨大粗隆骨密度,如果3个部位中的1个无法测量(如内固定、严重变形),则选取桡骨远端1/3。根据公式T值=(骨密度值-中国正常青年人峰值骨密度值)/中国正常青年人峰值骨密度的标准差(standard deviation,SD),T<2.5SD诊断为骨质疏松[8]。
1.2.4 简短疲乏评估量表 采用簡短疲乏评估量表(the brief fatigue inventor,BFI)评估患者首次诊断前列腺癌后6个月至2年的CRF程度,该量表共包括9个条目,前3个条目分别为当前疲乏、过去24h通常疲乏及最严重程度;后6个条目分别评估疲乏对一般活动、情绪、行走能力、正常工作、他人关系和生活的影响。每个条目以0~10分线段评分法,根据患者自身的疲乏状态做相应的标记。将9个条目的平均分作为总分,总分0分为无疲乏,1~3分为轻度疲乏,4~6分为中度疲乏,7~10分为重度疲乏[9]。
1.3 统计学方法
应用SPSS 26.0统计学软件对数据进行分析和处理,符合正态分布的计量资料以均数±标准差(![]() )表示,采用两独立样本t检验;非正态分布时以中位数(四分位数间距)[M(Q1,Q3)]表示,采用 Mann-Whitney U秩和检验。计数资料以例数(百分率)[n(%)]表示,采用χ2检验。根据单因素分析中P<0.05的变量纳入多因素Logistic回归分析,以逐步后退法筛选前列腺癌CRF的独立危险因素。采用R软件、RMS程序包建立前列腺癌CRF列线图预测模型,绘制受试者操作特征曲线(receiver operating characteristic curve,ROC曲线)并计算曲线下面积(area under curve,AUC),绘制校准曲线、决策曲线验证模型的效能,P<0.05 表示差异有统计学意义。
)表示,采用两独立样本t检验;非正态分布时以中位数(四分位数间距)[M(Q1,Q3)]表示,采用 Mann-Whitney U秩和检验。计数资料以例数(百分率)[n(%)]表示,采用χ2检验。根据单因素分析中P<0.05的变量纳入多因素Logistic回归分析,以逐步后退法筛选前列腺癌CRF的独立危险因素。采用R软件、RMS程序包建立前列腺癌CRF列线图预测模型,绘制受试者操作特征曲线(receiver operating characteristic curve,ROC曲线)并计算曲线下面积(area under curve,AUC),绘制校准曲线、决策曲线验证模型的效能,P<0.05 表示差异有统计学意义。
2 结果
2.1 前列腺癌患者CRF的发生及单因素分析
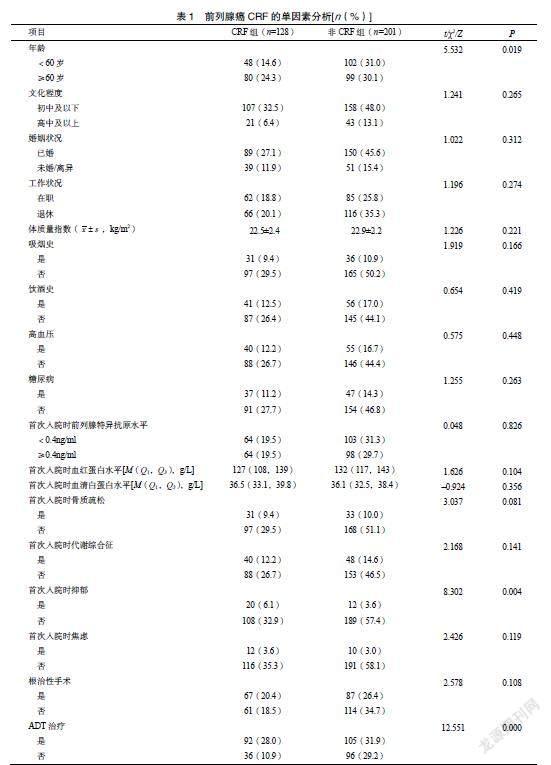
329例前列腺癌患者中,CRF的发生率38.9%(128/329)。单因素分析表明,CRF与患者的文化程度、婚姻状况、工作状况、体质量指数、吸烟史、饮酒史、高血压、糖尿病及患者首次入院时的前列腺特异抗原水平、血红蛋白水平、血清白蛋白水平、骨质疏松、代谢综合征、焦虑和根治性手术无关(P>0.05);与年龄、首次入院时抑郁、ADT、放疗、化疗有关(P<0.05),见表1。
2.2 前列腺癌患者CRF的多因素分析
将单因素分析結果中差异有统计学意义的变量作为自变量,将是否出现CRF作为因变量进行多因素Logistic回归分析,结果表明,年龄、首次入院时抑郁、ADT、放疗、化疗是前列腺癌患者CRF的独立危险因素(P<0.05),见表2。
2.3 前列腺癌患者CRF列线图模型的构建及验证
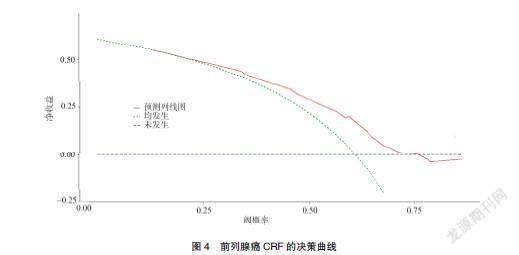
将5个独立危险因素建立CRF列线图模型,见图1。根据每个指标的具体情况对应相应的分数,每个指标分数相加为总分,总分向CRF风险概率轴做一垂直线即为CRF的发生风险。绘制ROC曲线并计算AUC=0.750(95%CI:0.694~0.806),见图2。Hosmer-Lemeshow检验结果为χ2=8.959,P=0.256。绘制的校正曲线表明预测曲线和实际曲线基本一致,见图3,表明模型具有较好的区分度和准确度。决策曲线分析显示模型具有较高的净收益,见图4。
3 讨论
3.1 前列腺癌患者CRF的发生概述
CRF是肿瘤患者常见不良事件,即使肿瘤治疗结束仍可长期存在。CRF常见的症状包括躯体疲劳(活动下降、懒惰和压力)和精神疲劳(注意力不集中、学习能力下降和短期记忆丧失),对患者的日常生活、生理和心理产生负面影响,严重降低患者治疗期间及治疗后的生活质量[10]。本研究中38.9%的前列腺癌患者出现CRF,对14项研究中共4736例前列腺癌患者进行荟萃分析,结果显示CRF发生率40%[11]。Feng等[12]对47例接受放疗的前列腺癌患者进行随访,治疗1年后34%的患者仍存在CRF。
3.2 前列腺癌患者CRF的列线图模型
列线图是建立在多因素分析结果的基础上,将多个临床相关变量整合成带有刻度的线段,可视化和图像化呈现各个变量对临床结局的影响,有助于便捷、直观地计算临床结局发生概率,目前已被床广泛应用[14]。本研究AUC=0.750,Hosmer-Lemeshow检验结果显示拟合优度良好。绘制的校正曲线表明预测曲线和实际曲线基本吻合,决策曲线分析显示模型的净收益较高,表明该模型具有较好的预测效能,有利于医护人员个体化、精确地预测前列腺癌患者CRF风险。
3.3 前列腺癌患者CRF发生的危险因素分析
年龄是前列腺癌患者CRF的重要影响因素。随着年龄的增长,新陈代谢降低、身体的机体功能减退、躯体受外界刺激的影响,老年人常并发多种慢性疾病,老年前列腺癌患者易出现疲乏无力、衰弱[15]。
肿瘤对人体是重大应激源,对人体的身体和心理造成重大的打击。抑郁症是常见的精神障碍,在肿瘤患者中患病率约25%,普通人群约5%~6%[16]。本研究中,抑郁可增加前列腺癌患者发生CRF的风险。抑郁表现为持久的情绪低落、苦恼忧伤、兴趣减退,思维迟钝、注意力障碍、动作迟缓、精力丧失、无精打采、疲乏无力等。Baden等[17]研究发现前列腺癌幸存者中CRF和抑郁常同时出现,相互作用,加重患者的症状负担。
ADT是前列腺癌患者常见的治疗手段之一,通过抑制人体睾酮的产生,从而阻断睾酮诱导的前列腺肿瘤细胞生长和分裂[18]。本研究中,ADT增加前列腺癌患者CRF风险。国外研究表明,ADT可引起骨骼密度下降、增加骨折、心血管疾病、糖尿病、性功能障碍、认知和情绪功能障碍、CRF、心理痛苦风险,降低患者的生活质量[19]。
放疗是利用电离辐射诱导癌细胞中双链 DNA 断裂,是治疗局部前列腺癌公认的有效方法。本研究中,放疗患者易发生CRF。放疗造成放射性直肠炎(腹痛、恶心、呕吐、血便、黏液便、里急后重感等症状)、放射性膀胱炎(尿急、尿频、尿痛、血尿等症状)及性功能障碍,降低患者认知功能和自我管理能力,影响身心健康[20]。
本研究中,化疗是前列腺癌患者CRF的风险因素。化疗在抑制肿瘤细胞的同时,也对正常的组织、细胞造成损伤,引起骨髓抑制、机体免疫力下降、严重持续性胃肠道反应后营养物质丢失、水电解质紊乱、周围神经病变,使机体功能衰弱、身心状态恶化,从而加重患者疲乏[21]。
总之,前列腺癌患者CRF的发生率高,年龄、抑郁、ADT、放疗、化疗是CRF的独立危险因素。构建的列线图模型能有效预测CRF的发生,可为临床早期识别并进行干预提供重要的借鉴。
[参考文献][1] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: Globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394–424.
[2] BALLON-LANDA E, PARSONS J K. Nutrition, physical activity, and lifestyle factors in prostate cancer prevention[J]. Curr Opin Urol, 2018, 28: 55–61.
[10] Agbejule O A, Hart N H, Ekberg S, et al. Self- management support for cancer-related fatigue: A systematic review[J]. Int J Nurs Stud, 2022, 129: 104–110.
[18] NGUYEN C, LAIRSON D R, SWARTZ M D, et al. Risks of major longterm side effects associated with androgen-deprivation therapy in men with prostate cancer[J]. Pharmacotherapy, 2018, 38(10): 999–1009.
