CalliSpheres®微球经导管肝动脉化疗栓塞术治疗原发性肝癌的疗效观察
2023-05-25裘华锋卢晓林邵国良
裘华锋 卢晓林 邵国良
原发性肝癌介入治疗已经越来越普及,经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是一种侵入性较小的姑息治疗,一般使用碘油、明胶海绵、聚乙烯醇颗粒等栓塞剂联合化疗药物来控制肿瘤生长,各国指南表明TACE 是进展期肝癌的首选治疗方法[1-2]。虽然TACE 可以达到一定的治疗效果,但也会产生并发症[3]。随着栓塞材料和技术的发展,研发出了载药微球,又称药物洗脱微球,它既是TACE 治疗中的化疗药物载体,又是肿瘤血管栓塞材料。CalliSpheres®微球(CalliSpheres microspheres,CSM)是我国自主研发的载药微球,通过载药珠将大剂量化疗药物注射到肿瘤供体动脉中,并延长药物释放的时间,减少化疗药物快速进入循环系统引起的不良反应[4]。文献报道载药微球经导管肝动脉化疗栓塞术(drug-eluting beads transhepatic arterial chemoembolization,DEB-TACE)较常规TACE 治疗更有效,且患者耐受性相当[5]。然而,CSM DEB-TACE 治疗原发性肝癌的疗效和安全性是否优于传统TACE 尚存争议,且CSM DEB-TACE 治疗原发性肝癌的临床报道相对较少。本研究旨在观察CSM DEB-TACE 治疗原发性肝癌患者的疗效和影响因素,探讨其临床应用价值,现将结果报道如下。
1 对象和方法
1.1 对象 收集嵊州市人民医院2016年6月至2020年12月行DEB-TACE 治疗的原发性肝癌患者92 例,其中男72 例,女20 例,年龄58~76(67±9)岁;有饮酒史32 例(占34.8%),无饮酒史60 例(占65.2%);有既往肝病史84 例(占91.3%),无既往肝病史8 例(占8.7%);术前介入治疗18 例(占19.6%),无介入治疗74 例(占80.4%);美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分:0 分72 例(占78.3%),1 分14例(占15.2%),2 分6 例(占7.5%);肿瘤最大径>10 cm者22 例(占23.9%),≤10 cm 者70 例(占76.1%)。纳入标准:(1)患者经临床、影像学或病理检查确诊为肝细胞癌(hepatocellular carcinoma,HCC);(2)患者在接受治疗前1 周内进行全面的检查(包括体格检查,肝功能、肾功能、肿瘤指标等相关实验室检查,胸、腹部CT或肝脏MRI 增强扫描);(3)术后1 周和1、3、6、12、18、24 个月等时点复查肝功能、肾功能及肿瘤指标等相关实验室指标,术后1、3、6、12、18、24 个月等时点复查肝脏MRI 增强扫描。排除标准:(1)合并严重肝功能或肾功能异常;(2)存在介入禁忌证患者[6];(3)继发性肝癌患者。本研究经嵊州市人民医院医学伦理委员会批准,所有患者均知情同意。
1.2 治疗方法 采用CSM(苏州恒瑞迦俐生生物医药科技有限公司,规格:100~300 μm 蓝色型,批号:20211020-01)行DEB-TACE 术。以Seldinger 穿刺法行股动脉穿刺,用飞利浦公司Allura Xper Fd20 型造影机行肝动脉数字减影血管造影(digital substraction angiography,DSA)检查,配合微导管超选择肿瘤供血动脉。将CSM加载表柔比星(比利时法玛西亚普强公司,规格:10 mg/支,批号:122FN5239)50 mg,按照1 ml/min速度缓慢推注至供血动脉,在肿瘤血管出现血流停滞,且可见血管铸型停止时,则结束栓塞。若目标剂量完全注入后仍未达到栓塞终点,额外推注空白微球,直至达到栓塞终点。待5 min 后行DSA 检查,如发现仍有肿瘤染色,则继续上述栓塞,复查造影显示肿瘤染色全部消失,供血动脉的血流明显减弱或完全停止后拔管,术毕穿刺点进行加压包扎。术后复查实验室指标和肝脏MRI 增强扫描以评价疗效[7]。常规进行保护肝和胃黏膜、止痛、止吐等对症治疗,术后予多烯磷脂酰胆碱针(成都天台山制药有限公司,规格:232.5 mg/支,批号:11211216)465 mg 溶于5%葡萄糖注射液250 ml 中,静脉滴注,1 次/d,连用3 d。注射用泮托拉唑钠(成都通德药业有限公司,规格:40 mg/瓶,批号:120220406)40 mg 溶于0.9%氯化钠注射液10 ml中,静脉滴注,1 次/d,连用2 d。昂丹司琼针(福安药业集团宁波市天衡制药有限公司,规格:8 mg/支,批号:210908A02)8 mg 溶于0.9%氯化钠注射液250 ml 中,静脉滴注,2 次/d,连用2 d。术后使用数字疼痛评分(numerical rating scale,NRS)对患者疼痛程度作出评估,0 分表示无疼痛,10 分表示最剧烈的疼痛。按照疼痛对应的数字将疼痛程度分为:轻度疼痛(1~3 分)、中度疼痛(4~6 分)、重度疼痛(7~10 分)。若患者NRS 评分<4 分,予吲哚美辛栓(马应龙药业集团股份有限公司,规格:50 mg×10 粒,批号:220402)50 mg 直肠给药,1 次/d。若患者NRS评分≥4 分,则联合使用哌替啶针(青海制药厂有限公司,规格:50 mg/支,批号:190912-1)50 mg 肌肉注射,每6 小时按需要重复。
1.3 观察指标及疗效评估 记录患者术前巴塞罗那肝癌分期(Barcelona clinic liver cancer stage,BCLC)分期、中国肝癌分期(China liver cancer stag,CNLC)和术后的临床信息,以及术前1 周、术后1 周和术后1 个月的肝功能指标判断术前及术后肝功能变化情况,如血清TBil、ALT、AST 和甲胎蛋白(alpha-fetoprotein,AFP)。术后1 个月由2 位副主任及以上放射科医师根据MRI 影像学表现,按照《改良实体瘤疗效评价标准》(mRECIST)进行疗效评价[8],疗效分为完全缓解(complete remission,CR):所有靶病灶消失;部分缓解(partial remission,PR):以治疗前靶病灶直径总和为参照,靶病灶直径总和下降至少30%;疾病稳定(stable disease,SD):靶病灶直径缩小程度未达到PR,增加程度未达到疾病进展(progressive disease,PD);PD:以治疗前靶病灶直径总和为参照,靶病灶的直径总和增加至少20%或出现新病灶。根据疗效评估后续治疗策略,术后不再符合DEB-TACE 适应证并换成全身治疗直到死亡患者13例,手术同时合并全身治疗患者仅1例,因此未纳入后续分析。将CR 和PR 患者作为有效组,SD 和PD 患者作为无效组,计算客观缓解率(overall response rate,ORR)=(CR+PR)/总例数×100%。采用美国国立癌症研究所制定的常见不良反应事件评价标准评估患者术中、术后常见不良反应(包括疼痛、发热、恶心、呕吐)。总体生存期(overall survival,OS)指手术后至死亡或最后随访的时间间隔;无进展生存期(progression-frees survival,PFS)为患者接受DEBTACE 治疗后至观察到PD 或者发生任何原因死亡的时间,随访截止时间为2022年7月。
1.4 统计学处理 采用R 语言统计软件。正态分布的计量资料以表示,非正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon 秩和检验,术前和术后1 周和术后1 个月比较采用Kruskal-WallisH检验;计数资料以例(%)表示,组间比较采用χ2检验。应用R 包“survival”(Version: 3.3-1)构建Cox 比例风险模型并进行log-rank 检验,记录相应的HR值及95%CI,采用Kaplan-Meier 法绘制生存曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 近期疗效 92 例患者中24 例患者未按要求周期进行检查,故剔除近期疗效分析,最终纳入68 例患者。术前患者肿瘤最大径为6.050(3.300,9.575)cm,术后1 个月为1.750(0,6.650)cm。患者术后1 个月经mRECIST 评价标准评估,疗效为CR 21 例,PR 34 例,SD 6例,PD 7例,ORR=80.9%(55/68)。典型病例见图1。
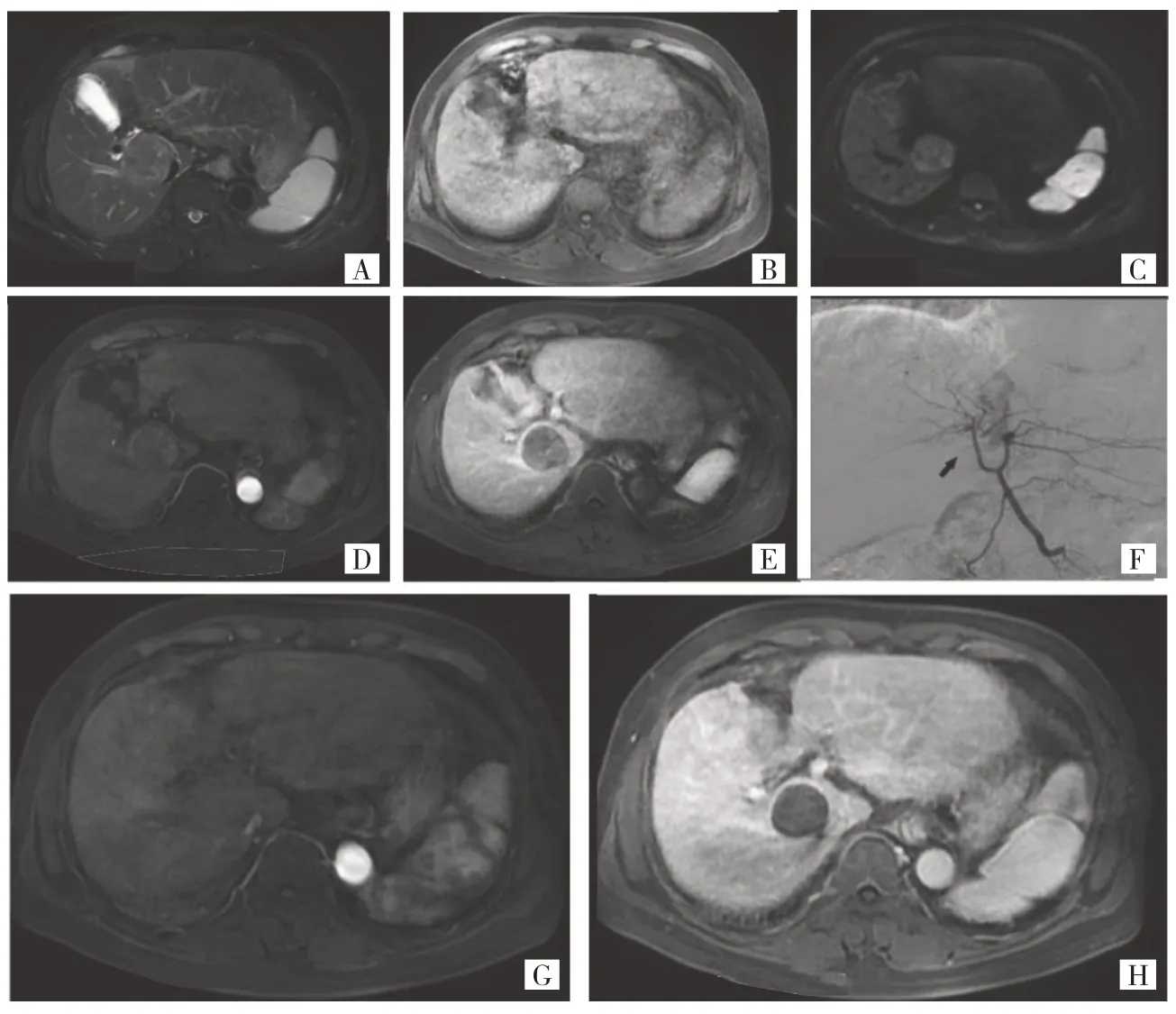
图1 65 岁男性HCC 患者术前术后影像学资料(A-E:2016年11月16日肝脏MRI 增强扫描发现肝S8 段肿块,大小4.2 cm×4.0 cm,T1WI 等低信号,T2WI 稍高信号,DWI 弥散受限呈高信号,Gd-DTPA 增强动脉期明显不均匀强化,静脉期强化减退,符合HCC 表现,肿瘤侵犯肝中静脉、肝右静脉,BCLC 分期C 期,CNLC 分期Ⅲa 期;F:2016年11月17日行DEB-TACE,DSA 检查中见实质期肝内团块状肿瘤染色;G-H:2016年12月19日肝脏MRI 增强扫描复查;肝S8 段肿瘤缩小,增强扫描靶病灶未见强化,评价为CR)
2.2 近期疗效的影响因素分析 68 例患者中有效组55 例,无效组13 例。有效组与无效组的饮酒史、BCLC分期和CNLC 分期的差异均有统计学意义(均P<0.05),其余变量两组间差异均无统计学意义(均P>0.05),见表1。
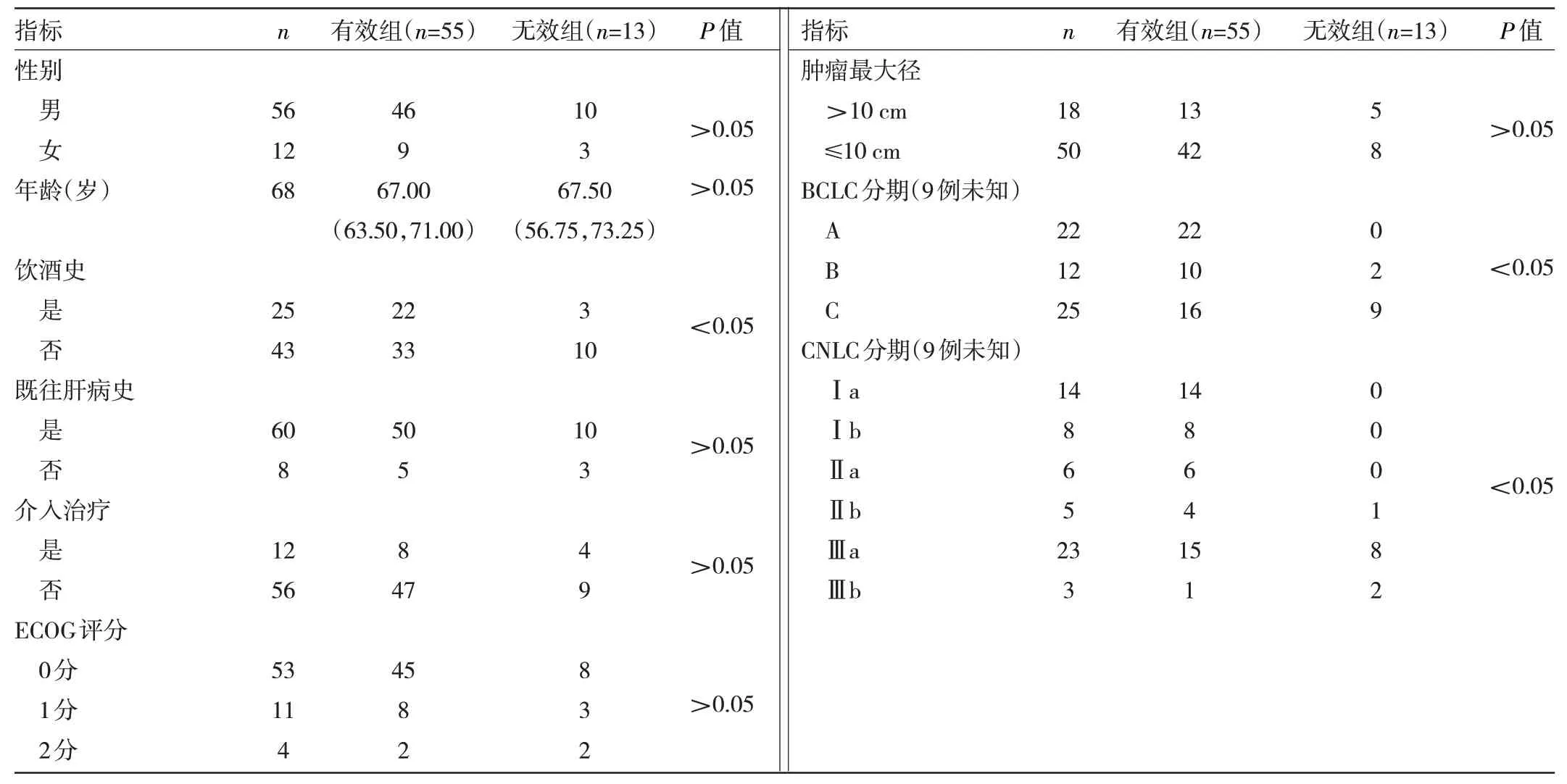
表1 影响DEB-TACE 手术疗效的单因素分析(例)
2.3 手术前后肝功能指标变化 与术前相比,患者术后1 周肝功能指标TBil、ALT 和AST 均显著升高,而在术后1 个月均恢复至DEB-TACE 治疗前水平(均P<0.05);术前、术后1 周和术后1 个月患者肝功能指标差异均有统计学意义(均P<0.05),见表2,表明DEBTACE 术后患者肝功能有一时性损害。

表2 术前术后肝功能指标变化
2.4 生化指标对患者术后预后的预测 结合上述92 例患者术后1 个月生化指标和预后随访信息,从中筛选出记录了明确疾病进展结局的75 例患者进行OS和PFS 分析。针对患者检测的AFP 水平(图2),在OS分析中,以49.27 ng/ml 为阈值将患者划分为高AFP 水平组和低AFP 水平组,单因素Cox 比例风险模型的HR值(95%CI)为2.911(1.480~5.724)(P<0.01),其中高AFP 水平组患者的中位OS 为17.00 个月,低AFP 水平组患者的中位OS 为41.00 个月;在PFS 分析中,以765.70 ng/ml 为阈值将患者划分为高AFP 水平组和低AFP水平组,单因素Cox比例风险模型的HR值(95%CI)为3.682(1.602~8.462)(P<0.01),其中高AFP 水平组患者的中位PFS 为5.97 个月,低AFP 水平组患者的中位PFS 为10.40 个月。低AFP 水平组患者术后20、40和60 个月的总体生存率高于高AFP 水平组,术后10、20、30 和40 个月的无进展生存率也高于高AFP 水平组。针对患者检测的ALT、AST 水平同样进行生存分析,差异均无统计学意义(均P>0.05),见图3。
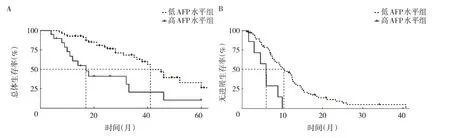
图2 术后患者不同AFP 水平的生存曲线(A:两组患者术后的总体生存期比较;B:两组患者术后的无进展生存期比较)
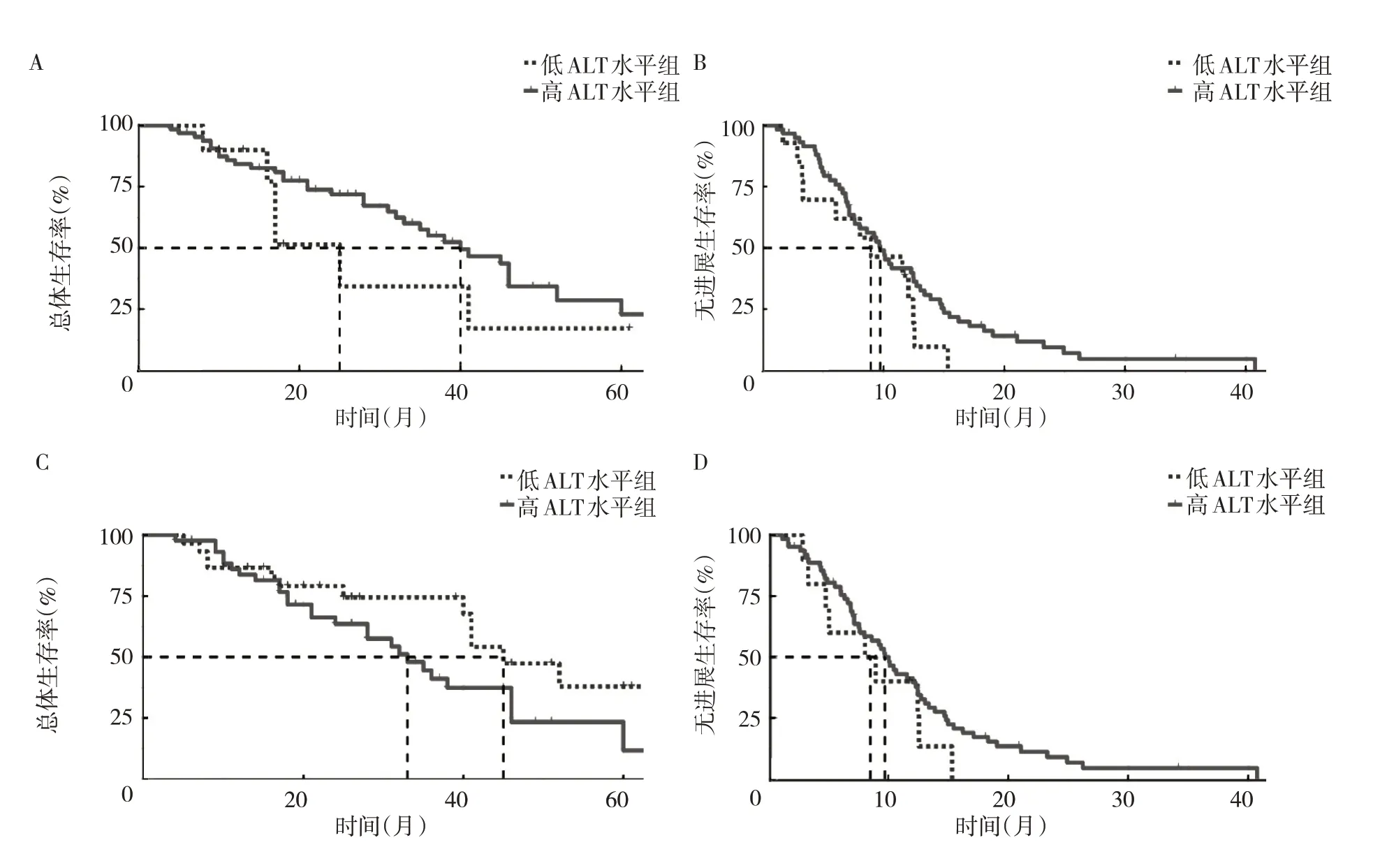
图3 术后不同ALT、AST 水平患者的生存曲线(A、B:不同ALT 水平患者术后总体生存期、无进展生存期的比较;C、D:不同AST水平患者术后总体生存期、无进展生存期的比较)
2.5 不同分期对患者术后预后的预测 对75 例不同分期的患者进行了PFS 分析。根据BCLC 分期(以A 为标准对照),分期为B 的患者单因素Cox 比例风险模型的HR值(95%CI)为1.736(0.877~3.439),分期为C 患者为4.215(2.312~7.683)(均P<0.01),分期为A、B、C 患者的中位PFS 分别为12.70、10.10 和6.00 个月,分期为A 的患者术后10、20、30、40 个月的无进展生存率高于其他分期,见图4。根据CNLC 分期(以Ia 为标准对照)进行PFS 分析,分期为Ⅲa 患者单因素Cox 比例风险模型的HR值(95%CI)4.552(2.354~8.803)(P<0.01),分期为Ⅰa 和Ⅲa 患者的中位PFS 分别为13.30和6.00 个月,分期为Ⅲa 预后最差,分期为Ⅰa 患者术后10、20、30 和40 个月的无进展生存率也高于其他分期,见图5。
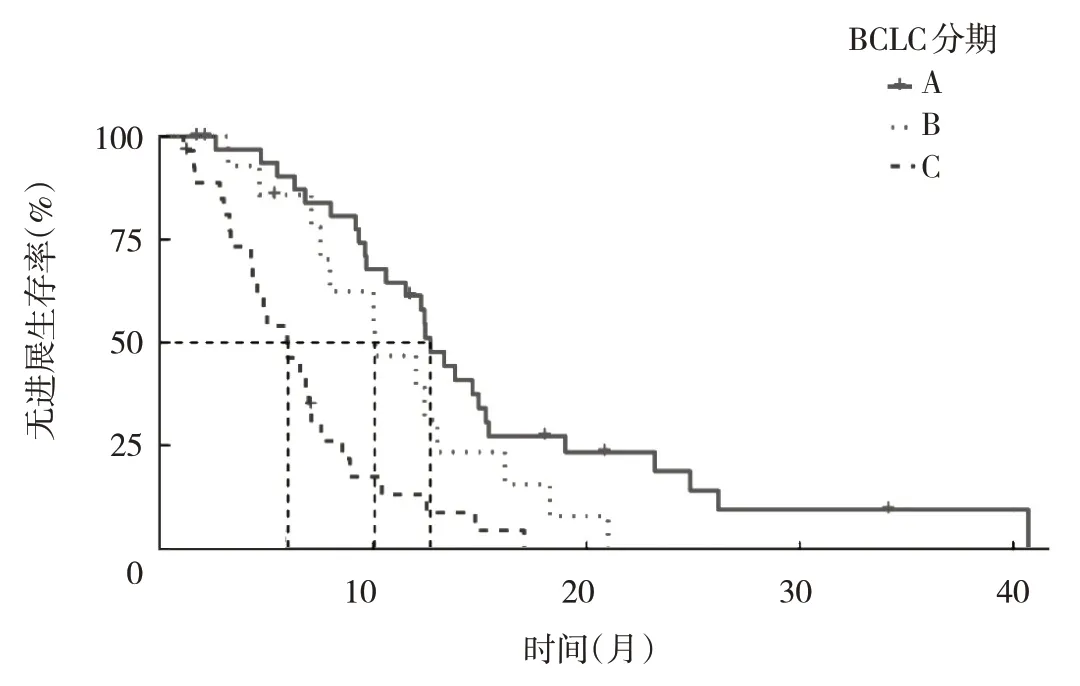
图4 术后不同BCLC 分期患者的无进展生存曲线

图5 术后不同CNLC 分期患者的无进展生存曲线
2.6 DEB-TACE 治疗后的不良反应 所有患者均记录了不良反应,术中及术后24 h 内,出现轻至中度疼痛上腹痛30 例次,较剧烈的恶心、呕吐4 例次。术后1周不良反应主要为栓塞后综合征,表现为发热、恶心以及腹痛,对症处理后明显改善。术后胆汁瘤2 例次,肝脓肿1 例次,均采用经皮肝穿刺置管引流后好转。所有患者均未出现穿刺出血、腹腔出血、胆漏、胃肠道出血、肿瘤出血等严重并发症。
3 讨论
传统TACE 疗效在临床实践中得到广泛认可[9]。然而,并不是所有的HCC 组织都有良好的碘油沉积,化疗药物也会因血流的不断冲刷而进入体循环,其长期疗效有待提高。CSM 由于自身良好的可变弹性,能够增强栓塞效果,并在靶血管内持续释放化疗药物,显著提高瘤内化疗药物浓度[10]。刘金等[11]采取CSM DEB-TACE 治疗12 例HCC 患者,术后3 个月的疾病缓解率为75%。陈刚等[12]研究发现,CSM DEB-TACE 治疗22 例原发性肝癌患者1 个月后,CR 和ORR 分别达到17.6%和58.8%。这些研究表明CSM DEB-TACE 治疗HCC 具有较好的治疗应答。本研究结果显示经CSM DEB-TACE 治疗后患者肿瘤体积明显减小,术后1 个月ORR 达80.9%,效能优于文献报道。
与传统TACE 相比,本研究中患者肝功能指标TBil、ALT 和AST 水平在DEB-TACE 术后1 周均显著升高,但术后1 个月复查相关指标与术前比较差异无统计学意义,与文献报道结果类似[13-14],这表明CSM DEB-TACE 对肝功能的损坏具有可逆性。笔者还进一步对患者术后1 个月的AFP 水平进行了预后分析,结果显示AFP 为原发性肝癌患者术后的危险因素,AFP水平越高,术后患者的整体和无进展生存结局越差。有研究表明,血清AFP 水平对原发性肝癌有较高的预后评估价值[15]。
在治疗反应上,既往研究显示DEB-TACE 不良反应发生率低于传统TACE,不良反应多为程度较轻的发热、呕吐、疼痛等[16]。Lammer等[17]报道,DEB-TACE能够显著降低严重肝损伤以及表柔比星等药物不良反应的发生率。本研究中患者术后腹痛、恶心、呕吐、发热等不良反应轻微,患者耐受性好。可能是DEB 将化疗药物在瘤内药物缓慢释放,减少了化疗药物的外周血液循环浓度,从而减少化疗药物的相关不良反应。
有研究报道肿瘤大小、病理分期等因素与HCC患者接受CSM DEB-TACE 治疗预后相关[18]。笔者根据BCLC 和CNLC 分期对患者进行分期并分析,发现分期为A 和Ⅰa 的患者术后预后更好,分期为C 和Ⅲa患者预后最差。此外,本研究还发现,饮酒史和CNLC 分期显著影响原发性肝癌患者的DEB-TACE 疗效。这些预测因素可给术前选择CSM DEB-TACE 治疗患者提供参考。
本研究不足之处为单中心回顾性研究,样本量相对较少,有待多中心大样本的研究证实。由于数据的限制,本研究未将患者是否合并全身治疗纳入分析,未来的DEB-TACE 联合全身治疗的研究,应着眼于细化入组标准,并进行分层分析找到联合治疗的最佳适宜人群。
