‘双优’葡萄组培苗根系发生的研究
2023-05-25李光宗韦伟单守明马军许文娣邵洁玲
李光宗,韦伟,单守明*,马军,许文娣,邵洁玲
(1. 宁夏大学农学院,宁夏银川 750021;2. 商洛学院,陕西商洛 726000)
‘双优’为我国育出的山葡萄新品种,在东北表现良好且具有较高的产量[1-2]。目前,对于葡萄的繁育方式主要以扦插和嫁接为主,其特点是简捷方便,但易受母株、砧木及繁育周期长等因素的限制,无法在短时间内实现大规模繁育[3-4]。此外,长期采取这些繁育方式,会造成严重的品种退化现象。组织培养具有成本低、速度快和操作程序简单等特点,能够有效避免时间、空间、气候等条件限制[5],加快优良品种的推广。目前已有许多关于葡萄组培方面的研究,涉及外植体选择、愈伤组织诱导、生根培养基筛选、炼苗及移栽[4-9]等方面,并取得相应的成效。然而葡萄组培中仍存在着生根不稳定、生根率不高等问题,在一定程度上限制了组培技术的应用。目前,关于‘双优’葡萄组培生根方面的研究鲜有报道,因此研究该品种枝条组培生根具有重要意义。
植物激素是植物体内合成的微量有机化合物,参与调控植物生根、发芽、开花等各个生长发育过程,在植物组培生根中也起着重要的调节作用。生长素即吲哚乙酸(Indoleacetic acid, IAA)是调控生根最重要的激素[10],以色氨酸作为底物,通过多条途径合成,其中主要的合成途径为吲哚-3-丙酮酸(Indole-3-pyruvate, IPA)途径[11],而YUCCA家族黄素单加氧酶(Flavin monooxygenase-like)和色氨酸氨基转移酶(Tryptophan aminotransferase of Arabidopsis 1,TAA1)协同参与该途径,从而合成生长素[12]。近年来,葡萄组培快繁相关研究取得了重大进展,其中培养基的类型、植物生长调节剂的种类和配比均会影响葡萄组培苗的生根[6,9],目前葡萄组培的相关研究着重于组培快繁体系建立等方面,而对于调控组培苗生根机理的研究较少。
基于此,以‘双优’葡萄枝条为试材,进行组织培养至生根阶段,筛选出较为合适的培养基后,通过正交设计以不同浓度的IBA、NAA和蔗糖进行处理,以探究其对‘双优’葡萄生根的作用,从而为该品种组培苗的繁育提供依据。
1 材料与方法
1.1 试验材料
‘双优’葡萄组培所用外植体为带芽茎段,于2021年7月在宁夏大学农科实训基地内获取。供试材料为两年生‘双优’葡萄,厂式架式,南北行向,株行距为1.0 m×3.0 m。
1.2 组培试验方法[13]
1.2.1 外植体消毒
选取生长健壮的‘双优’葡萄带芽茎段,带回实验室后用流水冲洗10 min。在超净工作台里用70%的乙醇溶液消毒45 s,之后用无菌水清洗3次并采用15%的H2O2溶液充分浸泡消毒6 min。取出后,再次用无菌水清洗4次。
1.2.2 启动培养
将消毒的外植体切去两端约5 mm后,接种至培养基中。启动培养的培养基为:MS+1.0 mg·L-16-BA+0.2 mg·L-1NAA+30 g·L-1蔗糖+7 g·L-1琼脂。培养条件为:日光照时间16 h,温度25 ℃,光照强度2500 Lx。
1.2.3 生根培养基筛选
当初代培养的带芽茎段芽长5 cm左右时,于超净工作台上将长势较为均一的萌发枝条切取并转接到生根培养基中,每瓶接1个茎段。生根培养基的筛选:采用0.3 mg·L-1IBA+0.3 mg·L-1NAA+25 g·L-1蔗糖+7.5 g·L-1琼脂,对1/2 B5、1/2 MS、1/2 WPM、B5、WPM及N6培养基进行筛选。培养条件为:日光照时间12 h,温度25 ℃,光照强度2500 Lx。各培养基类型设置10个样本,待15 d后统计各培养基中组培苗的生根情况,并计算平均生根数和生根率(不统计未生根的组培苗)。
1.2.4 生根培养
筛选出生根培养基后,采用不同浓度的IBA(0.1、0.3、0.5 mg·L-1)、蔗糖(15、25、35 g·L-1)和NAA(0.1、0.3、0.5 mg·L-1)进行处理。设计正交试验(表1),各组设置10个样本,各培养基琼脂浓度7.5 g·L-1。培养条件同1.2.3。
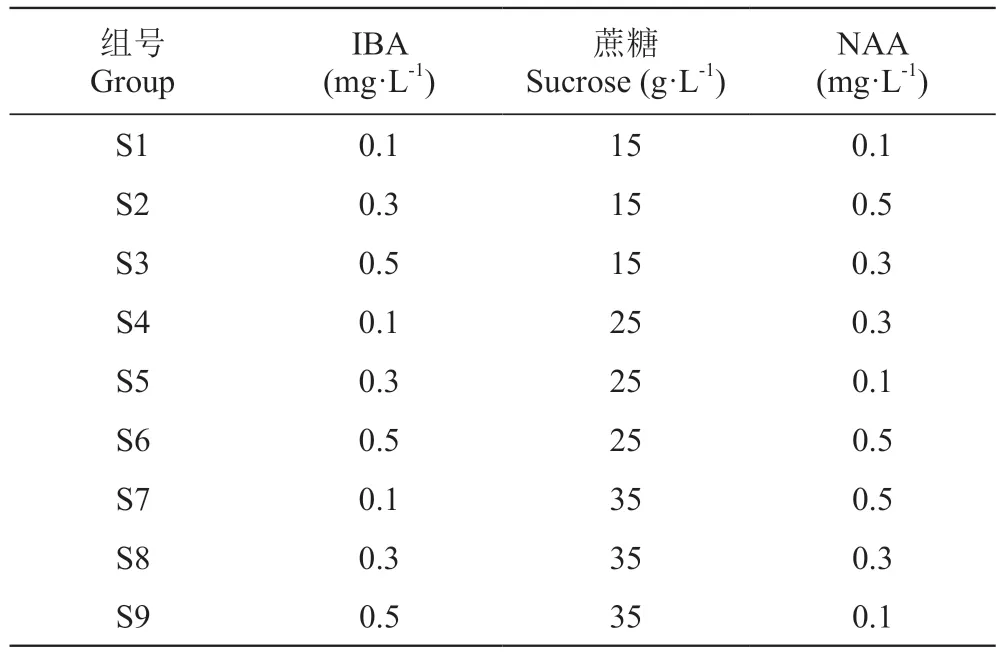
表1 正交试验设计Table 1 Orthogonal experimental design
1.2.5 样品获得及主根数目和根长测定
分别于生根处理后20、30、40 d观察统计各处理10个样本的主根数目,采用E-ruler软件测定主根长度(未生根的组培苗不做统计),并采集根系样品。
1.3 根系内源植物激素含量测定
委托上海酶联生物科技有限公司,采用酶联免疫吸附检测(ELISA)法测定根系中内源植物激素生长素(IAA)含量。
1.4 基因的实时定量PCR分析
1.4.1 总RNA提取及反转录
采用Tiangen RNA试剂盒提取根系总RNA,每个样品设3个重复,使用NanoDrop 2000测定RNA的提取质量,并结合琼脂糖凝胶电泳检测RNA的完整性。以总RNA为模板采用TaKara反转录试剂盒进行反转录。
1.4.2 qRT-PCR试验条件
采用CWBIO荧光定量试剂盒进行qRT-PCR试验,优化后的条件为95 ℃预变性10 min,95 ℃变性15 s,58 ℃退火30 s,40个循环,72 ℃延伸32 s。以VvEF基因(登录号:AF176496)作为内参,用2-△△CT算法计算基因相对表达量。各反应设置3个重复,运用 Primer 5.0设计引物,引物序列见表2。

表2 qRT-PCR基因引物序列Table 2 Primer sequences for qRT-PCR
1.5 数据统计与分析
运用Excel 2021统计数据,SPSS 20.0进行数据方差分析和LSD法显著性检验,采用Origin 2022软件绘图,图表中的数据表示为平均值±标准差。
2 结果与分析
2.1 生根培养基的筛选
由表3可知,1/2B5与1/2WPM培养基组生根率最高,达到了60%,且1/2B5培养基组平均生根条数最多,为3.4条;其次为B5与1/2MS培养基组,其生根率为40%,平均生根条数依次为3.0条和1.6条;而WPM培养基组生根率为30%,平均生根条数为1.67条。综合各培养基生根率和平均生根数情况,选择1/2B5培养基为生根培养基。

表3 不同培养基生根指标Table 3 Rooting index of different media
2.2 不同处理对‘双优’葡萄根系发生的影响
图1为正交试验设计下‘双优’葡萄生根处理20、30、40 d的主根数和主根长度情况。如图1所示,生根处理20 d时,S6的主根数目最多,为12.67条,显著高于其他培养基;而S5培养基主根长度最长,其次为S2,显著高于其他处理组。在生根处理30 d时,S6的主根数目显著高于其他各处理组,为18.5条,S5的主根长度显著高于其他组。当生根处理40 d时,S6处理组的主根数目为20条,显著高于其他各组,而此时S6主根长度显著高于其他组,其次为S9。在各处理中S1与S2的主根数和主根长度变化较为稳定。综上所述, ‘双优’葡萄组培苗主根数目和主根长度在各处理中均不同,表明不同的激素配比和碳源处理对其生根和根系伸长具有重要的作用。

图1 不同处理对‘双优’葡萄组培苗主根数和主根长度的影响Figure 1 Effects of different treatments on the number of taproots and taproot length of tissue culture seedlings of 'Shuangyou' grape
根据组培苗生根差异情况,分别选择S1、S2、S5、S6和S8进行后续内源生长素含量测定及其相关基因表达的研究。
2.3 不同处理对葡萄根系内源生长素含量的影响
表4表明,随着生根处理天数的增加,‘双优’葡萄根系中IAA含量总体呈上升趋势,在生根处理20 d时,S2与S8中IAA含量显著高于S1、S5和S6;生根处理30和40 d中,S1与S8显著高于其他处理组,且于生根处理40 d时达到最高值,分别为1.00、0.97 µg·g-1;其中,S6在生根处理30 d、40 d时生长素含量均低于其他处理。

表4 不同处理下‘双优’葡萄根系内源生长素(IAA)含量变化Table 4 Content changes of endogenous growth hormones in roots of 'Shuangyou' under different treatmentsµg·g-1
2.4 不同处理对葡萄根系中IAA合成与信号转导相关基因表达的影响
2.4.1 葡萄根系中IAA合成相关基因的表达
如图2所示,随着生根处理天数增加,IAA合成基因在不同处理中表现出不同的变化趋势。其中,VvTAA1基因相对表达量仅S1处理与生长素变化趋势一致,且于生根处理40 d时其表达量达到最高;VvYUCCA2表达量总体呈上升的趋势,与内源激素IAA含量变化趋势相近。值得注意的是,在生根处理20 d时,VvYUCCA2只在S2处理中表达,在生根处理30 d与40 d时,各处理间表达量存在显著差异,S6处理显著低于其他处理组。相较于VvTAA1与VvYUCCA2,各处理中VvYUCCA6与VvYUCCA8的相对表达量更高,且变化趋势不一。在生根处理20 d中,S2与S5处理中VvYUCCA6与VvYUCCA8的相对表达量显著高于其他组,而在生根30 d 时,S5与S6处理的表达量显著低于其他各组,在生根处理40 d时,S8中只有VvYUCCA6的相对表达量显著高于其他各组。
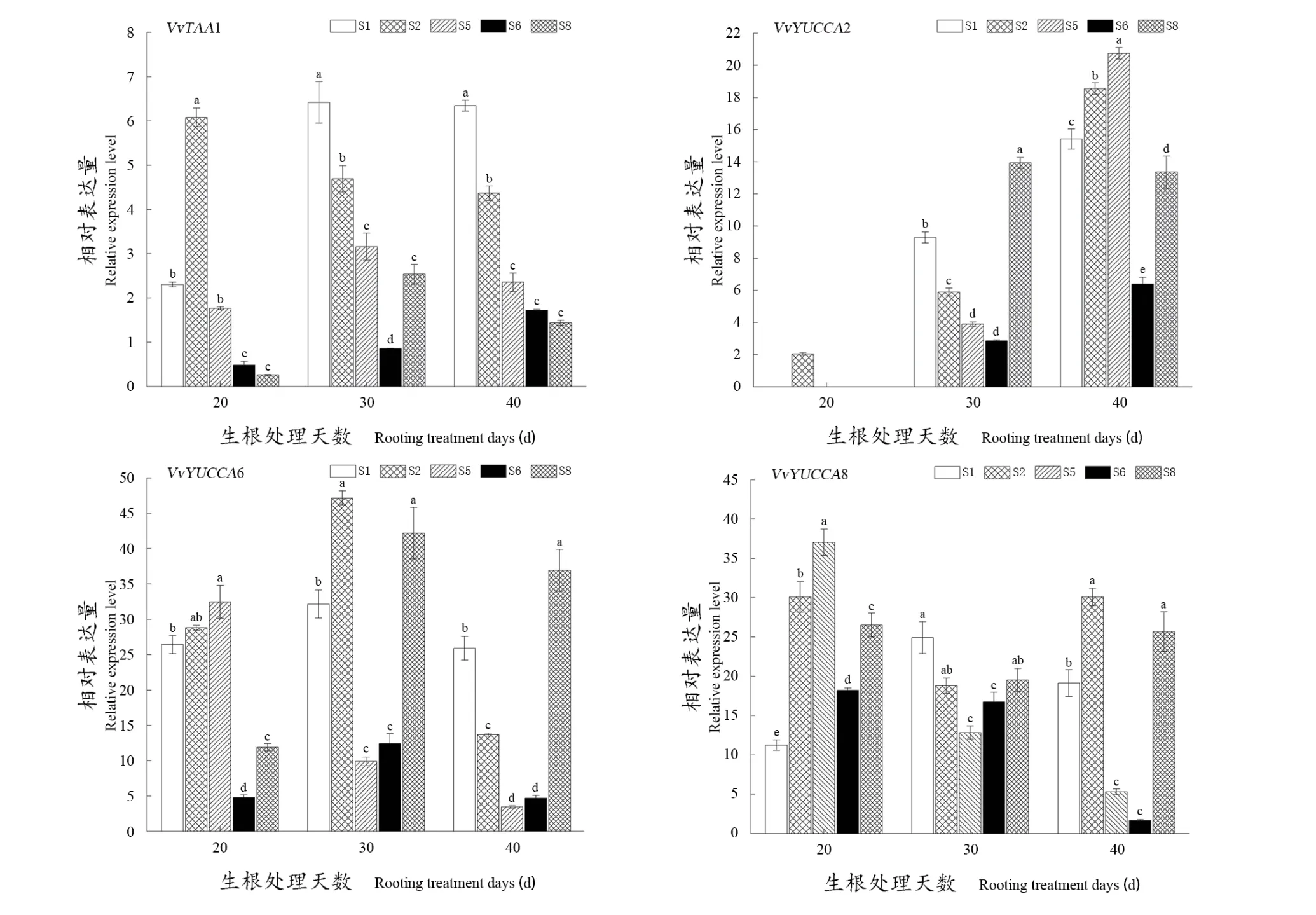
图2 不同处理下‘双优’葡萄根系中IAA合成途径相关基因的差异表达Figure 2 Differential expression of genes related to IAA synthesis pathway in roots of 'Shuangyou' grape under different treatments
2.4.2 葡萄根系中IAA信号转导相关基因的表达
如图3所示,IAA信号转导相关基因相对表达量差异较大,表现出不同的趋势。VvTIR1基因相对表达量除S6处理外,总体呈先上升后下降的趋势,其中S5处理组在生根处理30和40 d时表达量较高;而在生根处理40 d时,S5处理组相对表达量最高,显著高于其他各组。各处理中VvABP1表达量变化与VvTIR1较为相似,生根处理3个时期中,S5处理组中VvABP1基因相对表达量均较高,在生根处理20 d与340 d时显著高于其他处理组。VvABCB1各处理变化趋势差异较大,而VvAUX1除S6处理组外,均呈先上升后下降的趋势,其中在生根处理20 d时,VvABCB1和VvAUX1均在S5中表达量最高,显著高于其他处理组;在生根处理40 d时,VvABCB1在S6中表达量显著低于其他各组;而VvAUX1于生根处理30 d时在S1中达到最大值,显著高于其他各处理组,S6中其表达量显著低于其他各处理组。

图3 不同处理下‘双优’葡萄根系中IAA信号转导相关基因的差异表达Figure 3 Differential expression of genes related to IAA signal transduction in roots of 'Shuangyou' grape under different treatments
2.5 根系中IAA含量与其合成及信号转导基因相关性分析
如表5所示,在不同处理中,IAA含量与IAA合成和信号转导相关基因表达量具有一定的相关性。IAA合成基因VvYUCCA2在各处理中均与IAA含量存在显著或极显著相关性,表明其对IAA合成具有重要作用。在S1处理中VvTAA1和VvYUCCA2均与IAA含量呈现极显著相关性,表明低浓度生长素和碳源处理能促进其表达。IAA内运载体基因VvAUX1在S2和S5处理中均与IAA含量呈显著负相关,而在S8处理中达到极显著正相关,表明不同配比的生长素和碳源处理对其表达起到不同作用。
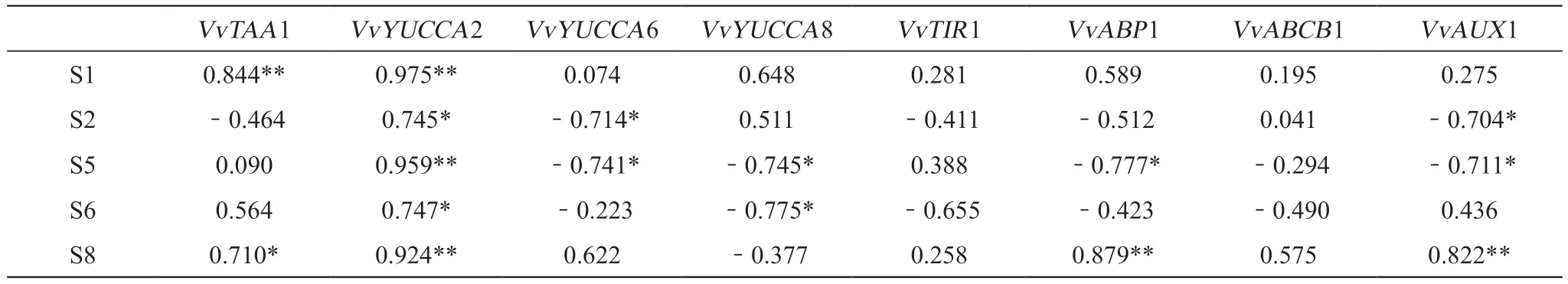
表5 ‘双优’葡萄根系中IAA含量与其合成和信号转导相关基因相对表达量的相关性分析Table 5 Correlation analysis between the content of IAA and the relative expression of genes related to IAA synthesis and signal transduction in the roots of 'Shuangyou' grapevine
3 讨论与结论
植物组织培养生根诱导过程中,低盐培养基有利于组培苗生根,可能原因为培养基中的氮源达到了有利于试管苗生根的水平[14]。本研究发现,低盐培养基1/2MS、1/2B5和1/2WPM相较于全培养基较为适合‘双优’葡萄生根,且生根率较佳,最终筛选出较为适合‘双优’葡萄生根的培养基类型为1/2B5,这与徐美隆等[8]在‘赤霞珠’葡萄组织培养中的研究结果基本一致,可能是1/2B5培养基的成分更为适合葡萄组培苗根系的生长发育。
植物激素是植物生长发育过程中所必需的物质,而植物生根与植物激素更是存在密切的联系,尤其生长素(IAA)尤为重要[15],其在植物主根、侧根及不定根的发育过程中起主导和中心作用[16],而其他植物激素多与生长素协同或拮抗来共同调控根系的发育[17]。本研究表明,随着生根处理天数增加,IAA含量呈上升趋势,与前人研究一致[18]。其中,S1与S8处理下IAA含量相对较高,而S6中始终较低且变化较稳定。同时,随着处理天数的增加,主根数的变化趋势与IAA相同,尤以S6处理的主根数最多,而主根长度表现出不同于IAA的趋势,在生根处理20 d和30 d时,S6的主根长度始终较短,但在生根处理40 d时表现出不同的趋势。推测可能是S6高浓度外源生长素处理,抑制了内源IAA的合成,从而影响生根,其有利于‘双优’葡萄主根数量的增加,同时,过高浓度的内源IAA不利于生根。
生长素是植物根系发育过程中的主要调控因子,以IPA途径为主要合成途径。该途径主要由色氨酸氨基转移酶(TAA1)和黄素单加氧酶(YUCCA)来完成[12,19],YUCCA是生长素合成途径中的关键限速酶,它的表达决定着生长素的含量,其过表达会引起植株死亡且不结实[20]。本研究表明,在生根处理过程中,VvYUCCA2的表达量总体呈上升趋势,与IAA的变化相近,这与张蒙[21]等的研究结果相似,表明VvYUCCA2的表达对‘双优’葡萄生根有利,而VvYUCCA6和VvYUCCA8表现出不同的表达趋势,可能在调控IAA合成中具有其他重要作用,值得注意的是VvYUCCA2在生根处理20 d时只在S2中表达,推测可能为不同处理影响其在生根前期的表达。通过相关性分析可知,VvYUCCA2在各处理中均与IAA合成存在显著或极显著相关性,VvYUCCA2的表达与IAA的合成存在着密切关系。与此同时,VvYUCCA6和VvYUCCA8在S5和S6中的表达与IAA含量呈显著负相关,这可能与生根处理20 d时VvYUCCA2基因不表达存在关系,二者在IAA合成中可能存在其它联系。生长素合成后在细胞内和细胞间流动,会引起生长素浓度的变化,影响生长素信号转导途径中生长素响应基因的表达,从而调控植物的生长发育[22-23]。本研究发现,生长素信号相关基因的表达趋势各不相同,与前人研究结果相似。相关性分析结果表明,VvABP1和VvAUX1与IAA含量存在一定的相关性,由此推测VvABP1与VvAUX1在‘双优’葡萄根系内源IAA合成及生根中具有重要的作用。同时,本研究表明在S6高浓度生长素处理下,会抑制IAA合成和信号相关基因的表达。
综上所述,生根是一个复杂的生理生化过程,生长素及其合成和代谢相关调控基因在其中发挥重要作用。本研究对‘双优’葡萄组织培养生根培养基类型进行筛选,1/2B5培养基较为适合‘双优’葡萄生根。内源生长素含量测定表明,IAA作为调控生根的主效因素,在‘双优’葡萄主根生长发育过程中具有重要作用。而其合成和信号相关基因的差异表达调控根系中IAA含量变化,进而影响生根。此外,本研究还发现,高浓度的外源生长素处理会抑制内源生长素的合成和信号相关基因的表达,从而降低内源IAA的含量。
