干腌牛肉加工过程中蛋白质结构变化
2023-05-25伏慧慧潘丽王庆玲
伏慧慧,潘丽,王庆玲
石河子大学食品学院(石河子 832000)
基于新疆得天独厚的资源优势,通过干腌肉制品加工技术,鲜牛脊肉经腌制、风干、发酵和成熟工艺制得极具新疆地域特色的干腌牛肉,其有独特的口感、丰富的营养特性且便于贮藏[1]。然而干腌牛肉并未形成工业化生产规模,流通量较少,因而鲜有人知。
干腌肉制品中蛋白质的组成、含量、生化特性的变化及稳定性均关系到产品的营养、风味、质构、色泽等多方面的品质特性。蛋白质结构变化是多种生化修饰的结果,可引起蛋白质溶解性、疏水性的变化,进而对产品的品质产生不同程度影响[2]。蛋白质分子中氢键、静电相互作用、疏水相互作用的变化是因腌制环境的改变,导致蛋白质空间构象改变,最终影响产品的功能特性。腌腊加工过程中因蛋白质结构的改变及水解、氧化使肉制品产生风味前体物质[3]。
试验以干腌牛肉加工过程中工艺点为研究对象,主要研究蛋白质结构、浊度、溶解度、表面疏水性及蛋白质分子相互作用力变化,从而明确蛋白质结构变化对干腌牛肉品质的影响,为进一步研究干腌牛肉产品品质提供理论参考,为新疆牛肉加工制品工业化提供新方向。
1 材料与方法
1.1 材料
新鲜褐牛脊肉(购自乌鲁木齐市农贸市场)。
磷酸氢二钠、磷酸二氢钠、氯化钾、三氯乙酸、氢氧化钠、溴酚蓝等(均为分析纯,购自天津市富宇精细化工有限公司)。
1.2 仪器与设备
Neofuge 15R高速冷冻离心机(力康发展有限公司);X7酶标仪(基因有限公司);IKA-T25高速分散器(上海巴玖实业有限公司);JSM-6490LV扫描电子显微镜(SEM,日本电子公司)。
1.3 试验方法
1.3.1 样品制备
工艺流程:鲜牛脊肉→腌制→风干→发酵→成熟→成品。
工艺条件:将鲜牛脊肉冷藏48 h(4 ℃),按样品总量6.0%称取食盐并均匀揉搓在样品表面,在8 ℃,Hr65%腌制35 d;牛脊肉洗后于10 ℃,Hr60%风干15 d;发酵80 d(20 ℃,Hr70%,40 d;24 ℃,Hr75%,40 d),于27 ℃、Hr70%成熟50 d即得成品。
分别采集原料(0 d)、腌制期(35 d)、风干期(50 d)、发酵期(130 d)、成熟期(180 d)5个阶段牛脊肉样品,置于-80 ℃冷藏备用。
1.3.2 肌浆蛋白和肌原纤维蛋白的提取
提取干腌牛肉中蛋白质参考冉丽丹等[4]的方法,并进行微调。肉样破碎处理,称取5.00 g样品放入离心管,匀浆混匀前加入10 mL磷酸盐缓冲液,并在4 ℃,以5 000 r/min离心15 min后,取清液,重复操作2次,即得肌浆蛋白溶液(SP)。向剩余沉淀中加入10 mL磷酸盐缓冲液,匀浆混匀、离心15 min(4 ℃,5 000 r/min),获得清液,此重复操作2次,即得肌原纤维蛋白溶液(MP),蛋白浓度通过双缩脲法测定。
1.3.3 干腌牛肉加工过程中微观结构的观察
将各工艺的蛋白溶液进行真空冷冻干燥,肉样破碎处理,称取5.00 g置于离心管中。采用SEM分析形态,在激发电压下(10 kV)获得图片。
1.3.4 干腌牛肉加工过程中表面疏水性的测定
表面疏水性(HFS)的测定参考刘娟[5]的方法。取1 mL样品蛋白稀释液,加入200 μL溴酚蓝,混匀后于摇床振荡5 min(200 r/min,25 ℃),离心(5 000 r/min,15 min),取上清液,测定吸光度(595 nm),用A表示。同时做空白对照(磷酸盐缓冲液),用A0表示。HFS(μg)按式(1)计算。
1.3.5 干腌牛肉加工过程中蛋白质分子相互作用力的测定
将不同加工时期干腌牛肉样品用组织捣碎机破碎,准确称取3.00 g,分别向肉样中加入20 mL如下试剂:S1,0.6 mol/L的KCl溶液;S2,20 mmol/L的Tris溶液,pH 8.0;S3,20 mmol/L Tris包含1% SDS,pH 8.0;S4,20 mmol/L Tris包含8 mol/L尿素、1% SDS,pH 8.0;S5,20 mmol/L Tris包含8 mol/L尿素、1% SDS、2%β-巯基乙醇、pH 8.0;S6,0.5 mol/L NaOH溶液。
在25 ℃以150 r/min摇床振摇2.5 h,其中振摇S5样品前,需在100 ℃水浴4 min。所有样品溶液振摇后离心(5 000 r/min,20 min),取5 mL上清液,加入20%三氯乙酸并使三氯乙酸终浓度为10%,样品在4 ℃避光静置18 h,将样品离心(5 000 r/min,20 min),经0.5 mol/L NaOH溶解沉淀,通过双缩脲法对其蛋白质含量进行定量,结果以每一个样品中蛋白含量所占S6的百分比表示[6]。
1.3.6 干腌牛肉加工过程中溶解度的测定
参考Xiong等[7]的方法对溶解度进行测定,稍作修改。将SP和MP蛋白稀释至1 mg/mL,低温离心(4℃,5 000 r/min,20 min),通过上清液测定蛋白质含量。蛋白质的氮溶指数(NSI)按式(2)计算。
1.3.7 干腌牛肉加工过程中浊度的测定
浊度的测定参考Xiong等[7]的方法,并作适当修改。将SP和MP蛋白稀释至1 mg/mL,试管中各取5 mL蛋白稀释液,分别于30,40,50,60和70 ℃的温度加热30 min,冷却至室温,测定吸光度(600 nm),同时做空白对照(磷酸盐缓冲液)。根据吸光度的大小计算浊度。
1.4 数据统计分析
结果用平均值±标准差表示,每个工艺点重复测定3次,显著水平P<0.05,数据ANOVA分析使用SPSS Statistics 25.0软件,图表绘制通过Origin 2021软件。
2 结果与讨论
2.1 干腌牛肉微观结构的变化
样品表面形态及网络结构的变化常用扫描电镜来观察。图1显示加工过程中干腌牛肉蛋白的微观结构,干腌牛肉蛋白质结构在各时期均发生不同程度的变化。肌浆蛋白原料时结构结实致密、间隙小且分布均匀,随着加工工序的开展,结构变得越来越疏松,间隙距离明显增加,逐渐呈现不规则的形状,结构破坏更加严重,同时,不断出现肌浆蛋白溶出物。肌原纤维蛋白原料形状规则、结构紧密、间隙小且分布均匀,在加工过程中逐渐呈现结构疏松,形状不规则、间隙变大且分布极不均匀。成品时结构松散,聚集块增加,间隙越来越大,且分布更加不均匀,形成众多大小不一的蛋白聚集物。造成这些现象的原因是蛋白质氧化、水解使蛋白质分子的天然构象发生变化,使蛋白质结构由原料紧实至成熟期空洞松散,因而蛋白质主要作用力形成也发生改变,三维网状结构的相互作用力减弱[8]。

图1 干腌牛肉加工过程中蛋白微观结构变化
2.2 干腌牛肉加工过程中表面疏水性的变化
蛋白质表面疏水基团分布及构象变化通常用蛋白质表面疏水性表示。由图2可知,加工过程中肌浆蛋白和肌原纤维蛋白的表面疏水性呈显著增加趋势(P<0.05)。从原料到成品时干腌牛肉的SP和MP分别增长49.13%和52.39%,这可能是因温度升高、蛋白氧化引起蛋白质二级和三级结构改变,使疏水性氨基酸暴露出来[9],同时,受到pH和食盐量增加影响,蛋白质的表面疏水性增强。这与孙为正[6]对广式腊肠的研究结果一致。
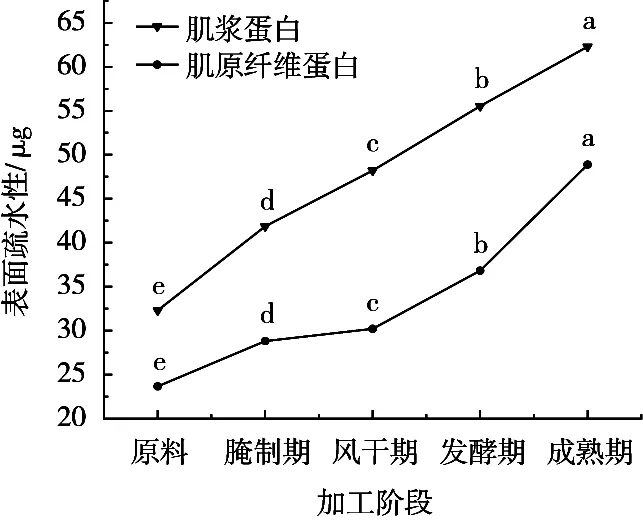
图2 干腌牛肉加工过程中表面疏水性的变化
2.3 干腌牛肉加工过程中蛋白质相互作用力
蛋白质分子相互作用形成三维网络结构影响着干腌牛肉产品的功能性质。图3显示加工过程中蛋白质分子相互作用力变化,S1从原料至腌制期增长3.96%,而后续加工至成熟期时降低14.55%。S2在加工过程中逐渐减少,降幅为12.31%。S1和S2降低是因蛋白质出现变性或降解,使其结构发生改变从而导致蛋白质作用力改变。S3呈现波动变化,从原料至腌制期的降幅为2.68%,至风干期增加8.90%,加工后期逐渐下降,到成品时降低21.81%。S4和S5呈先降后升的变化,从原料至腌制期分别下降11.20%和4.54%,而后逐渐上升,到成熟期增幅分别为39.37%和37.10%,试验结果与表面疏水性的增加一致,说明加工过程中蛋白质氧化程度不断加剧。在干腌牛肉由原料到成品时二硫键对蛋白质三维结构影响最大(即S5>S4>S3>S2>S1),该结果与孙为正[6]研究相吻合。干腌牛肉加工过程中蛋白质分子相互作用改变了蛋白质构象,使静电相互作用减弱,而氢键、疏水相互作用力和二硫键明显增强,蛋白质变性聚集对蛋白质结构形成和稳定性有重要影响。
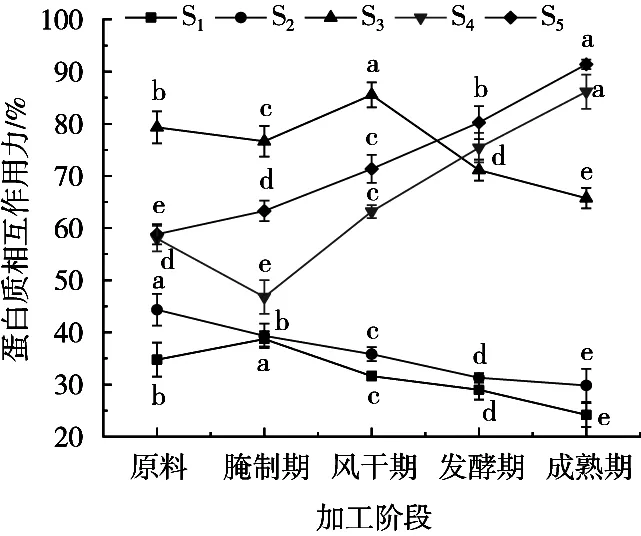
图3 干腌牛肉加工过程中蛋白质分子相互作用力变化
2.4 干腌牛肉加工过程中溶解度的变化
溶解性与氧化变性程度呈正相关。由图4可知,加工过程中干腌牛肉的SP和MP溶解度均呈显著降低的变化趋势(P<0.05),从原料至成熟期分别下降20.40%和25.56%,这主要因牛肉在腌制过程中疏水基团暴露及氧化使蛋白质交联产生聚集和沉淀,导致蛋白质溶解性下降,这与邹朝阳[10]研究结果变化趋势一致。
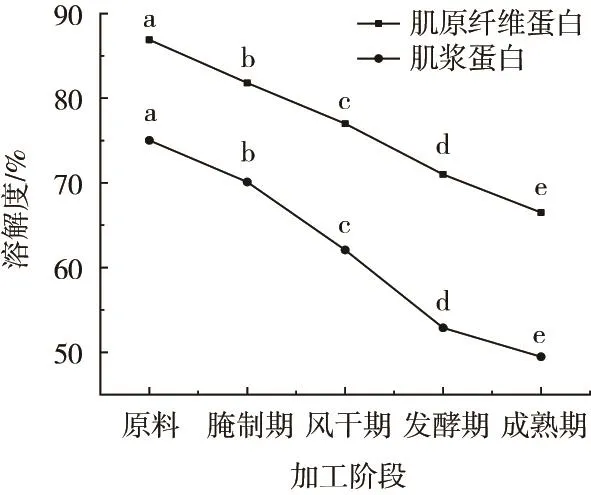
图4 干腌牛肉加工过程中蛋白质溶解性的变化
2.5 干腌牛肉加工过程中浊度的变化
蛋白质聚集情况可用浊度来反映。如图5所示,加工过程中肌浆蛋白和肌原纤维蛋白的浊度出现不同程度增长(P<0.05)。在同一温度梯度下,加热0.5 h后,肌浆蛋白浊度吸光度在成品时分别增长0.149,0.192,0.118,0.088和0.103,肌原纤维蛋白浊度吸光度在成品时分别增长0.063,0.073,0.077,0.112和0.128,其增长是因加热使蛋白分子相互作用形成大分子聚集体,使得光散射增加[11],同时,巯基基团改变使蛋白质出现变性聚集,使浊度增加。干腌牛肉加工过程中浊度值增加越大,表明蛋白质结构改变及变性形成更大的聚集体。
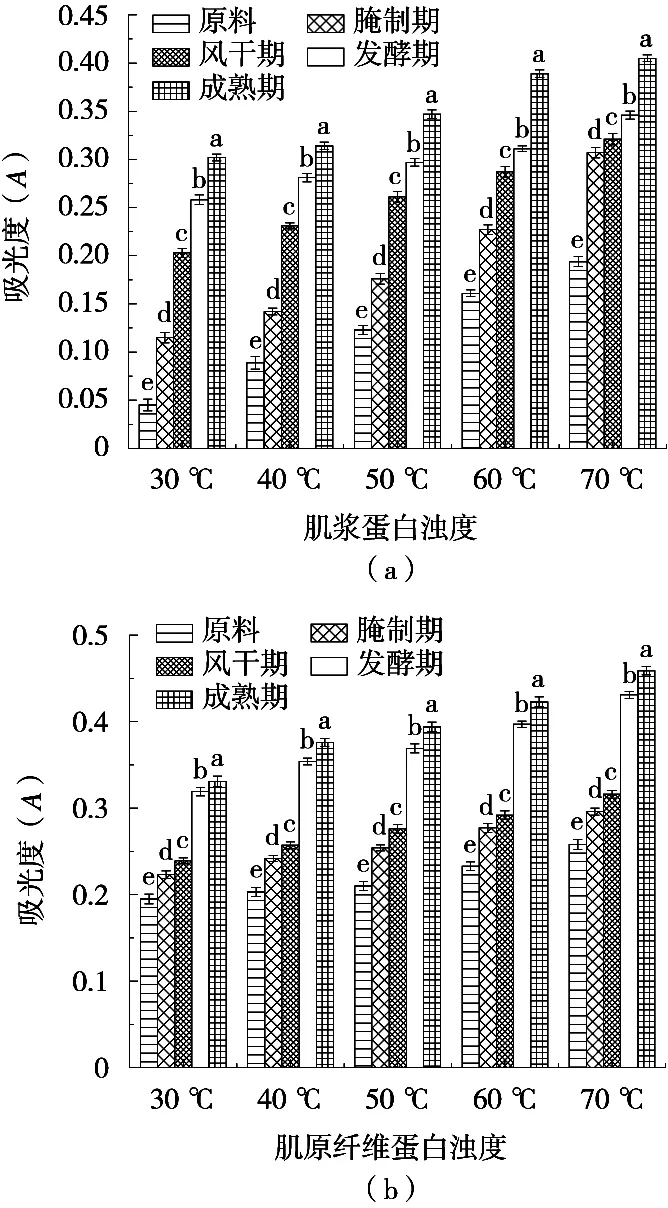
图5 干腌牛肉加工过程中蛋白质浊度的变化
3 结论
试验结果表明:干腌牛肉在加工过程中蛋白质结构由紧致变得松散无序;氢键、疏水相互作用力和二硫键作用下形成蛋白质聚集体,且各作用力显著增强。蛋白质表面疏水性分别增加49.13%和52.39%,而溶解性分别减少20.4%和25.56%。蛋白质内部结构的变化对干腌牛肉品质和营养特性产生不同程度影响,这为深入干腌牛肉品质机理的研究提供参考依据,有利于该产品工业化、规模化的发展进程。
