发展学生“变化观念”的项目式教学
2023-05-25付士林高玉龙
付士林 高玉龙
摘要:以“硫代硫酸钠的制备”为项目主题,开展高中化学“含硫物质转化”的复习教学。学生将项目拆分成子任务并转化为化学问题,完成了“硫代硫酸钠的性质预测及制备原理的探究”“硫代硫酸钠实验制备条件优化及产品分离提纯的探究”“硫代硫酸钠产品纯度的检测”等三个子项目。在解决问题的过程中构建含硫物质转化的“价-类”二维图,使学生掌握从物质结构、元素价态和物质类别等多个角度认识物质的方法,同时培养学生实验操作能力、分析问题及解决问题的能力。通过该项目的实施,尝试将核心知识、学科思维方法、学科核心素养等有效落实,形成适用于元素化合物复习教学的一般模式。
关键词:项目式教学;硫代硫酸钠;含硫物质转化;“价-类”二维图
文章编号:1008-0546(2023)08-0013-07 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2023.08.003
一、项目主题内容分析
元素化合物知识是高中化学的重要教学内容,该部分内容涵盖了元素化合物性质、物质结构与性质、化学反应速率与平衡原理应用、氧化还原反应规律、物质分离提纯的实验操作、物质的定性定量检验等知识,因此元素化合物知识的教学是培养学生学科知识融合能力的重要载体。然而,由于知识本身具有庞杂、琐碎的特点,使得该部分知识的教学多是孤立的、碎片式的,导致大部分學生采用机械记忆的学习方法,[1]难以实现知识的有效融合,不利于系统知识体系的建立。这样的教学模式和学习方法易导致学生对陌生物质和情境无从下手,远离《普通高中化学课程标准(2017年版2020年修订版)》中指出的对学生五大学科核心素养的培养初衷。[2]
目前,项目式教学被认为是最具核心素养融合发展效力的教学方式之一。[3]通过设置一个真实、具体的问题情景,让学生作为项目实施的主体参与其中,为促进项目的实施,主动提出驱动性任务,在完成项目任务的过程中,学生与教师不断对话,完成自我评价和检测,促进核心素养的融合发展。[4,5]项目式教学具有问题的真实性、任务的挑战性、活动的体验性等特点,在实施的过程中常要求学生融合运用学科内多模块知识与技能完成项目,[4]因此,项目式教学是发展学生学科知识融合能力的一种有效途径。
硫代硫酸钠,俗称大苏打、海波,应用非常广泛。现行教材中没有涉及硫代硫酸钠的性质及制备的有关知识,对于学生而言,硫代硫酸钠属于一种陌生物质。本文以硫代硫酸钠的制备作为切入点,进行含硫物质转化的复习教学,承载了化学热力学和动力学、物质结构与性质、物质制备实验操作、物质的定性定量检验等多个模块内容,将学生置身于真实的、有意义的问题情境中,学生通过完成项目而掌握项目所承载的学科知识和方法,培养学生融合学科内多模块知识分析和解决实际复杂问题的综合能力。本文有可能为高中元素化合物的复习教学建立可复制模板,在实际教学过程中,教师可根据学生思维发展程度,选择不同物质并设置不同驱动性任务进行项目式教学,使学生在已有知识的基础上,通过教师的引导,将零散的化学知识进行整合,形成系统的知识体系。从未知到已知,在真实的项目情景中,引导学生将实际工业生产问题转化为项目任务,再进一步拆解成化学问题,在问题解决的过程中建构元素化合物相互转化的模型框架,[6]培养学生分析和解决问题的能力,增强化学知识与生活实际的内在联系,获得学科核心素养的融合发展。
二、项目教学目标分析
(1)通过“硫代硫酸钠的制备”项目学习,使学生对含硫物质的相互转化形成系统的知识体系,强化认识物质性质的角度,体验模型构建的思路方法,培养宏观辨识与微观探析的学科核心素养。
(2)根据任务要求,设计并优化实验方案,从热力学和动力学角度分析实验方案的可行性,提高学生分析问题及解决问题的能力,培养变化观念与平衡思想的学科核心素养。
(3)根据实验方案进行实验探究,观察实验现象,并分析实验中出现的问题,培养科学探究与创新意识的学科核心素养。
(4)根据支持信息,分析外界条件对硫代硫酸钠制备的影响,提出优化制备及提纯方案,提高学生信息获取与加工的能力,培养证据推理与模型认知的学科核心素养。
(5)依托化学实验创设的真实情境,以连续性问题为驱动,外显分析思路,引导学生从定性认识层面逐渐上升到定量计算,进而提升学生分析和解决问题的能力。
三、项目任务及教学流程
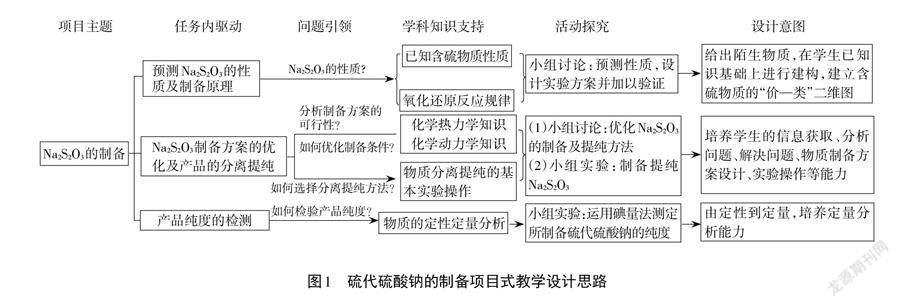
本文以“硫代硫酸钠的制备”为项目主题,由学生自主拆解成三个驱动性任务:(1)预测硫代硫酸钠的性质及制备原理;(2)硫代硫酸钠实验制备方案的优化及产品的分离提纯;(3)产品纯度的测定。具体对应关系如图1所示。
四、项目实施过程及学生学习成果
1.项目的提出与拆解
【项目背景】硫代硫酸钠是一种非常重要的化工原料,可作为定影剂应用于感光工业中,也可作为含氮氧化物尾气的中和剂、媒染剂、麦秆和毛绒物品的漂白剂,以及纸张漂白时的脱氯剂等,在医疗上还可用作氰化物中毒的解毒剂。在实验室中可以模拟工业生产硫代硫酸钠的过程,为了制备硫代硫酸钠,需要做哪些准备呢?
【项目拆解】对项目的拆解是项目式教学的关键。[7,8]通过思考与讨论,学生将主项目拆解成三个子项目,即“预测硫代硫酸钠的性质”“实验室制备硫代硫酸钠”及“产品纯度的测定”,通过小组间的相互补充及教师的引导最终确定预设项目任务,此过程使学生建立了陌生物质性质预测及制备方案设计的思维模型(图2)。
2.预测Na2S2O3的性质及制备原理
【教师】如何预测Na2S2O3的性质?
【学生】(1)结构决定性质,通过 Na2S2O3的结构预测其性质;(2)可以根据物质类别及硫元素的价态预测其性质。
【教师】物质结构和“价-类”二维模型是认识物质性质的重要方法。图3为 Na2S2O3的结构,根据价键理论分析 S2O 3(2)-的空间结构及化学键的类型。
【学生】S2O 3(2)-为四面体结构,结构中存在着 S-O σ键、S-O配位键、S-S配位键。
【教师】S2O 3(2)-是由硫原子取代 SO4(2)-结构中的一个 O 原子而形成的。 S2O 3(2)-和 SO4(2)-在性质上具有一定的相似性,例如:BaSO4和 BaS2O3均难溶于水。然而,Na2S2O3还存在着很多特性。根据已有知识,构建含硫物质相互转化的“价-类”二维图,从价态和类别两个角度预测硫代硫酸钠的性质。
【小组展示】学生完成并展示含硫物质相互转化的“价-类”二维图(图4)。经过小组讨论,学生得出如下观点:(1)从价态角度分析,Na2S2O3中 S 元素的化合价是+2价,处于硫元素的中间价态,应既具有氧化性,又具有还原性;(2)从类别角度分析,Na2S2O3属于盐,应具有盐的通性,可能会和某些物质发生复分解反应。
【教师】如何验证Na2S2O3的还原性?
【学生】利用KMnO4等氧化剂检验。
【教师】如何验证Na2S2O3既具有氧化性,又具有还原性呢?
资料卡:Na2S2O3遇酸会产生淡黄色沉淀,并逸出具有刺激性气味的气体。
【学生】Na2S2O3在酸性条件下会发生歧化反应,淡黄色沉淀为硫,逸出的气体可能是SO2。
【实验验证】各小组根据所提供的仪器及药品,实验验证Na2S2O3的氧化性及还原性,观察并记录实验现象。小组汇报结果详见表1。
【教师】Na2S2O3具有还原性,很多氧化性较弱的物质均能将其氧化,例如在碱性条件下,I2可以将 S2O 3(2)-氧化成 SO Na2S2O3的工业制备方法有很多,根据氧化还原反应的“价态归中”规律,可通过硫单质与 SO3(2)-反应制备 S2O 3(2)-(图4,虚线标注),反应原理如下:Na2SO3+ S = Na2S2O3。实际制备过程中,这一方案是否可行?如何对 Na2S2O3制备条件进行优化呢?这就是下一个任务需要解决的问题。
3. Na2S2O3制备方案的优化及产品的分离提纯
【教师】如何从理论上分析一个化学反应能否应用于工业生产?
【学生】应该从两个方面考虑:(1)反应发生的可能性,利用△G=△H - T △S 公式,若△G<0,则反应可以自发进行;(2)反应发生的现实性,即反应速率的快慢,活化能的大小。
【教师】分析制备方案的可行性,需从化学热力学和动力学两个方面考虑。根据所给信息(图5),[9-12]分析制备方案的可行性?
【小组展示】学生通过计算得出结论:△ H=-3.95 kJ·mol-1,△S=23 J·K-1·mol-1,因此任何温度下△G 均小于零,反应均具有自发进行的可能性。但动力学数据表明,反应的活化能较大,反应速率相对较慢。因此,若将该制备方案应用于实际生产,应采取一定措施,降低反应的活化能,提高反应速率。
【教师】运用化学热力学和动力学数据可分别分析上述反应进行的可能性和现实性。在工业上,常通过改变反应历程降低活化能的方法加快反应速率。[10-12]如何对实验方案进行优化,并根据方案设计制备Na2S2O3的实验装置图?
【小组展示】通过各小组间相互补充,确定优化实验方案及装置(图6)。
【教师】Na2S2O3是通过各物质间复杂反应生成,因此需明确各种物质间的转化过程,进而掌握反应的原理。结合已有知识,回答下列问题。
(1)问题1:SO2通入水溶液中后,会发生哪些反应,产物会以哪些形式存在?
(2)问题2:已知 H2SO3的电离平衡常数为:Ka1=1.54×10-2,Ka2=1.02×10-7;H2S 的电离平衡常数为:Ka1=9.1×10-8,Ka2=1.1×10-12。根据数据比较 H2SO3与 H2S 的酸性强弱关系,推测将 SO2通入Na2S 的溶液中会发生哪些反应?
(3)问题3:结合问题1、2,分析在锥形瓶中如何产生S,进而制备Na2S2O3。
【小组展示】通过小组讨论及相互补充,学生得出如下结论。
(1)针对问题1:SO2会和水发生反应生成 H2SO3, H2SO3是弱酸,不完全电离,在溶液中的存在形式有: H2SO3、HSO3(-)、SO
(2)针对问题2:H2SO3的酸性强于 H2S,将 SO2通入Na2S 的溶液中,生成的H2SO3会与S2-反应生成H2S。
(3)针对问题3:根据问题1、2可知,反应体系中有 H2SO3和 H2S 生成,二者可发生“价态归中”反应生成S,进而与 SO3(2)-反应制备 S2O
【教师】请分别写出锥形瓶内进行的每一步反应方程式,并分析该方案的优点。
【小组展示】各小组讨论优化制备方案的反应机理,结果见图7。通过 H2S 与 SO2反应产生的硫单质,能够与Na2SO3充分反应。同时,随着硫单质的不断消耗,逐步促进了可逆反应的正向进行。
【教師】在讨论过程中,学生充分考虑到了反应方向、反应速率、化学平衡移动、实验安全、尾气处理等在实验中应注意到的细节问题。实际工业生产中,很多条件会对物质制备产生影响,哪些因素会对 Na2S2O3的制备产生影响?通过什么方法进行研究呢?
【学生】溶液酸碱性及温度可能会对 Na2S2O3的制备产生影响,可以通过控制变量法依次优化制备条件。
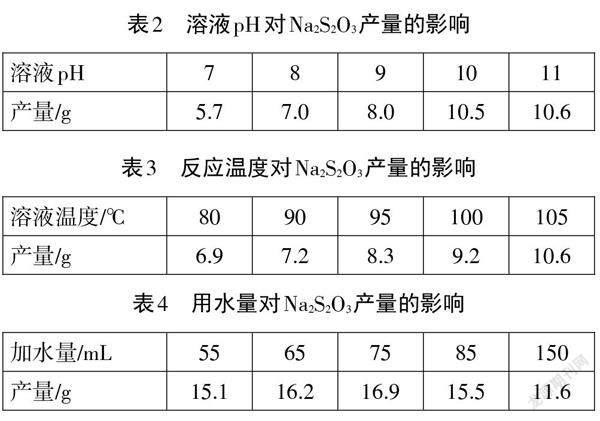
【教师】查阅资料发现,溶液的pH、反应温度及水的用量都会对 Na2S2O3的产量产生影响。结合所给信息(详见表2-表4),[9]选择最佳制备条件。
【学生】Na2S2O3产量随溶液pH升高而增加,但pH 高于10.0以后,产量变化不大,所以应保持溶液pH =10.0。类似的分析可知,反应温度为100℃,用水量为75 mL 时,Na2S2O3产率最大。
【教师】维持溶液pH =10.0,可以向反应体系中加入一些碱性物质,如果从NH3· H2O、NaOH 和Na2CO3中选择,选择哪种物质更好?
【学生】NH3· H2O易分解,同时从原料成本角度考虑应选择Na2CO3。
【教师】学生对信息进行了充分的提取和分析,选择了制备 Na2S2O3的最佳条件。在实际制备过程中可
能遇到以下困难,[9]如何解决?
(1)问题4:Na2CO3和 Na2S 同时溶解时间过长, Na2S易被空气氧化而使溶液变浑浊,加热溶解会促进 Na2S水解且有臭味溢出。[9]
(2)问题5:Na2SO3固体与浓硫酸反应生成Na2SO4附着在Na2SO3表面,减慢了SO2的生成速率,延长反应时间。[9]
(3)问题6:由于反应体系是密封的,通过溶液pH 判断反应进行程度很不方便,同时会导致 SO2气体溢出。[9]
【小组展示】通过小组充分讨论及相互补充,针对上述问题,学生提出如下解决方案:
(1)针对问题4:可调整试剂的加入顺序,在微热下先将Na2CO3溶于水,完全溶解后再将Na2S溶于Na2CO3溶液中,这样可以抑制Na2S 的水解,缩短溶解时间。
(2)针对问题5:可适当降低硫酸浓度,同时用少量水润湿Na2SO3固体。
(3)针对问题6:可通过观察反应体系的现象变化判断反应终点,反应溶液的颜色由无色→黄色→无色,继续通入SO2气体,当溶液中有淡黄色固体析出且附着在瓶壁上,反应一段时间仍不消失,说明溶液中的反应物已完全反应。
【教师】Na2S2O3产品中有哪些杂质?
【学生】通过上述方法制备的 Na2S2O3中可能含有的杂质为:Na2S、Na2SO3、Na2CO3,由于Na2S2O3具有还原性,易被氧化,因此产品中还可能有Na2SO4杂质。
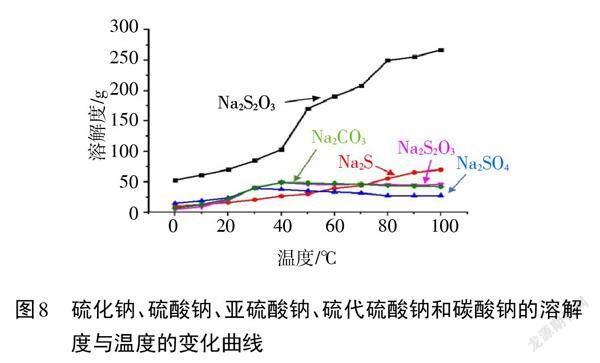
【教师】在制备过程中,选择合适的分离提纯方法是实验成功的关键。图8给出了Na2S2O3制备过程中,各种物质溶解度随温度变化的情况,结合所给信息,选择提纯Na2S2O3的具体方法。
【小组展示】对比五种物质溶解度随温度的变化情况,可以看出硫代硫酸钠的溶解度受温度影响较大,因此可采用重结晶的方法进行分离提纯。具体提纯方法为:蒸发浓缩至有晶膜出现,趁热过滤,冷却结晶,过滤,洗涤,干燥。
【教师】资料表明:Na2S2O3晶体析出时间过长,易造成滤液中 Na2S2O3的浪费而降低产量,[9]如何解决?
【学生】这可能和重结晶时溶剂的使用有关,根据 Na2S2O3的溶解性,可使用乙醇和水的混合溶液降低 Na2S2O3的溶解度,缩短结晶时间。
【教师】经过上述环节,学生已经掌握了Na2S2O3制备及提纯方法,下面通过实验来检验方案的可行性。
【任务完成-实验制备】各小组根据优化方案及分离提纯方法,实验制备Na2S2O3。实验过程由学生在实验室完成,实验过程中教师给予相应指导和提示,学生实验操作记录如下:连接实验装置并检查装置的气密性。称取3.3 g Na2CO3固体,微热溶解于盛有75 mL 蒸馏水的锥形瓶中,再加入15.0 g Na2S 固体并使其完全溶解。向圆底烧瓶中加入32.0 g Na2SO3固体并用少量水润湿,在分液漏斗中加入20 mL 70%硫酸。对锥形瓶内溶液加热并搅拌,维持反应温度为105℃。打开分液漏斗活塞,逐滴向 Na2SO3中滴入硫酸,产生的气体不断通入锥形瓶中,反应40 min后终止反应并冷却至室温。将锥形瓶内溶液蒸发浓缩,趁热过滤,向滤液中加入15 mL 乙醇,降温结晶,产品经过滤、洗涤、干燥后备用。不同小组原料用量不同,所得产品产量不同。
4.产品纯度的检验
【教师】Na2S2O3具有还原性,易被氧化,因此产品中可能有Na2SO4杂质。如何在杂质存在的情况下,检验产品是否为Na2S2O3?
【学生】Na2SO4的存在不影响 Na2S2O3的检验,因此依然可以通过加稀硫酸的方法检验。
【教师】如何定量检测Na2S2O3?
【小组展示】经过小组交流讨论,汇报结果详见表5。
【教师】两个方案都利用了Na2S2O3本身的特性,但方案2操作更加简捷、精确。
【小组讨论优化方案】结合所给实验仪器及药品,各小组经过充分分析讨论,最终确定Na2S2O3纯度的测定方案(表6)。
【实验测定】各小组根据实验方案,测定Na2S2O3的纯度(详见表6)。
5.学生课后访谈
【教师】通过该项目的学习,学生从陌生物质的性质预测开始,逐步实现了陌生物质的实验制备及定性/定量检验。为检验学生学习效果与项目预期目标的匹配程度,对学生进行了课后访谈。
【学生1】预测陌生物质性质时,应分别从物质结构、元素价态及物质类别等多个方面分析。结构决定性质,通过结构分析可了解物质中化学键类型,进而确定物质参与化学反应时的活性位点。根据物质所含元素價态可判断其氧化性和还原性,这有助于设计制备及储存方法。通过类别认识物质,则可以了解物质的通性。
【学生2】一个制备方案能否应用于工业生产,需要从化学热力学和动力学两个方面分析。
热力学数据(反应焓变和熵变)可用于判断反应进行的可能性,动力学数据(活化能和反应速率)可用于判断反应进行的现实性。
【学生3】实施实验之前,需要查阅相关资料精心设计实验方案,对实验过程中可能出现的各种问题充分预判并进行优化。在实验的过程中,要和小组同学进行充分讨论,这样可以相互补充,更有利于问题的解决。
【学生4】在定量分析的过程中,要注意细节,仔细观察实验现象,微小的失误就可能会导致实验的失败。当实验出现误差时,要根据原理对误差进行分析,了解误差出现的原因并在后续实验中加以纠正。
【教师】通过该项目的学习,学生掌握了从物质结构和“价-类”二维图等多方位预测物质性质的思路方法;学会了利用化学热力学及动力学数据设计及优化物质制备方案;团队协作能力、分析和解决问题的能力得到显著提高。同时,综合实验探究能力得到了提升,学生能够充分分析实验中存在的问题,寻找解决方案,有效地实现了项目预期发展目标。
五、项目式教学反思
本文以“硫代硫酸钠制备”为项目主题,运用学生已有含硫物质相互转化的知识解决了未知问题。物质制备实验是一个有机整体,它包含陌生物质性质预测、制备条件的调节和控制、实验制备、分离提纯、定性/定量检验等几个项目。在传统的高中化学元素化合物复习中,学生的思维大多停留在单点结构、多点结构水平上,知识关联与抽象拓展的思维能力不足。实施项目式教学,在具体项目任务的驱动下,学生作为项目实施的主体参与其中,激发了学生学习和思考的主动性,通过小组间的相互讨论及教师的问题引导,学生内在的思维过程得以外显,使学生知晓自己思维的障碍点,同时改变了高三复习课知识满堂灌的现象,充分发挥学生的主体性,调动学生学习的主动性。在解决问题的过程中,学生的信息提取、分析问题、解决问题、语言表达、逻辑推理和小组合作等能力都得到了充分的锻炼。综上所述,将项目式教学应用于元素化合物的复习过程,一定会促进学生核心素养的融合发展,彰显化学学科特色,进一步强化学科核心素养的落实。
参考文献
[1]姜言霞,王磊,支瑶.元素化合物知识的教学价值分析及教学策略研究[J].课程·教材·教法,2012(9):106-112.
[2]中华人民共和国教育部.普通高中化学课程标准(2017版2020年修订)[S].北京:人民教育出版社,2020.
[3]王磊,陳光巨.外显学科核心素养促进知识向能力和素养的转化—北京师范大学“新世纪”鲁科版高中化学新教材的特点[J].化学教育(中英文),2019,40(17):9-19.
[4] Joseph S K,Charlene M C,Carl F B.中小学科学教学—基于项目的教学方法与策略[M],王磊,等译.北京:高等教育出版社,2004.
[5]陈颖,王磊,徐敏,等.高中化学项目教学案例—探秘神奇的医用胶[J].化学教育(中英文),2018,39(19):8-14.
[6]亓玉成.建构主义学习理论在初中化学教学中的应用[J].天津教育,2021(6):131-132.
[7]窦卓,刘炯明,江合佩.基于真实情境促进核心素养发展的项目式实验教学—以“草酸亚铁的制备及检测”为例[J].福建基础教育研究,2021(11):118-121.
[8]宋立栋,刘翠,王磊,等.基于项目式教学的含硫物质转化复习教学设计与实施[J].化学教育(中英文),2019,40(19):37-40.
[9]陈英,赖红珍.实验室硫代硫酸钠的制备条件的研究及改进[J].绵阳师范学院学报,2015,34(2):121-126.
[10]韦汉昌,赵凤春.硫代硫酸钠合成反应动力学模型研究[J].广西广播电视大学学报,2004,15(2):57-58.
[11]邸万山,段树斌硫代硫酸钠合成条件的优化[J].辽宁化工,2003,32(2):54-55.
[12]张永,郑志胜,张成芳,液相中H2S与SO2反应动力学研究[J].高校化学工程学报,2003,17(3):279-283
