山姜素对博来霉素诱导的肺纤维化小鼠的作用及机制研究
2023-05-24刘宇王倩王荣丽
刘宇 王倩 王荣丽
肺纤维化(pulmonary fibrosis, PF)是一种常见的、可由多种病因引起的间质性肺疾病,主要表现为细胞外基质(extracelullar matrix, ECM)在肺组织中过度沉积,大量瘢痕组织形成,导致气体交换减少、进行性呼吸衰竭[1-2]。山姜素是一种广泛存在于自然界中的类黄酮化合物,具有抗氧化、抗炎、抗肿瘤、抗菌、抗病毒等多种作用[3-4],并且具有较低的全身毒性。研究表明黄酮类化合物抗肺纤维化的机制可能是通过抑制TGF-β1/Smad信号通路,进而抑制成纤维细胞转化为肌成纤维细胞,减少ECM的产生,改善肺纤维化和缓解肺纤维化的进展[5-7]。然而山姜素能否通过TGF-β1/Smad信号通路改善博来霉素诱导的PF仍有待研究。本研究应用博来霉素诱导的肺纤维化小鼠模型探讨山姜素的抗纤维化作用及其可能机制。
资料与方法
一、实验动物
SPF级雄性C57BL/6J小鼠60只,6~8周龄,体重18~20 g,购自斯贝福(北京)生物技术有限公司[SCXK(京)2019-0010],质量合格证号:110324220101630175,饲养于本院肿瘤科动物室。所有实验操作遵守实验室相关管理规定,经西南医科大学附属医院进行伦理审批(swmu20230018)。
二、主要试剂与仪器
博来霉素购自北京泰泽嘉业科技发展有限公司;山姜素购自成都埃法生物科技有限公司;羟脯氨酸试验盒购自南京建成生物工程研究所;HE染色试剂盒、Masson染色试剂盒购自武汉赛维尔生物科技有限公司;Smad2/3、Smad7购自Affinity Biosciences公司; TGF-β1、Col-1、E-Cad、α-SMA、ACTIN抗体购自武汉赛维尔生物科技有限公司;酶标仪购自Rayto;电泳仪购自武汉赛维尔生物科技有限公司;荧光定量PCR仪购自Bio-rad;正置荧光显微镜购自Nikon。
三、动物分组及造模
实验动物适应性喂养1周后随机分为对照组(NS)、模型组(BLM)、羧甲基纤维素钠组(CMC)、低剂量山姜素组(Alp25)、中剂量山姜素组(Alp50)、高剂量山姜素组(Alp100),每组10只。模型制备[8]:小鼠腹腔注射1%戊巴比妥(50mg/kg)麻醉后,BLM组、CMC组、Alp25、Alp50、Alp100组采取一次性气管内滴注博来霉素2U/kg建立肺纤维化模型,NS组一次性气管内滴注相应体积的生理盐水,滴注后立即将小鼠直立旋转,使液体均匀分布于肺内。从造模第二天开始给药,Alp25、Alp50、Alp100组分别腹腔注射25、50、100mg/kg山姜素溶液,NS组和BLM组腹腔注射给予相应体积的生理盐水,CMC组腹腔注射给予相应体积的0.5%羧甲基纤维素钠溶液,隔天给药1次,共10次。在第21天,麻醉处死小鼠,取双肺组织待检。
四、HE染色
取右肺上叶肺组织,置于4%多聚甲醛中固定、脱水、包埋、5μm切片。HE染色观察肺组织病理改变。
五、Masson染色
石蜡切片经Masson染色观察肺组织纤维化程度。
六、ELISA法检测HYP含量
取适量左肺下叶组织匀浆离心后取上清,采用碱水解法,按HYP试剂盒说明操作,取上清于550 nm处测定吸光度值,根据下列公式计算各组小鼠肺组织中HYP的含量。
羟脯氨酸含量(ug/mg)=(测定OD值-空白OD值)/(标准OD值-空白OD值)×标准品含量(5ug/mL)×[水解液总体积(mL)/组织湿重(mg)]
七、肺系数
剥离出小鼠肺组织,生理盐水清洗,滤纸拭干肺组织表面水分后称重,根据下列公式计算肺系数。
肺系数=[(肺脏重量(mg)/体重(g)]×100%
八、免疫组织化学法检测TGF-β1、Smad2/3、Smad7表达
将石蜡切片脱蜡至水,组织切片置于盛满抗原修复缓冲液的修复盒中于微波炉内进行抗原修复,3%双氧水溶液室温避光孵育阻断内源性过氧化物酶,滴加3%BSA封闭,滴加PBS按一定比例配好的一抗,4°C孵育过夜,滴加二抗,室温孵育50min,滴加DAB显色剂显色,复染、脱水、透明、封片。用数字化电子显微镜进行切片扫描,K-Viewer进行图像采集。
九、免疫荧光染色检测E-cad、α-SMA、Col-1表达
将石蜡切片脱蜡至水,组织切片进行抗原修复,BSA封闭,滴加配好的一抗,4°C孵育过夜,滴加二抗,室温孵育50min,DAPI复染细胞核,避光室温孵育10min,淬灭组织自发荧光,封片。切片扫描后,CaseViewer进行图像采集,使用Image J进行荧光定量分析。
十、Western Blot检测Smad2/3、Smad7蛋白表达
取左肺上叶组织,加入裂解液(使用前数分钟内加入蛋白酶抑制剂),研磨,离心,提取组织蛋白,制备分离胶和浓缩胶,上样后进行电泳,电泳至溴酚蓝里最底部大约1cm即可终止电泳,进行转膜,将PVDF膜放入脱脂牛奶中封闭,加入一抗,4℃孵育摇床过夜,洗膜,二抗孵育,洗膜,最后化学发光显影,进行凝胶图像分析。
十一、RT-PCR检测TGF-β1 mRNA表达
取适量左肺下叶组织,按试剂盒说明将RNA逆转录合成cDNA链,以cDNA为模板进行RT-PCR扩增,扩增条件为:95℃预变性30 s,95℃变性15 s,60℃退火30 s,共40个循环。GADPH上游引物序列:5′- CCTCGTCCCGTAGACAAAATG-3′,下游引物序列:5′- TGAGGTCAATGAAGGGGTCGT-3′;TGF-β1上游引物序列:5′- TAATGGTGGACCGCAACAAC-3′,下游引物序列:5′-CCACATGTTGCTCCACACTTGAT-3′。以GADPH为内参,计算TGF-β1 mRNA的相对表达量。
十二、统计学方法
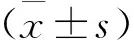
结 果
一、山姜素对肺纤维化小鼠体重及肺组织结构的影响
如(图1A)所示,NS组小鼠体重逐渐增加,而构建肺纤维化模型的小鼠,在0~4天期间,体重逐渐下降;4天后,BLM组和CMC组小鼠体重无明显上升;Alp50组在给予治疗后,小鼠的体重逐渐恢复;Alp25组和Alp100组小鼠体重恢复无Alp50组明显。从HE染色和Masson染色可以看出(图1C),NS组小鼠肺组织结构完整,无炎性细胞浸润,无明显胶原纤维增生;BLM组和CMC组小鼠肺组织结构损害明显,肺泡结构紊乱,炎性细胞大量浸润,大量蓝染胶原纤维沉积;与BLM组比较,Alp25、Alp50、Alp100组小鼠肺组织病变结构有所改善,炎性细胞浸润减少,蓝染胶原纤维沉积减少,而Alp50组改善最明显。并且与BLM组和CMC组相比,Alp50组小鼠肺系数降低更明显(图1B)。

图1 (A)小鼠体重变化;(B)肺组织肺系数;(C)肺组织HE染色和Masson染色
二、山姜素对肺纤维化小鼠肺组织Col-1表达的影响
如(图2)所示,与NS组相比,BLM组和CMC组小鼠肺组织中Col-1表达显著升高;与BLM组相比,Alp25、Alp50、Alp100组小鼠肺组织中Col-1表达降低,而Alp50组降低更显著。

图2 A:免疫荧光检测各组小鼠肺组织中Col-1表达(×100);B:各组小鼠肺组织中Col-1表达定量分析
三、山姜素对肺纤维化小鼠肺组织E-cad表达的影响
如(图3)所示,与NS组相比,BLM组和CMC组小鼠肺组织中E-cad表达降低;与BLM组相比,Alp50组小鼠肺组织中E-cad表达显著升高。

图3 A:免疫荧光检测各组小鼠肺组织中E-cad表达(×100);B:各组小鼠肺组织中E-cad表达定量分析
四、山姜素对肺纤维化小鼠肺组织α-SMA表达的影响
如(图4)所示,与NS组相比,BLM组和CMC组小鼠肺组织中α-SMA表达升高;与BLM组相比,Alp50组小鼠肺组织中α-SMA表达降低。
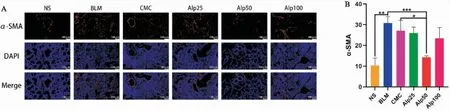
图4 A:免疫荧光检测各组小鼠肺组织中α-SMA表达(×100);B:各组小鼠肺组织中α-SMA表达定量分析
五、山姜素对肺纤维化小鼠肺组织Smad2/3和Smad7蛋白表达的影响
如(图5)所示,与NS组相比,BLM组和CMC组小鼠肺组织中Smad2/3蛋白表达升高,Smad7蛋白表达下降;与BLM组相比,Alp50组小鼠肺组织中Smad2/3蛋白表达降低,Smad7蛋白表达升高。

图5 A:Western Blot检测各组小鼠肺组织中Smad2/3和Smad7蛋白表达电泳图;B:各组小鼠肺组织中Smad2/3蛋白表达定量分析;C:各组小鼠肺组织中Smad7蛋白表达定量分析
六、山姜素对肺纤维化小鼠TGF-β1/Smad信号通路及肺组织HYP含量的影响
如(图6A、6B)所示,与NS组相比,BLM组和CMC组小鼠肺组织中Smad2/3、TGF-β1表达升高,Smad7表达降低;与BLM组相比,Alp50组小鼠肺组织中Smad2/3、TGF-β1表达降低,Smad7表达升高;而Alp25、Alp100组小鼠肺组织中TGF-β1/Smad信号通路相关蛋白及mRNA表达变化无Alp50组明显。如(图6C)所示,BLM组小鼠肺组织中的HYP含量高于NS组,而Alp50组小鼠肺组织中的HYP含量低于BLM组。
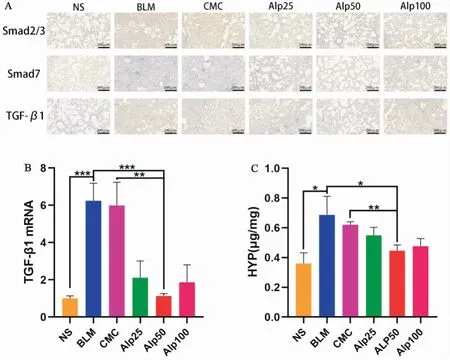
图6 (A)各组小鼠肺组织中Smad2/3、Smad7和TGF-β1免疫组化(×200);(B)各组小鼠肺组织中TGF-β1 mRNA表达;(C)各组小鼠肺组织中HYP含量
讨 论
肺纤维化是一种常见的肺间质疾病,其发病机制较为复杂,以炎症和广泛的纤维化为主要特征,在发病的过程中,肺泡上皮细胞因反复的损伤导致持续的炎症反应,进而发生纤维化[9]。肺纤维化患者治疗困难、预后差、死亡率高,并且肺纤维化患者肺癌发生率远高于普通人群[10]。目前针对肺纤维化尚无有效的根治方法,仅有吡非尼酮和尼达尼布被美国FDA批准用于特发性肺纤维化的治疗[11]。但是,吡非尼酮和尼达尼布长期服用所导致的肝功能损害和昂贵的费用,使大部分肺纤维化患者难以承受。因此,研发一种安全、高效、经济的抗肺纤维化药物是非常必要的。既往研究表明,山姜素能够改善葡聚糖硫酸钠诱导的结肠炎、改善四氯化碳诱导的肝纤维化、改善卵清蛋白诱导的过敏性哮喘、改善脂多糖联合吸烟诱导慢性阻塞性肺疾病[4,12-14],但是在肺纤维化治疗上未见相关报道。通过本研究发现山姜素可以有效地抑制TGF-β1/Smad信号通路的表达,对肺纤维化有一定的治疗作用。
既往研究表明,运用博来霉素诱导C57BL/6小鼠建立PF模型是目前应用最广泛的方法。一次性气管内滴注博来霉素后,PF发展分为三个阶段,1~7天为急性损伤及炎症期,7~14天为炎症向纤维化活跃过度,21天后为慢性纤维化阶段,21~28天为胶原沉积的高峰[8]。所以本实验采取一次性气管内滴注博来霉素构建PF模型,并运用此模型探究山姜素对PF的作用及可能机制。HYP是胶原蛋白的主要成分,在胶原蛋白的合成和稳定中起重要作用,能间接反应肺组织纤维化[15]。本研究结果显示,BLM组和CMC组小鼠肺组织结构损害严重,肺泡结构紊乱,炎性细胞大量浸润,大量蓝染胶原纤维沉积,HYP含量升高,肺系数增加。HE染色、Masson染色以及胶原沉积的结果提示本研究成功诱导小鼠肺纤维模型。经过山姜素治疗后,小鼠体重逐渐上升,小鼠肺组织结构有所改善,炎性细胞浸润减少,蓝染胶原纤维沉积减少,HYP含量下降,肺系数减少,表明治疗后小鼠整体生活质量得到了改善,小鼠的PF得到改善,其中中剂量组(Alp50)改善最明显。但本研究未消除山姜素对炎症的影响,难以区分山姜素是单纯抗纤维化作用还是依赖抗炎效应的抗纤维化作用。
在肺纤维化的发生发展中,过度的上皮-间充质转化(epithelial-mesenchymal transition,EMT)可能发挥着重要作用[16]。随着EMT的进展,上皮细胞标志物E-cad减少,间质细胞标志物α-SMA增加,成纤维细胞迅速增加,产生细胞外基质,促进肺纤维化的形成[9]。而肌成纤维细胞分泌的Col-1也可以促进肺纤维化[17]。既往研究表明,萝卜硫素治疗肺纤维化小鼠后,Col-1、α-SMA表达减少,E-cad表达增加[18]。在本研究中,通过免疫荧光的方法可以直观的看到各组小鼠的E-cad、α-SMA和Col-1的表达。本研究结果表明,经过山姜素治疗后的小鼠,Col-1和α-SMA的表达减少,E-cad的表达增加,山姜素能减少ECM的沉积,改善PF的进展,其中以Alp50组的改善最明显。但本研究未探究山姜素是否可通过调节炎症反应、氧化失衡等其他因素共同改善PF。
参与PF发生发展过程主要的信号通路有NF-κB、Nrf-2、PI3K/Akt/mTOR、JAK2/STAT3、TGF-β1/Smad、Wnt/β-catenin[19]。其中TGF-β1/Smad信号通路是肺纤维化发生发展的重要通路。研究表明,抑制TGF-β1/Smad信号通路的表达,能有效地抑制肺纤维化的进展,因此,TGF-β1/Smad信号通路也是治疗肺纤维化的潜在靶点[20-21]。研究表明,肺纤维化的发生与TGF-β1/Smad信号通路激活有关,TGF-β1的作用依赖于Smads蛋白,TGF-β1与TGF-β受体结合,激活Smad2、Smad3,被激活的Smad2/3复合物与胞浆内的Smad4结合形成co-Smads,以调节基因表达;抑制性Smad7能与受体结合,进而抑制Smad2、Smad3的激活[22]。因此,TGF-β1的下调被认为是终止纤维化过程的关键。研究表明TGF-β1可以促进成纤维细胞的聚集、激活和增殖并导致过多的ECM沉积和胶原蛋白生成,还可以刺激促炎性和促纤维化细胞因子的表达[23-24]。既往研究表明,芍药苷治疗肺纤维化小鼠后,Smad2/3表达降低、Smad7表达升高[25]。研究结果表明,经过山姜素治疗后的小鼠,Smad2/3、TGF-β1表达降低,Smad7表达升高,而Alp50组的作用比Alp25组和Alp100组更加明显。因此,山姜素可以抑制TGF-β1/Smad信号通路相关蛋白的表达,进而改善肺纤维化的进展,其中Alp50组改善最明显。但该研究未探究山姜素是否可通过其他信号通路改善PF。
以上研究结果显示,山姜素可以通过阻止EMT,抑制TGF-β1/Smad信号通路的表达,改善肺纤维化的进展,达到抑制肺纤维化的作用。本研究为治疗肺纤维化提供了新的理论依据。
