运动皮质刺激治疗神经病理性疼痛研究进展*
2023-05-24马奕然庞淼一王怡然周一辰王培培
马奕然 庞淼一 王怡然 周一辰 王培培 李 纤 杨 菲△
(1 首都医科大学基础医学院,北京 100069;2 首都医科大学基础医学院神经生物学系,北京 100069;3 首都医科大学基础医学院生物化学与分子生物学系,北京 100069)
疼痛是一种与实际或潜在组织损伤相关的不愉快的感觉和情绪、情感体验,或与此相似的经历[1]。根据疼痛持续时间的长短可以把疼痛分为急性疼痛和慢性疼痛。根据目前国际疼痛学会最新的规定,疼痛持续3 个月以上就可以被认定为慢性疼痛。慢性疼痛不仅严重影响了病人及其家庭的工作及生活,也对病人的社会活动造成不良影响。
初级运动皮质参与控制自主运动行为,而大脑皮质内记录和功能神经影像的研究结果提示,痛觉也能够引起人类初级运动皮质的反应[2]。在20 世纪90 年代初期,运动皮质刺激开始被用于治疗慢性神经病理性疼痛,其主要方法是通过刺激与病人疼痛区域相对应的运动皮质区域来减轻疼痛。研究者认为这些电脉冲可以通过抑制由脊髓丘脑通路传受入阻所引起的丘脑过度兴奋来缓解疼痛[3]。1991年,Tsubokawa 等[4]发展了一种相对简单而安全的技术—硬膜外运动皮质刺激(epidural motor cortex stimulation, eMCS),并在12 名丘脑或丘脑上病变的病人中进行了试验,其中8 名脑卒中后中枢性疼痛病人的症状得到了缓解。随后,eMCS 技术迅速被全世界的神经外科医师用于治疗各类神经病理性疼痛[5,6]。伴随着技术的不断优化,科学家又逐渐研发了无创的皮质刺激技术,包括经颅直流电刺激(transcranial direct current stimulation, tDCS) 及重复经颅磁刺激 (transcranial magnetic repetitive stimulation, rTMS),以上技术均使用低于动作电位阈值的刺激强度来刺激运动皮质,可达到缓解疼痛的效果[7]。
越来越多的证据表明,在外周和中枢性疼痛中,丘脑发挥着重要的作用[8]。外周伤害性感觉传入中枢神经系统,经脊髓丘脑束上升,投射到皮质丘脑系统的丘脑内外侧核,激活躯体感觉皮质、前扣带回(anterior cingulate cortex, ACC)、岛叶和前额叶皮质[9]。最新研究表明,背内侧丘脑通路连接从初级运动皮质(primary motor cortex, M1)到伏隔核的奖励回路,刺激该通路可以抑制神经病理性疼痛引起的负面情绪和相关的行为学表现,这可能成为运动皮质刺激技术缓解疼痛的通路之一[10]。此外,还有研究表明运动皮质刺激可以通过抑制丘脑活动,间接激活中脑导水管周围灰质 (periaqueductal gray matter, PAG),从而激活疼痛抑制通路[11]。目前已有文献描述了慢性神经病理性疼痛与皮质内抑制缺陷的关系,这些缺陷也被认为可以通过运动皮质刺激治疗恢复[12]。另一种作用机制认为运动皮质刺激可以诱导内源性阿片类物质的分泌。一项试验使用放射性物质标记二丙诺啡后,通过正电子发射计算机断层显像 (positron emission computed tomography,PET) 成像发现,经运动皮质刺激7 个月后放射性信号降低,这说明运动皮质刺激增加了内源性阿片类物质释放及其与阿片受体结合。因此病人神经递质的长期变化,内源性阿片类物质的潜在分泌,阿片受体的数量都与运动皮质刺激的临床疗效呈正相关[13]。本文将从作用机制、临床效果两方面对运动皮质刺激镇痛加以具体介绍。
一、硬膜外运动皮质刺激 (eMCS)
eMCS 是一种早期的神经外科运动皮质刺激技术,时至今日已经在很大程度上取代了丘脑刺激。eMCS 的镇痛机制很多,包括通过激活丘脑改变多个皮质和皮质下区域活动,诱导内源性阿片类物质的释放增加,激活脊髓的下行抑制等[14]。根据临床观察发现eMCS 的疗效可持续10 年,并可通过在术前使用rTMS 技术对疗效进行预测。
虽然eMCS 的刺激装置和定位技术有了很大发展,但手术过程仍与30 年前Tsubokawa 所描述的大致相似[6]。基本过程包括麻醉开颅后,将刺激电极放置在疼痛对侧的运动皮质上,平行或垂直于中央沟并穿过中央沟。然后,电极导线在皮肤下穿至颈部外侧,并在锁骨下或腹部外侧连接到接收器。不同的电极位置会造成不同的临床效果[6,15],例如刺激电极被放置在皮质外侧表面,可用于治疗上肢或面部疼痛;刺激电极被放置在皮质内侧表面,则适用于下肢疼痛的治疗。临床经验发现相比将刺激电极放置在硬膜下,刺激电极放置在硬膜外不仅可以缩短手术时间,而且可以避免硬膜下刺激导致癫痫发作并降低颅内血肿的风险[16]。同时现有证据表明电极放置在硬膜外或硬膜下并不会造成疗效的不同。
1.eMCS 的作用机制
在临床试验中,eMCS 作用机制的早期假说是将eMCS 和运动皮质内的纤维连接或中间神经元的激活联系起来[15,16]。丘脑被激活后,包括运动前皮质、前额皮质和眶额皮质、扣带回周围、基底节和PAG在内的许多皮质和皮质下区域的神经活动会发生变化[17],例如PAG 在丘脑被激活后触发脊髓的下行抑制。这些区域在eMCS 治疗停止后仍然可以保持数个小时的激活状态,这很好地解释了eMCS 治疗后临床效应的持续现象[18]。通过PET 扫描观察神经递质的长期变化,研究人员发现在相同的皮质和皮质下区域,内源性阿片类物质和局部脑的血流量增加,提示这两种机制可能与eMCS 的疗效有关[13]。
在动物实验中,发现eMCS 治疗可以持续减轻啮齿动物的神经病理性的超敏反应[19]和强直性疼痛[20]。在大多数的动物研究中发现丘脑、扣带回、纹状体、PAG 和脊髓背角的功能发生改变[21]。类似于人类研究中发现的下行抑制和丘脑变化,在啮齿类动物和猫中也观察到了eMCS 刺激后引发脊髓下行抑制的现象,表现为脊髓背角的活动性降低以及ACC 和PAG 中c-fos 蛋白增多[22]。此外神经病理性疼痛可能与丘脑的功能异常和低代谢状态有关,eMCS 治疗不仅可以减少丘脑的异常活动,还可以增加丘脑的代谢[11],这可能是由丘脑底部未定带的GABA 能神经元通路驱动的[23]。啮齿类动物在受到eMCS 治疗后也会出现进行性的变化,如丘脑的激活和c-Fos 表达的变化[24]。最后在啮齿类动物和猫的研究中发现,eMCS 的作用机制可能涉及不同的神经递质和受体,包括内源性阿片类物质[25]、儿茶酚胺、5-羟色胺及其脊髓的5-HT1A受体[22]、多巴胺D2 受体[26]和大麻素CB2 受体[25]等。但是在PAG 中GABA 能神经元活性是否增加[27],同一区域谷氨酸信号是否参与传导[28],蓝斑在eMCS 期间是否激活等仍然存在着争议,有待进一步的研究探索[27]。
2.eMCS 的临床效果
多项研究指出eMCS 在耐药的中枢或周围神经病理性疼痛病人中可以发挥镇痛作用,平均成功率为45%~50%[21]。Rasche 等[29]和André-Obadia 等[30]筛选出有疗效的病人(> 50%疼痛减轻或 > 30%疼痛减轻加上药物使用减少)共37 例,在长达10 年的随访后发现,其中47%~50%的病人结果较好。因为存在随着时间的推移疗效有所下降的情况,所以研究人员推测eMCS 治疗对于大约一半的耐药神经病理性疼痛病人有明显的镇痛作用[30]。
由于eMCS 治疗的病人常表现出延迟效应和波动效应,因此在随机试验中的效果需要仔细分析。例如有研究显示,近20%的病人在第1 个月的治疗没有效果,但在1 年后疼痛有所缓解。还有一些经视觉模拟评分法(visual analogue scale, VAS)评分评估治疗后疼痛变化不显著的病人,在注意到电池耗尽后表示疼痛增强[31],这也表明单纯用VAS 评分评估神经调控对疼痛的缓解作用主观性较强,缺乏信度。
在进行eMCS 之前观察病人对rTMS 的反应是临床上能够有效预测eMCS 治疗效果的唯一方法,准确率高达90%。随着随访时间的延长,对病人2年及以上预测的准确率仍能接近70%[32]。由于在早期的大部分报道中,多数病人在手术前没有考虑通过rTMS 进行疗效预测,因此如果通过术前rTMS评估来筛选病人,eMCS 治疗的临床效果可能会出现显著提高。
二、重复经颅磁刺激 (rTMS)
rTMS 依据法拉第电磁感应原理,当线圈内经过瞬时电流能够产生磁场,该磁场可以通过电磁感应在大脑中产生电流。这种次级电流的强度在不会使病人感到疼痛的同时,能够有效刺激大脑的运动皮质。其中“八字形”线圈能够最大程度确保皮质刺激的精度,在临床中的应用也最为广泛[33]。rTMS 在临床上既可以用来预测植入神经刺激的疗效,也可以单独用于治疗神经病理性疼痛。已有的研究证明运动皮质高频rTMS 治疗对神经病理性疼痛有明显的镇痛作用,而对广泛性疼痛及纤维肌痛的镇痛效果则不太理想。到目前为止,针对背外侧额叶皮质的rTMS 是否具有疗效仍缺乏研究支撑,受关注较多且被认为有效的是后盖岛叶皮质刺激。
1.rTMS 的作用机制
rTMS技术可以使大脑皮质神经元发生去极化,从而导致线圈下方的皮质在短时间内产生同步的神经元放电。当使用阈上脉冲时,可以直接或经突触诱导皮质脊髓束的神经元发生去极化,进而使受刺激的皮质区域支配的肌肉激活。而rTMS 用于缓解疼痛的刺激强度低于激活皮质神经元所需的刺激阈值[34],因此最初研究人员认为阈下rTMS 可能通过改变皮质神经元突触的长时程增强或长时程抑制作用[35],或诱导皮质内抑制达到缓解疼痛的效果。但这一结论未能在后续研究中得到重复,并且药理实验表明,药物阻断rTMS 的作用时不会改变皮质兴奋性,且GABA 能药物诱发皮质内抑制后对神经病理性疼痛没有改善作用,这些结果提示皮质兴奋性的改变可能与镇痛作用无关[36]。研究者还发现皮质内抑制对截肢后疼痛和脊髓损伤后疼痛也没有缓解效果[37]。因此目前的结论提示rTMS 的镇痛机制可能与运动皮质兴奋性无关。
目前得到支持较多的理论是,rTMS 通过与局部和远处的皮质产生震荡相互作用,从而起到了缓解疼痛的效果。阈下rTMS 与eMCS 通过震荡作用激活的脑区有许多重叠的部分[17],包括ACC、岛盖、背外侧前额叶皮质、纹状体和脑干。因果模型研究表明,在人类和灵长类动物的中枢性神经病理性疼痛模型中,rTMS 可以诱导这些脑区激活[38]。对大鼠和小鼠施加rTMS 还可以诱导丘脑、ACC 等脑区皮质运动束的神经元表达c-fos,这一发现可以协助预测rTMS 的临床疗效[39]。
另一种猜测是,rTMS 通过调节内源性阿片类物质的水平而起到镇痛效果。研究表明rTMS 能够诱导血清β-内啡肽水平升高,并增加阿片类物质与其受体的结合[40],给予纳洛酮能够阻断rTMS 的镇痛作用。啮齿类动物及人的PET 成像都发现,rTMS 可以刺激纹状体分泌多巴胺。但由于rTMS诱导的多巴胺分泌水平在短暂升高后迅速恢复到基线,因此可能由于持续时间较短,无法达到相应的临床效果,故而研究人员推测多巴胺释放可能通过与其他阿片类物质的协同作用而产生间接效应。此外两项人类研究间接支持谷氨酸NMDA 受体可能参与rTMS 镇痛[41],不过在大鼠模型中这一假说未得到证实。最后在临床应用中rTMS 对触诱发痛病人的治疗效果优于对自发痛病人的治疗效果[42]。
2.rTMS 的临床效果
rTMS 已被用于多种类型神经病理性疼痛的治疗,临床上获得的疗效也不尽相同。例如,在病程第1 天和第30 天给予慢性偏头痛病人rTMS 治疗,比较刺激组和假刺激组后发现,刺激组的疼痛评分和偏头痛发作的频率都明显降低[43]。在另外一项同时关注患有不同中枢和外周神经病理性疼痛病人的研究中发现,得到rTMS 治疗的病人主观疼痛相比于治疗前得到显著缓解[44],这种即时缓解效果在另一项评估创伤后继发周围神经病变的研究中也得到了验证。在该研究报告中,与假刺激组相比,10 名刺激组病人中,70%的病人刺激后疼痛显著缓解[45]。研究还指出rTMS 结合运动治疗可以增强镇痛效果[37]。
由此可见,许多研究都表明运动皮质的rTMS可以在短期或中期缓解慢性神经病理性疼痛[46]。目前至少有6 项大型可靠的试验(单/双盲,> 20 名试验组病人)研究了运动皮质rTMS 对慢性神经病理性疼痛的影响,除一项研究外,其余结果均报告rTMS 有镇痛作用[47]。其中一项研究进一步的报告了运动皮质rTMS 对帕金森相关疼痛缓解效果显著[48],而另一项在纤维肌痛病人中的研究结果呈阴性[49]。尽管目前研究结果的可信度仍然受到方法学缺陷的限制,但美国一份有影响力的报告得出结论,与大多数已批准的神经病理性疼痛药物相比,rTMS 的不良反应更少,对于已经使用过其他慢性疼痛治疗方法且效果不好的病人来说,可以尝试使用rTMS 治疗。由于rTMS 具有优先作用于痛阈异常而非生理疼痛的特性,其对于神经病理性疼痛的疗效较短,如何确保其长期的疗效仍有待进一步探索。
三、经颅直流电刺激 (tDCS)
20 世纪下半叶的研究表明,对大脑皮质施加直流电刺激可以影响啮齿类动物和人类的神经元兴奋性。放置在皮肤表面的电极发出阳极刺激时可以激活神经元放电,皮质兴奋性升高,阴极刺激则会降低皮质兴奋性[50]。因此,tDCS 被认为是一种安全、无痛、可逆且具有一定特异性的调节大脑兴奋性的技术方法,可以模拟运动皮质激活以达到镇痛作用。传统的tDCS 技术是将电极放置在病人皮肤表面(4~30 cm2)并连接到刺激器,传递1~2 mA 的直流电流[48]。tDCS 通过改变皮质神经元的静息膜电位来改变相应区域的兴奋性,以此影响病人疼痛的认知、情绪和痛觉感受。相对于rTMS 而言,tDCS的成本更低,安全性更高,且具有居家治疗的可能性,因此更适合用于长期治疗。
1.tDCS 的作用机制
tDCS 能够改变运动皮质的兴奋性,并且能够引起全身代谢改变。研究认为tDCS 的镇痛机制主要与全身代谢的改变相关[51,52]。临床研究表明病人在接受tDCS 治疗期间,岛叶及ACC 区域的GABA、谷氨酸及内源性阿片类物质分泌增加。研究人员预先给予神经病理性疼痛小鼠GABA 能药物、谷氨酸能等药物改变小鼠代谢水平后再施加tDCS 刺激,并用vonFrey 法评估其痛阈。结果发现施加tDCS可以提高小鼠痛阈,接受药物预处理后,能够影响tDCS 的镇痛效果,因此研究人员认为这些神经递质参与了tDCS 的镇痛机制[53]。实验已经表明,tDCS 的阳极和阴极刺激都能够对谷氨酸突触产生影响[54],阴极刺激还能够改变GABA 能神经递质的表达水平[55]。除代谢水平变化外,tDCS 疗效还受各种可调节参数的影响,包括电极的极性、数量、大小和位置、刺激强度、刺激持续时间等,这些参数对疗效的具体影响仍有待探索。
与其他形式的神经刺激一样,tDCS 在啮齿类动物的神经病理性疼痛模型中被验证能够减少脊髓伤害性反射[56]。在临床试验中 tDCS 通常不能减少健康受试者的生理性疼痛[57],但能够减少由辣椒素诱发的病理性疼痛(痛觉超敏、痛觉过敏)[58],这一结果表明tDCS 可能作用于病理性疼痛的通路,而非生理性疼痛[59],这与rTMS 的作用机制类似。在这些前提下,健康受试者的试验研究应该更多采用痛觉过敏(辣椒素、高频刺激等)的病理痛模型,而非简单的急性生理性疼痛范式[47]。目前关于tDCS 作用机制的研究较少,许多现有结论仍然需要重复的实验进行验证。
2.tDCS 的临床效果
目前已有许多关于tDCS 治疗疼痛的文献,其中不乏系统综述及荟萃分析,使用不同的评价系统提供了关于tDCS 疗效的不同结果评价。有研究认为tDCS 成功地缓解了神经病理性疼痛[60],与此同时也有研究认为在神经病理性疼痛病人中tDCS 组与假刺激组没有明显区别[46],类似的不一致结论也出现在其他类型疼痛的研究当中。例如,一些系统评价认为tDCS 对纤维肌痛有明确的镇痛效果,但另一些系统评价则认为这种镇痛效果并不稳定,或与假刺激组的结果相比,接受tDCS 治疗后的病人并不能提供疼痛减轻的证据[51,52]。
在神经病理性疼痛的领域中,极少有将tDCS与传统的rTMS 疗效进行对比的研究。一项研究对比了在治疗腰骶神经根病病人中的效果,结果提示rTMS 的疗效优于tDCS[61],然而对常规rTMS 治疗无反应的疼痛病人也可以通过tDCS治疗得到缓解。一项小型随机研究将tDCS 作为辅助治疗,报告了tDCS 与背根神经节刺激的联合使用比单独的背根神经节刺激疗效更好[62]。
tDCS 最大的优势是可以居家治疗,便于进行长期持续性治疗。但由于tDCS 刺激系统在电极放置、刺激强度、刺激模式方面选择不当都容易造成严重危害[63],因此必须额外使用远程监督系统,允许临床工作人员进行在线监测并控制电刺激来规避伤害。Garcia-Larrea 等[64]通过远程医疗,针对不同适应证,测试了医疗遥控居家刺激的可行性,结果表明远程控制在大多数情况下是可行的。参与研究的一半病人表示tDCS 有镇痛作用,而另一半病人的疼痛没有缓解。所以tDCS 的远程居家治疗还需要进一步的研究与优化。
四、小结
慢性疼痛的治疗仍是一项世界性难题,病人需要更加科学、长效的治疗手段。目前在临床上,医研人员建议对耐药及其他疗法无效的慢性疼痛病人,采取侵袭性或非侵袭性皮质刺激作为缓解疼痛的替代疗法。eMCS、rTMS、tDCS 三种针对运动皮质的刺激技术各有优势(见表1)。虽然存在疗效不稳定的问题,但初步的临床试验证实三种治疗手段对药物耐受的疼痛病人都有一定的治疗效果,具有良好的应用前景(见表2)。随着技术的发展,运动皮质刺激的安全性和疗效都在不断提高,临床上应用运动皮质刺激作为神经病理性疼痛治疗的辅助手段或治疗手段也日益增多。尽管基础理论及临床研究都表明运动皮质刺激极具应用潜力,但目前临床长期使用且效果显著的案例仍然很少。此外运动皮质刺激是通过兴奋性还是抑制性神经元的调节来实现镇痛仍是一个争论的话题[16]。随着技术和研究的不断进步,可以预料在未来,运动皮质刺激协同药物、针灸、手术、心理等方法将在慢性疼痛的治疗中发挥更大作用。
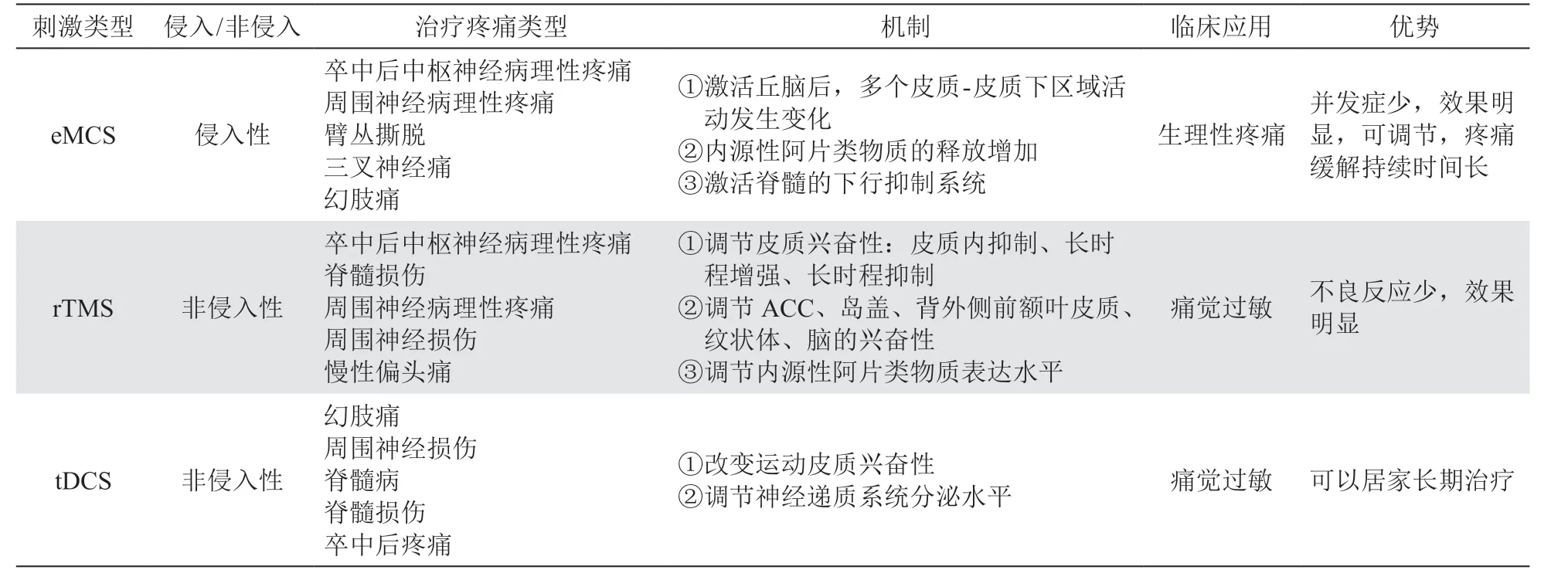
表1 MCS 刺激技术对比

表2 MCS 治疗技术在慢性疼痛病人中的主要临床试验
利益冲突声明:作者声明本文无利益冲突。
