5株蕲艾内生细菌的促生因子及其对黄州萝卜的促生效果研究
2023-05-23徐碧林彭陈万里王邓玥张文敬蔡菲郑永良李世升
徐碧林 彭陈万里 王邓玥 张文敬 蔡菲 郑永良 李世升


摘要:分别利用钼蓝比色法、原子吸收分光光度计、元素分析仪和Salkowski比色法测定5株蕲艾内生细菌溶磷、解钾、固氮和产IAA的能力,并比较它们对黄州萝卜种子萌发和幼苗生长的促进作用。结果表明,菌株Acinetobacter pittii lzy-1、Pseudomonas psychrotolerans lzy-2和Pantoea sp. Lzy-3既能溶剂有机磷(8.28~23.72 mg/L),也能溶解无机磷(75.57~342.77 mg/L);Curtobacterium luteum lzy-9只能溶解无机磷(358.02 mg/L)。5株待测菌株都具有解钾能力(5.77~19.77 mg/L),lzy1和lzy9具有固氮活性,且固氮能力相当(发酵液氮含量分别为8.55、8.73 mg/L)。除了lzy1,其余4株菌都能产IAA(10.38~15.43 mg/L),其中lzy2产IAA活性最高。5株菌均对黄州萝卜种子萌发和幼苗的生长具有促进作用。其中lzy2提高发芽势的效果最为显著,lzy9对下胚轴长和株高的促生效果最为显著,增长率分别为191.22%和83.23%;Bacillus cereus lzy-7对单株鲜质量的促生效果最为显著,增长率达89.09%。本研究为进一步探究蕲艾内生细菌的促生机理以及开发应用于黄州萝卜的专用微生物菌剂或菌肥奠定了基础。
关键词:蕲艾内生细菌;黄州萝卜;微生物菌剂;促生因子;促生特性
中图分类号:S182 文献标志码:A
文章编号:1002-1302(2023)08-0203-08
基金项目:中央引导地方科技发展专项(编号:2018ZYYD019、2019zyyd044);湖北省教育厅科学技术研究计划青年人才项目(编号:Q20182901);湖北省重点实验室、大别山特色资源开发湖北省协同创新中心联合开放基金(编号:2021CX03)。
作者简介:徐碧林(1986—),女,湖北黄冈人,博士,讲师,研究方向为微生物生理生化。E-mail:xubilin@whu.edu.cn。
通信作者:李世升,博士,副教授,研究方向为作物发育与育种。E-mail:shishengli@hgnu.edu.cn。
萝卜(Raphanus sativus L.)别称莱菔,为十字花科萝卜属作物,在世界各地广泛种植,是全球重要蔬菜之一[1]。作为重要的食用部位,萝卜肉质根富含多种微量元素、莱菔子素和植物蛋白等,具有较高的营养价值和药用价值。我国萝卜产量高、耐贮藏,常年种植面积约120万hm2,约占世界种植面积的40%,产量约占世界总产量的47%,是备受欢迎的大众化蔬菜[2-3]。“黃州萝卜”是黄冈特产,并于2008年获国家地理标志产品保护[4]。“黄州萝卜”不仅产量高、适应强,还具有不易糠心、肉质紧脆、耐贮藏等优良性状和品质,尤其是生食甜、熟食味美、煨汤不稠、回火不烂的特点使其更受广大消费者喜爱[5-6]。但由于农户盲目追求高产,长期不合理施用化肥,造成土壤质量下降、环境污染等问题,不但没有提高蔬菜产量和品质,反而还极大地浪费了资源。因此,不合理施用化肥已成为蔬菜生产中普遍存在的问题[7]。鉴于此,通过微生物菌肥替代或部分替代化肥的研究逐渐成为学者研究的热点[8-9]。
内生细菌存在于植物的根、茎、叶、花和种子中,对植物的生长具有促进作用[10-12]。例如来源于白化茶的内生细菌能显著提高水稻和扦插茶叶的生物量[13];来源于湖平山碎米荠的内生细菌能在硒酸盐胁迫下促进红豆杉种子萌发[14];来自甲乌豆根部的内生细菌对早期幼苗生长具有显著的促进作用[15];东乡野生稻种子内生细菌对水稻幼苗根长、地上部长、干物质和叶绿素含量具有显著的促进作用[16]。植物促生细菌采用多种机制促进植物生长,且大多是多种机制协同作用[17]。目前已报道的促生细菌的促生机制主要包括以下3个方面:(1)合成促进植物生长发育物质,例如吲哚乙酸(IAA)、植酸酶和吡咯喹啉醌(PQQ)等,尤其是通过色氨酸依赖途径合成IAA会影响植物的生长[18-19]。 (2)通过固定大气中的氮、改变根系形态、调节渗透压、改善磷酸铁载体的产生、增强增溶活性和调节气孔等方式促进植物的生长和发育[20-21]。(3)还有一些促生菌能诱导植物产生系统耐受力和系统抗性,使植物抵抗生物类侵害和非生物胁迫,提高植物整体免疫抗病力,进而促进植物生长[22]。近年来,植物促生菌在水稻、小麦、玉米、大豆等大田作物,以及甘蔗、苹果、辣椒、生菜、番茄、莴苣等果蔬上已有大量应用研究[23-32]。然而,植物促生菌在促进萝卜种子萌发和苗生长效应等方面的研究鲜见报道。
不同的气候环境、植物种类以及土壤类型,使得植物促生菌的特性和适宜性不同,导致菌肥效果差异也很大[33]。蕲艾(Artemisia argyi Levl. et Van. var. argyi cv. Qiai)为湖北省蕲春县特产、中国国家地理标志产品、湖北省道地药材[34-36]。研究发现,蕲艾含有丰富的内生菌。Cosoveanu等从湖北蕲春野生艾草根茎中分离出43 株内生真菌[37]。Shi等从蕲艾艾叶中分离得到能产新型真菌多酮类化合物和2种已知的酮类类似物的内生真菌Trichoderma koningiopsis QA-3[38]。杨倩从蕲艾根茎中分离纯化得到1株产卷线孢菌素的内生真菌HCH285[39]。石小杉从蕲艾叶中分离纯化得到2株对水产病害具有较强抑菌效果的内生真菌拟康宁木霉菌QA-3(T. koningiopsis)和绿木霉菌QA-8(T. virens)[40]。本团队徐碧林等从蕲艾不同组织中分离得到20株具有不同程度的产酶活性及抑菌能力的内生细菌[41]。目前有关蕲艾内生菌促生作用的研究鲜见报道。
因此,本研究采用盆栽试验,以黄州萝卜为研究对象,在前期分离得到的蕲艾内生细菌的基础上,筛选具有溶磷、解钾、固氮和产IAA等能力的内生细菌,并比较它们对黄州萝卜种子萌发和幼苗生长的促生效果,旨在为萝卜种植以及蕲艾内生促生菌资源的开发与利用提供参考。
1 材料与方法
1.1 材料
供试菌株和萝卜种子:本试验所用蕲艾内生细菌Acinetobacter pittii lzy-1、Pseudomonas psychrotolerans lzy-2、Pantoea sp. Lzy-3、Bacillus cereus lzy-7和Curtobacterium luteum lzy-9以及黄州萝卜种子,均保存于黄冈师范学院经济林种质资源改良与综合利用湖北省重点实验室。
培养基:阿须贝氏培养基用于内生细菌固氮能力的筛选[42];King氏液体培养基用于内生细菌分泌IAA特性测定[43];无机磷液体培养基用于内生细菌溶无机磷特性测定[44];蒙金娜有机磷培养基用于内生细菌解有机磷特性测定[45];解钾(钾长石粉)培养基用于解钾内生细菌的筛选[46];LB培养基用于内生细菌的保存与培养[47]。
1.2 方法
1.2.1 促生细菌的初筛和复筛
1.2.1.1 溶磷、解钾和固氮能力初筛 将纯化的蕲艾内生细菌分别接种于无机磷、有机磷、解钾和阿须贝氏固体培养基上,37 ℃培养24~72 h,分别测量记录溶磷圈直径/解钾圈直径(D)和菌落直径(d)比值(D/d)大小,初步筛选具有溶磷和解钾能力的菌株。观察记录菌株在阿须贝氏固体培养基上的生长速度和菌落大小,初步筛选具有固氮能力的菌株。
1.2.1.2 溶磷、解钾和固氮能力复筛 将初筛得到的解磷、解钾菌株分别接种到含磷和解钾(钾长石粉)液体培养基中,对照加等量无菌水,37 ℃、180 r/min 摇床培养7 d,各接种处理分别设置3个重复。分别用钼锑抗比色法和原子吸收分光光度计测定发酵液中可溶磷和可溶钾含量[48]。溶磷/钾率=[试验组可溶磷/钾含量(mg/L)-对照组可溶磷/钾含量(mg/L)]/试验组可溶磷/钾含量(mg/L)×100%。同时用梅特勒-托利多FiveEasy Plus系列pH计测最终的发酵液上清的pH值。参照王明欢等的方法,将筛选得到的具有固氮能力的菌株活化后,接种至100 mL阿须贝液体培养基中,37 ℃、180 r/min 振荡培养3 d,8 000 r/min离心 10 min,除去上清,称定沉淀的质量。取一定量的沉淀干燥至呈均匀粉末状,称定质量,命名为菌名+菌体1。剩余的菌泥平均分成3份,分别接种至3个150 mL新鲜的阿须贝液体培养基中,37 ℃、180 r/min 振荡培养7 d,8 000 r/min离心10 min,取上清液旋蒸后冷冻干燥得均匀粉末,称定质量,命名为菌名+發酵液1。沉淀干燥后称定质量,命名为菌名+菌体3。然后,利用元素分析仪检测上述所得3种样品中的氮含有量[48-49]。
1.2.1.3 产IAA活性测定 采用Salkowski比色法,参照李福艳等的方法[50],根据标准曲线测定细菌分离IAA的量。
1.2.2 菌株对黄州萝卜的促生效果试验设计
1.2.2.1 菌株对黄州萝卜种子萌发的影响 将筛选出的具有溶磷、解钾及分泌IAA能力的菌株分别接种于50 mL LB液体培养基中,37 ℃、180 r/min振荡培养24 h,8 000 r/min离心10 min,将菌体重悬于50 mL无菌生理盐水中,对菌悬液进行梯度稀释,配制成D600 nm≈0.5(约1×108 CFU/mL)的菌悬液备用。挑选饱满、大小一致的新鲜黄州萝卜种子,用75%无水乙醇浸泡30 s消毒处理后,用无菌水冲洗干净,置于铺有3层无菌滤纸的培养皿中,每个培养皿内放30粒黄州萝卜种子和10 mL菌悬液,每个处理重复3次。将培养皿置于25 ℃恒温培养箱中黑暗浸种12 h后,转移至25 ℃温室培养5 d(空白对照CK使用无菌水处理)。每天观察,以种子露白作为发芽标准,培养第3天统计发芽势,第5天统计发芽率并用数显卡尺测量下胚轴长和胚根长。
1.2.2.2 菌株对黄州萝卜幼苗生长的影响 将菜园土和营养土以1 ∶1的比例混合,高压蒸汽灭菌2次(每次121 ℃灭菌1 h)后,等量分装于底径9 cm×高11.5 cm×口径12.5 cm的花盆中备用。根据上述方法对黄州萝卜种子进行萌发处理,待种子萌发第3天,挑选长度一致的种子,每个花盆种2粒。试验组每2 d用50 mL约1×108 CFU/mL的菌悬液浇灌,对照用等量无菌水浇灌,每种处理30盆,重复3次。将花盆至于(25±2) ℃温室,空气相对湿度65%左右,每个培养架的光照由3根40 W的直管灯管提供,采用每日光培养16 h和暗培养8 h的光周期。培养至第10天进行间苗,每盆留1株苗继续培养约45 d。测量萝卜幼苗的株高、鲜质量、根长和叶片数等农艺指标。
上述试验于2021年3月至2022年4月在经济林种质资源改良与综合利用湖北省重点实验室作物栽培室进行。
1.2.3 数据处理与分析
运用软件SigmaPlot 14.5和SPSS Statistics 23.0进行数据处理和统计学分析。
2 结果与分析
2.1 促生细菌的初筛和复筛结果
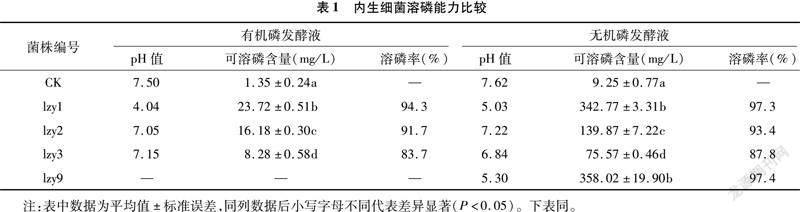
2.1.1 内生细菌溶磷能力比较
经过初筛,发现菌株lzy1、lzy2和lzy3既可溶有机磷,又可溶无机磷,菌株lzy9只能溶无机磷。由表1可知,菌株lzy1、lzy2和lzy3溶有机磷的范围为8.28~23.72 mg/L,溶磷能力依次为lzy1>lzy2>lzy3,溶磷率分别为94.3%、91.7%和83.7%。菌株lzy1、lzy2、lzy3和lzy9溶无机磷的范围为75.57~358.02 mg/L,溶磷能力依次为lzy9>lzy1>lzy2>lzy3,溶磷率依次为97.4%、97.3%、93.4%和87.8%。试验组发酵液的pH值均低于对照组。
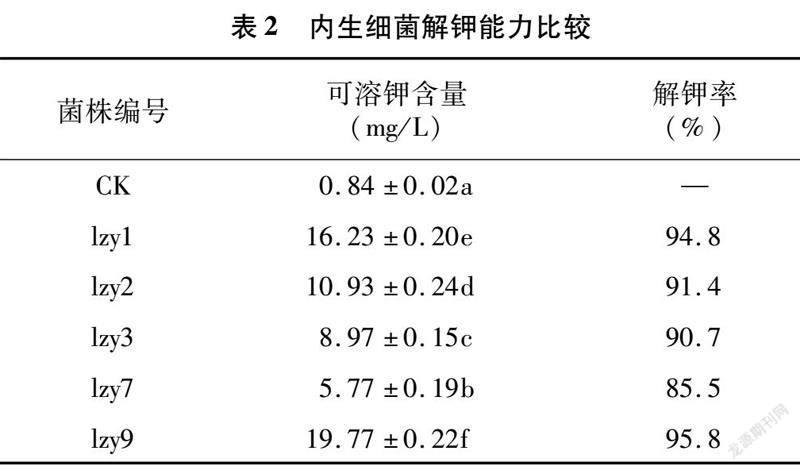
2.1.2 内生细菌解钾能力比较
经过初筛,发现5株菌均具有不同程度的解钾能力。由表2可知,发酵液中可溶钾含量为5.77~19.77 mg/L,解钾能力依次为lzy9>lzy1>lzy2>lzy3>lzy7,解钾率依次为95.8%、94.8%、91.4%、90.7%和85.5%。
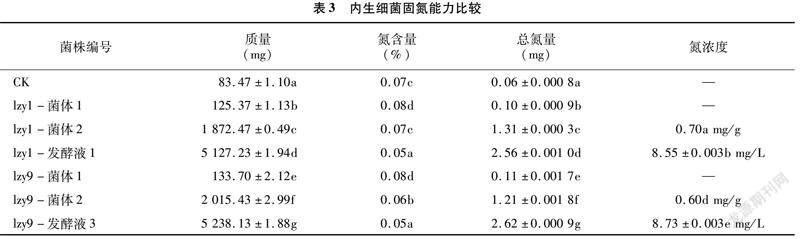
2.1.3 内生细菌固氮能力比较
经过初筛,发现菌株lzy1和lzy9能在不含氮的培养基上生长。由表3可知,这2株菌均可以固定空气中的氮,且固定的氮一部分用于菌体生长,一部分溶于发酵液中,lzy9的固氮能力略强于lzy1。
2.1.4 内生细菌产IAA活性比较
通过菌株培养液IAA定性试验对所有菌株进行初筛发现,只有菌株lzy1不产IAA。如图1所示,这4株菌产IAA的浓度均大于10 mg/L,lzy2产IAA能力最强,达15.43 mg/L lzy9次之 为13.64 mg/L,lzy3和lzy7分别为12.54 mg/L和10.38 mg/L。
2.2 内生细菌对黄州萝卜的促生效果比较
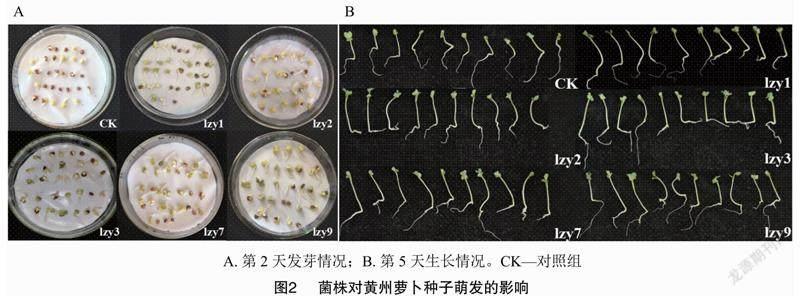
2.2.1 内生细菌促进黄州萝卜种子萌发效果比较
分别用5株菌的菌悬液处理黄州萝卜种子,结果如图2和表4所示。在种子萌发第3天统计发芽势,发现5株菌株均在不同程度上提高了黄州萝卜的发芽势,发芽势的增长率依次为lzy2>lzy3=lzy1=lzy9>lzy7。在种子萌发第5天统计发芽率,发现试验组的种子均全部发芽,而对照组的发芽率为90%,发芽率提高10百分点。此外,在种子萌发第5天分别测量幼苗的整体、下胚轴和胚根长度发现,与空白对照组相比,试验组的上述参数均有不同程度的提高。其中整体长度和下胚轴长度增长率lzy9>lzy2>lzy3>lzy7>lzy1,[JP+2]整体长度增长率依次为94.0%、88.6%、79.0%、74.6%和73.6%,下胚轴长度增长率依次为191.22%、181.46%、160.49%、151.22%和143.41%。根长增长率lzy1>lzy2>lzy7=lzy9>lzy3,依次为31.6%、28.14%、26.41%、26.41%和23.81%。
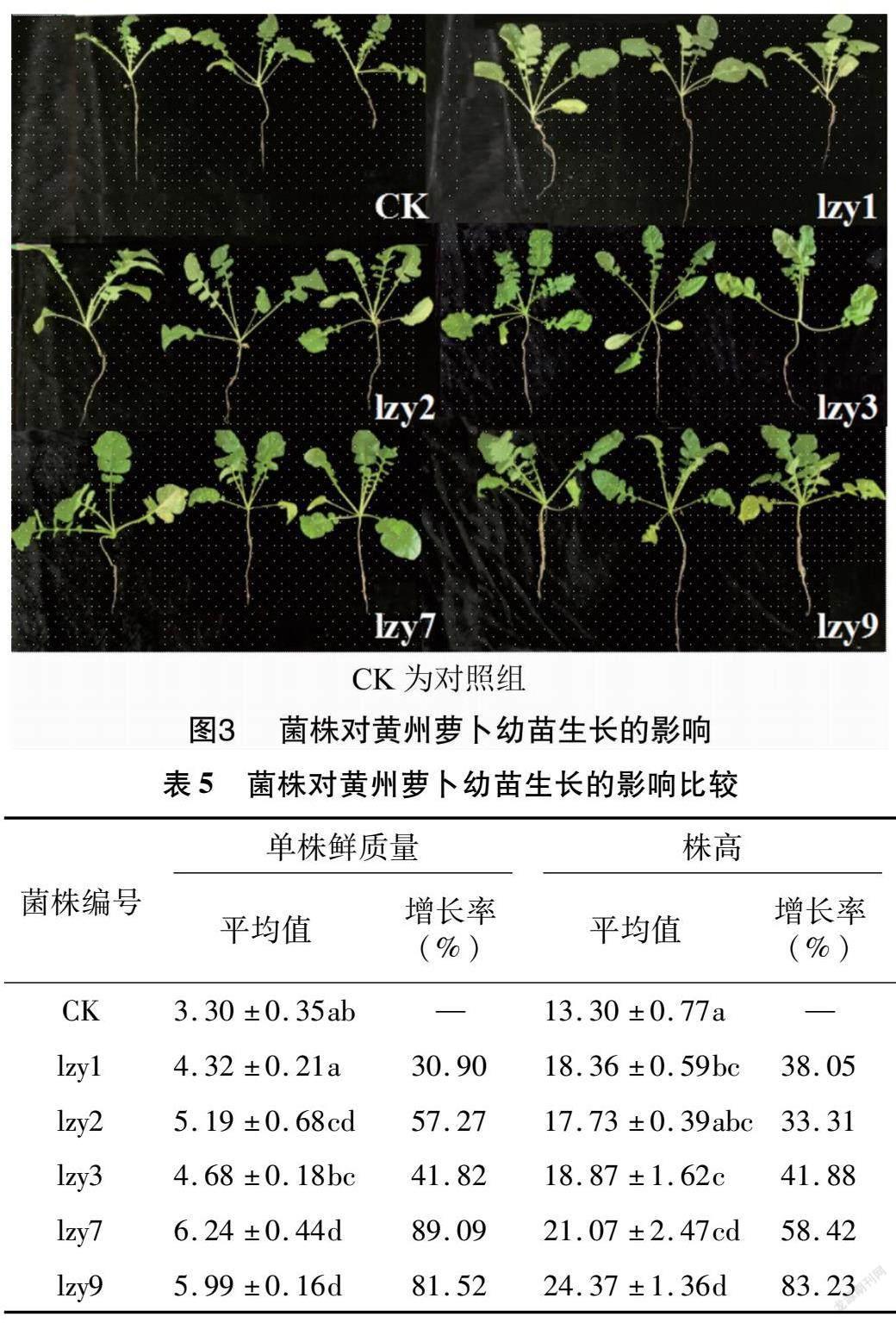
2.2.2 内生细菌促进黄州萝卜幼苗生长的效果比较
分别用5株菌的菌悬液处理黄州萝卜幼苗,结果如图3和表5所示。通过对单株幼苗的鲜质量和株高进行统计发现,5株菌对黄州萝卜幼苗的生长有着不同程度的促进作用。其中单株鲜质量增长率lzy7>lzy9>lzy2>lzy3>lzy1,依次为89.09%、81.52%、57.27%、41.82%和30.9%;株高增长率lzy9>lzy7>lzy3>lzy1>lzy2,依次为83.23%、58.42%、41.88%、38.05%和33.31%。
3 讨论
内生菌可为植物提供营养成分,也可以通过代谢产物促进植物生长。本研究探讨了5株蕲艾内生细菌的4项促生因子(溶磷、解钾、 固氮、产IAA)及其对黄州萝卜种子萌发和幼苗生长的影响。结果表明,这5株菌均能产生不同类型的促生因子,且都对黄州萝卜种子萌发和幼苗生长具有一定的促进作用。
Ashfaq等的研究表明,解钾细菌A. pittii L1/4和L3/3显著提高了盐渍条件下水稻植株的茎长、鲜质量、干质量和叶绿素含量,表现出较强的促生效果[51]。Wan等发现,溶磷细菌A. pittii gp-1具有较强的溶有机磷和无机磷的能力,且能促进铅的固定化,可显著改善土壤肥力和质量[52]。Khan等则从麦田中分离到了具有固氮能力的A. pittii[53]。与上述结果类似,本研究发现,蕲艾内生细菌A. pittii lzy-1能溶有机磷(23.72 mg/L)、无机磷(342.77 mg/L)、解钾(16.23 mg/L)和固氮(菌体和发酵液的氮浓度分别为0.70 mg/g和8.55 mg/L),且对黄州萝卜种子萌发和幼苗生长均具有较强的促进作用。Passari等发现,能产IAA、激动素和苄基腺嘌呤的P. psychrotolerans能显著提高番茄的株高、根长和鲜质量[54]。Mei等发现,具有溶磷能力的P. psychrotolerans IALR632能显著促进番茄的生长[55]。Kang等的研究表明,接种P. psychrotolerans CS51能诱导黄瓜产生内源吲哚-3-乙酸(IAA)和赤霉素(GAs),进而显著提高了黄瓜植株的生长(根冠长度)和对重金属的耐受性[56]。本研究结果表明,蕲艾内生细菌P. psychrotolerans lzy2能溶有机磷(16.18 mg/L)、无机磷(139.87 mg/L)以及产IAA(15.43 mg/L),且能显著促进黄州萝卜种子萌发和幼苗生长。不仅如此,本研究还发现,P. psychrotolerans lzy2具有解钾活性,系首次报道具有解钾活性的P. psychrotolerans。
Rasul等发现,Pantoea sp. MR1能溶解多种不同的难溶磷,且对小麦具有显著的促生效果[57]。Trifi等的研究則表明,在含磷石膏的土壤中,Pantoea sp. BRM17能促进甘蓝型油菜的生长[58]。Wang等研究发现,从莎草叶片中分离得到的Pantoea sp. YSD J2不仅能溶磷、解钾,还能产IAA,且能显著促进莎草的生长[59]。Bacillus能促进植物种子萌发、幼苗及根系生长,提高植物产量,改善品质。目前,关于Bacillus促生作用的报道较多。Wang等发现,耐镉根际B. cereus M4通过产IAA和改善根际土壤环境促进水稻生长,减少镉的积累[60]。Kumar等的研究表明,B. cereus LPR2可通过产IAA和溶磷来促进玉米的生长[61]。Ali等发现,具有解钾能力的Bacillus cereus显著促进了马铃薯的生长,使得总产量达40 t/hm2[62]。与上述结果类似,本研究表明,蕲艾内生细菌Pantoea sp. lzy3能溶有机磷(8.28 mg/L)、无机磷(75.57 mg/L)、解钾(8.97 mg/L)以及产IAA(12.54 mg/L),蕲艾内生细菌B. cereus lzy7能解钾(5.77 mg/L)和产IAA(10.38 mg/L),且二者都能促进黄州萝卜种子萌发和幼苗生长。
目前,关于C. luteum促生作用的报道较少,Khan等研究发现,C. luteum SAK2通过产IAA促进盐胁迫条件下水稻的生长发育[53]。Sturz等发现,C. luteum既可以单独也可以与Rhizobium spp.联合使用来促进红三叶草的生长[63]。Long等的研究表明,C. luteum对紫花苜蓿的生长具有促进作用[64]。与上述结果类似,本研究发现,蕲艾内生细菌C. luteum lzy9对黄州萝卜种子萌发和幼苗的生长具有促进作用。除此之外,本研究还首次系统地探究了C. luteum lzy9产生促生长因子的效果,结果发现,它不仅能溶无机磷(358.02 mg/L)、固氮(菌体和发酵液的氮浓度分别为0.60 mg/g和8.73 mg/L),还能产IAA(13.64 mg/L)。
近年来,不少研究者致力于促生长因子的特性及其相关性的研究。王奎萍等研究发现,菌株溶磷、固氮和产IAA的能力与促进植物生长效果之间存在明显的正相关,且固氮和溶磷活性对于植物生长的影响大于产IAA[65]。正如本研究中lzy9虽然产IAA能力不如lzy2,但是其溶无机磷、解钾和固氮均强于lzy2,因此其对黄州萝卜种子萌发和幼苗生长的促生效果均强于lzy2。陈峥等的研究则表明,芽胞杆菌促生因子对植物的促生作用是相互独立的,例如,促生因子(解无机磷、解有机磷、固氮效能、IAA含量、植酸酶活性、PQQ 浓度)之间无相关关系(P>0.05),与番茄种子发芽率、胚根长、胚芽长也无明显相关关系(P>0.05)[66],且促生效果好的菌株促生长因子的含量并不一定高,反之也有可能。例如本研究中的lzy7和lzy1,虽然lzy7产促生因子的能力均不如其他菌株,但是其对萝卜幼苗生长的影响却强于lzy1、lzy2和lzy3;而lzy1促生因子含量并不低于lzy2、lzy3和lzy7,但是其促生效果却不如这3株菌。这可能与lzy7的生长速率显著快于其他几株菌,而lzy1的生长速率则显著低于其余菌株有关(结果没有列出)。本研究还发现,菌株产IAA的能力与其促进萝卜种子萌发的效果几乎呈正相关。该结果表明,在无土的种子萌发阶段,产IAA的能力对于种子萌发的影响要大于溶磷、解钾和固氮。总之,促生过程十分复杂,特定的促生因子起到的效果有限,需要联合多种促生因子共同作用才能起到更好的促生效果。然而,具有高效促生能力的微生物菌剂用于农业生产,不仅能充分利用土壤潜在营养元素,还能减少由于化肥的过度使用造成的土壤退化和环境污染问题,对促进农业可持续发展具有重要意义。本研究还应该结合菌株生长情况,进一步量化其产促生因子的能力。在此基础上,制备复合菌剂,以最大限度地提高其对黄州萝卜生长发育的促进作用。此外,本研究筛选到的菌株的田间适应性也有待进一步研究。
参考文献:
[1]Gamba M,Asllanaj E,Raguindin P F,et al. Nutritional and phytochemical characterization of radish (Raphanus sativus):a systematic review[J]. Trends in Food Science & Technology,2021,113:205-218.
[2]包崇来,汪精磊,胡天华,等. 我国萝卜产业发展现状与育种方向探讨[J]. 浙江农业科学,2019,60(5):707-710.
[3]王方艳. 我国萝卜产业发展问题及对策[J]. 中国农机化学报,2016,37(11):188-191.
[4]葛长军,闫 良,李世升,等. 国家地理标志保护产品——黄州萝卜[J]. 长江蔬菜,2021(2):38-39.
[5]陈全胜. 黄州萝卜提纯复壮技术研究[J]. 黑龙江农业科学,2015(2):168-169.
[6]罗九玲. 黄州萝卜产业发展现代及对策[J]. 现代农业科技,2012(22):310,312.
[7]于桂香. 化肥减量对蔬菜产量和品质的影响[J]. 农家参谋,2022(2):66-68.
[8]Stamenkovic' S,Bekoski V,Karabegovic' I,et al. Microbial fertilizers:a comprehensive review of current findings and future perspectives[J]. Spanish Journal of Agricultural Research,2018,16(1):e09R01.
[9]邬 刚,严从生,袁嫚嫚,等. 化肥減量配施有机肥对叶菜类蔬菜产量、品质和养分吸收的影响[J]. 中国瓜菜,2021,34(12):58-62.
[10]Compant S,Mitter B,Colli-Mull J G,et al. Endophytes of grapevine flowers,berries,and seeds:identification of cultivable bacteria,comparison with other plant parts,and visualization of niches of colonization[J]. Microbial Ecology,2011,62(1):188-197.
[11]Elmagzob A A H,Ibrahim M M,Zhang G F. Seasonal diversity of endophytic bacteria associated with Cinnamomum camphora (L.) Presl[J]. Diversity,2019,11(7):112.
[12]Qin S,Li J,Chen H H,et al. Isolation,diversity,and antimicrobial activity of rare Actinobacteria from medicinal plants of tropical rain forests in Xishuangbanna,China[J]. Applied and Environmental Microbiology,2009,75(19):6176-6186.
[13]Jia H Y,Xi Z G,Ma J Q,et al. Endophytic bacteria from the leaves of two types of albino tea plants,indicating the plant growth promoting properties[J]. Plant Growth Regulation,2022,96(2):331-343.
[14]Li Q,Zhou S B,Liu N. Diversity of endophytic bacteria in Cardamine hupingshanensis and potential of culturable selenium-resistant endophytes to enhance seed germination under selenate stress[J]. Current Microbiology,2021,78(5):2091-2103.
[15]Faria P S A,de Oliveira Marques V,Selari P J R G,et al. Multifunctional potential of endophytic bacteria from Anacardium othonianum Rizzini in promoting in vitro and ex vitro plant growth[J]. Microbiological Research,2021,242:126600.
[16]Zhang Z B,Liu T T,Zhang X,et al. Cultivable endophytic bacteria in seeds of Dongxiang wild rice and their role in plant-growth promotion[J]. Diversity,2021,13(12):665.
[17]Taulé C,Vaz-Jauri P,Battistoni F. Insights into the early stages of plant-endophytic bacteria interaction[J]. World Journal of Microbiology and Biotechnology,2021,37(1):13.
[18]Fouda A,Eid A M,Elsaied A,et al. Plant growth-promoting endophytic bacterial community inhabiting the leaves of Pulicaria incisa (Lam.) DC inherent to arid regions[J]. Plants,2021,10(1):76.
[19]Gravel V,Antoun H,Tweddell R J. Growth stimulation and fruit yield improvement of greenhouse tomato plants by inoculation with Pseudomonas putida or Trichoderma atroviride:possible role of indole acetic acid (IAA)[J]. Soil Biology and Biochemistry,2007,39(8):1968-1977.
[20]Compant S,Reiter B,Sessitsch A,et al. Endophytic colonization of Vitis vinifera L. by plant growth-promoting bacterium Burkholderia sp.strain PsJN[J]. Applied and Environmental Microbiology,2005,71(4):1685-1693.
[21]Devi K A,Pandey P,Sharma G D. Plant growth-promoting endophyte Serratia marcescens AL2-16 enhances the growth of Achyranthes aspera L.,a medicinal plant[J]. HAYATI Journal of Biosciences,2016,23(4):173-180.
[22]Wu W,Chen W H,Liu S Y,et al. Beneficial relationships between endophytic bacteria and medicinal plants[J]. Frontiers in Plant Science,2021,12:646146.
[23]Dubey A,Saiyam D,Kumar A,et al. Bacterial root endophytes:characterization of their competence and plant growth promotion in soybean [Glycine max (L.) Merr.]under drought stress[J]. International Journal of Environmental Research and Public Health,2021,18(3):931.
[24]Ibrahim E,Fouad H,Zhang M C,et al. Biosynthesis of silver nanoparticles using endophytic bacteria and their role in inhibition of rice pathogenic bacteria and plant growth promotion[J]. RSC Advances,2019,9(50):29293-29299.
[25]Rana K L,Kour D,Kaur T,et al. Endophytic microbes from diverse wheat genotypes and their potential biotechnological applications in plant growth promotion and nutrient uptake[J]. Proceedings of the National Academy of Sciences,India Section B:Biological Sciences,2020,90(5):969-979.
[26]Wang Y J,Li H,Zhao W,et al. Induction of toluene degradation and growth promotion in corn and wheat by horizontal gene transfer within endophytic bacteria[J]. Soil Biology and Biochemistry,2010,42(7):1051-1057.
[27]da Silveira A P D,de Paula Freitas Iório R,Marcos F C C,et al. Exploitation of new endophytic bacteria and their ability to promote sugarcane growth and nitrogen nutrition[J]. Antonie Van Leeuwenhoek,2019,112(2):283-295.
[28]Martínez-Cano B,García-Trejo J F,Sánchez-Gutiérrez A E,et al. Isolation and characterization of plant growth-promoting compost bacteria that improved physiological characteristics in tomato and lettuce seedlings[J]. Agriculture,2021,12(1):3.
[29]Puri R R,Dangi S R,Dhungana S A,et al. Diversity and plant growth promoting ability of culturable endophytic bacteria in Nepalese sweet potato[J]. Advances in Microbiology,2018,8(9):734-761.
[30]Saragih M,Trizelia,Nurbailis,et al. Endophytic colonization and plant growth promoting effect by entomopathogenic fungus,Beauveria bassiana to red chili (Capsicum annuum L.) with different inoculation methods[J]. IOP Conference Series:Earth and Environmental Science,2019,305(1):012070.
[31]Tamoiūne· I,Staniene· G,Haimi P,et al. Endophytic Bacillus and Pseudomonas spp. modulate apple shoot growth,cellular redox balance,and protein expression under in vitro conditions[J]. Frontiers in Plant Science,2018,9:889.
[32]黃书超,侯 栋,岳宏忠,等. 三株促生菌及其混合微生物菌剂对莴笋生长和品质的影响[J]. 浙江农业学报,2021,33(7):1212-1221.
[33]Egamberdiyeva D. The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils[J]. Applied Soil Ecology,2007,36(2/3):184-189.
[34]董元火,廖新安,夏恒建,等. 湖北蕲春九棵松野生蕲艾群落基本结构[J]. 江汉大学学报(自然科学版),2018,46(1):58-61.
[35]洪宗国. 蕲艾的道地性研究[J]. 中南民族大学学报(自然科学版),2015,34(2):33-37.
[36]曹 利,卢金清,叶 欣. 蕲艾的化学成分和药理作用研究进展[J]. 中国药房,2017,28(10):1423-1425.
[37]Cosoveanu A,Hernandez M,Iacomi-Vasilescu B,et al. Fungi as endophytes in Chinese Artemisia spp.:juxtaposed elements of phylogeny,diversity and bioactivity[J]. Mycosphere,2016,7(2):102-117.
[38]Shi X S,Wang D J,Li X M,et al. Antimicrobial polyketides from Trichoderma koningiopsis QA-3,an endophytic fungus obtained from the medicinal plant Artemisia argyi[J]. RSC Advances,2017,7(81):51335-51342.
[39]楊 倩. 蕲艾内生菌HCH285的卷线孢菌素活性及安全性研究[D]. 武汉:华中农业大学,2018:12-14.
[40]石小杉. 蕲艾内生真菌中抗海洋水产病害菌活性代谢产物研究[D]. 青岛:中国科学院大学(中国科学院海洋研究所),2019:15-24.
[41]徐碧林,罗周瑜,彭陈万里,等. 蕲艾内生细菌的分离鉴定及抑菌活性分析[J]. 广西植物,2023,43(1):68-78.
[42]白 洁,姚 拓,雷 杨,等. 欧李(Cerasus humilis)内生固氮细菌筛选、鉴定及特性研究[J]. 草地学报,2022,30(4):859-866.
[43]李海云,蒋永梅,姚 拓,等. 蔬菜作物根际促生菌分离筛选、鉴定及促生特性测定[J]. 植物保护学报,2018,45(4):836-845.
[44]Nautiyal C S. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiology Letters,1999,170(1):265-270.
[45]李剑峰,张淑卿,龙 莹,等. 石漠生境下金银花内生/根际解磷菌在不同温度及酸碱环境下的生长和溶磷能力[J]. 西南农业学报,2021,34(4):820-826.
[46]陈 腊,李可可,米国华,等. 解钾促生菌的筛选鉴定及对东北黑土区玉米的促生效应[J]. 微生物学通报,2021,48(5):1560-1570.
[47]余 萍,姚 斌,罗红梅,等. 西双版纳原始森林土壤中分离的两株纤维素分解细菌的鉴定[J]. 西南农业学报,2021,34(12):2714-2719.
[48]王明欢,张小娜,林 冰,等. 中药药渣中固氮菌、解磷菌、解钾菌的筛选[J]. 中成药,2020,42(2):531-533.
[49]Villar I,Alves D,Mato S. Product quality and microbial dynamics during vermicomposting and maturation of compost from pig manure[J]. Waste Management,2017,69:498-507.
[50]李福艳,刘晓玉,颜静婷,等. 三株产吲哚乙酸根际促生芽孢杆菌的筛选鉴定及其促生作用[J]. 浙江农业学报,2021,33(5):873-884.
[51]Ashfaq M,Hassan H M,Ghazali A H A,et al. Halotolerant potassium solubilizing plant growth promoting rhizobacteria may improve potassium availability under saline conditions[J]. Environmental Monitoring and Assessment,2020,192(11):697.
[52]Wan W J,Qin Y,Wu H Q,et al. Isolation and characterization of Phosphorus solubilizing bacteria with multiple phosphorus sources utilizing capability and their potential for lead immobilization in soil[J]. Frontiers in Microbiology,2020,11:752.
[53]Khan M A,Asaf S,Khan A L,et al. Plant growth-promoting endophytic bacteria augment growth and salinity tolerance in rice plants[J]. Plant Biology,2020,22(5):850-862.
[54]Passari A K,Mishra V K,Leo V V,et al. Phytohormone production endowed with antagonistic potential and plant growth promoting abilities of culturable endophytic bacteria isolated from Clerodendrum colebrookianum Walp[J]. Microbiological Research,2016,193:57-73.
[55]Mei C S,Chretien R L,Amaradasa B S,et al. Characterization of phosphate solubilizing bacterial endophytes and plant growth promotion in vitro and in greenhouse[J]. Microorganisms,2021,9(9):1935.
[56]Kang S M,Asaf S,Khan A L,et al. Complete genome sequence of Pseudomonas psychrotolerans CS51,a plant growth-promoting bacterium,under heavy metal stress conditions[J]. Microorganisms,2020,8(3):382.
[57]Rasul M,Yasmin S,Yahya M,et al. The wheat growth-promoting traits of Ochrobactrum and Pantoea species,responsible for solubilization of different P sources,are ensured by genes encoding enzymes of multiple P-releasing pathways[J]. Microbiological Research,2021,246:126703.
[58]Trifi H,Ben Salem I,Kolsi Benzina N,et al. Effectiveness of plant growth-promoting rhizobacterium Pantoea sp. BRM17 in enhancing canola growth on phosphogypsum-amended soil[J]. Pedosphere,2020,30(4):570-576.
[59]Wang S S,Wang J B,Zhou Y F,et al. Isolation,classification,and growth-promoting effects of Pantoea sp. YSD J2 from the aboveground leaves of Cyperus esculentus L. var. sativus[J]. Current Microbiology,2022,79(2):66.
[60]Wang C R,Liu Z Q,Huang Y C,et al. Cadmium-resistant rhizobacterium Bacillus cereus M4 promotes the growth and reduces cadmium accumulation in rice (Oryza sativa L.)[J]. Environmental Toxicology and Pharmacology,2019,72:103265.
[61]Kumar P,Pahal V,Gupta A,et al. Effect of silver nanoparticles and Bacillus cereus LPR2 on the growth of Zea mays[J]. Scientific Reports,2020,10:20409.
[62]Ali A M,Awad M Y M,Hegab S A,et al. Effect of potassium solubilizing bacteria (Bacillus cereus) on growth and yield of potato[J]. Journal of Plant Nutrition,2021,44(3):411-420.
[63]Sturz A V,Christie B R,Matheson B G,et al. Biodiversity of endophytic bacteria which colonize red clover nodules,roots,stems and foliage and their influence on host growth[J]. Biology and Fertility of Soils,1997,25(1):13-19.
[64]Long L K,Lin Q Y,Yao Q,et al. Population and function analysis of cultivable bacteria associated with spores of arbuscular mycorrhizal fungus Gigaspora margarita[J]. 3 Biotech,2017,7(1):8.
[65]王奎萍,鄭 颖,褚光耀,等. 解磷、固氮、产吲哚乙酸微生物菌株的筛选及其对植物的促生效果[J]. 江苏农业学报,2013,29(6):1352-1359.
[66]陈 峥,刘 波,邓文琼,等. 14株芽胞杆菌菌株的分子鉴定及其促生机理分析[J]. 热带作物学报,2021,42(3):789-799.
