姜曲海猪ATP2B1基因克隆、生物信息学及组织表达分析
2023-05-23徐盼赵为民倪黎纲张君胜闫伟刘家兴陶勇
徐盼 赵为民 倪黎纲 张君胜 闫伟 刘家兴 陶勇



摘要:克隆姜曲海猪质膜钙转运ATP酶1(ATPase Plasma Membrane Ca2+Transporting 1,ATP2B1)基因CDS区序列,对其进行生物信息学分析,并探究ATP2B1基因在不同日龄姜曲海猪子宫组织的表达水平,以期为研究ATP2B1基因在姜曲海猪繁殖性能方面的作用提供参考依据,采用RT-PCR技术扩增姜曲海猪子宫ATP2B1基因CDS区序列,利用生物信息学软件对其进行分析,利用实时荧光定量PCR检测ATP2B1基因在1月龄和8月龄姜曲海猪子宫组织中的表达量。结果显示,姜曲海猪ATP2B1基因CDS区全长3 663 bp,编码1 220个氨基酸,与野猪同源性最高、亲缘关系最近。姜曲海猪ATP2B1蛋白分子质量约为134 737.94 u,原子总数为19 102个,理论等电点(pI)为5.63,带正电荷、负电荷的氨基酸数分别为141、161个。该蛋白最可能位于细胞膜上,为跨膜、非分泌型疏水蛋白质,有159个磷酸化位点和5个N-糖基化位点,无规则卷曲在预测的二级结构中占比最大。实时荧光定量PCR结果显示,ATP2B1基因在8月龄姜曲海猪子宫组织中的表达量显著低于1月龄姜曲海猪子宫组织(P<0.05)。本试验为探明ATP2B1基因对猪繁殖性状的影响提供了分子理论依据。
关键词:姜曲海猪;ATP2B1基因;克隆;生物信息学;组织表达
中图分类号:S828.2;S828.3 文献标志码:A
文章编号:1002-1302(2023)08-0150-07
基金项目:国家自然科学基金(编号:31702089);江苏高校“青蓝工程”;江苏农牧科技职业学院大学生创新创业训练计划(编号:202112806093Y);江苏农牧科技职业学院科技创新团队项目(编号:NSF2021TC04)。
作者简介:徐 盼(1988—),男,江苏南京人,博士,讲师,从事动物遗传育种与繁殖研究。E-mail:panxu_nj@hotmail.com。
通信作者:陶 勇,男,江苏扬州人,博士,教授,从事畜禽品种资源保护与遗传育种的教学及科研工作。E-mail:tyrsm1975@126.com。
近年来,受非洲猪瘟的影响,我国生猪生产无法满足市场的需求,提高猪的繁殖性能对提高猪肉产量具有重要意义。作为猪最重要的经济性状之一,繁殖性状受遗传、品种、营养、环境及年龄等因素的影响,其中遗传是主要的影响因素。因此,对影响猪繁殖性状的候选基因的挖掘与鉴定成为猪遗传育种领域的热点。
姜曲海猪具有耐粗饲、性成熟早、繁殖力高、肉质细嫩、肉味鲜美、皮骨比例较低、早熟易肥等特点,该品种与江苏省的其他5个品种(二花脸猪、淮猪、梅山猪、米猪、沙乌头猪)已被列入国家保护计划。Xu等使用GeneSeek GGP Porcine 80K SNP芯片对来自国家级姜曲海猪保种场的105头姜曲海猪进行基因分型,通过计算LSBL(locus-specific branch length)值鉴别到包括质膜钙转运ATP酶1(ATPase Plasma Membrane Ca2+Transporting 1,ATP2B1)基因在内的9个与姜曲海猪繁殖性状相关的受选择的候选基因[1]。
作为P型离子转运ATP酶家族中的一员,ATP2B1基因与钠/钙交换体协同作用,将细胞内的Ca2+转运至细胞外,维持静息状态下细胞内Ca2+浓度处于较低水平,对维持细胞内外钙离子稳态平衡具有重要作用[2]。Ma等研究发现,与低产二花脸母猪相比,高产二花脸母猪的子宫中钙离子浓度更高[3]。由上述研究发现,ATP2B1基因可能对猪的繁殖性能有影响。目前,对地方猪ATP2B1基因的研究鲜见报道。本研究以姜曲海猪为研究对象,对子宫组织ATP2B1基因CDS区序列进行克隆及相关生物信息学分析,通过实时荧光定量PCR技术检测不同日龄子宫组织中ATP2B1基因的表达,以期为进一步研究ATP2B1基因在豬繁殖性能方面的作用机制提供参考依据。
1 材料与方法
1.1 试验时间和地点
本试验于2021年3—6月在江苏农牧科技职业学院和江苏姜曲海猪种业有限公司进行。
1.2 样品采集
1月龄和8月龄姜曲海母猪各3头,由国家级姜曲海猪保种场(江苏姜曲海猪种业有限公司)提供,采集其子宫组织放入-80 ℃冰箱中保存。
1.3 主要试剂
UNlQ-10柱式Trizol总RNA抽提试剂盒、M-MuLV反转录酶、2×SG Fast qPCR Master Mix (High Rox)定量试剂盒、柱式DNA胶回收试剂盒均购自生工生物工程(上海)股份有限公司;LA Taq酶购自宝日医生物技术(北京)有限公司。
1.4 基因克隆
使用UNlQ-10柱式Trizol总RNA抽提试剂盒提取总RNA;使用M-MuLV反转录酶反转录合成cDNA;根据NCBI(https://www.ncbi.nlm.nih.gov/)网站Sus scrofa ATP2B1基因(登陆号:NM_214352.3)的cDNA序列设计克隆引物、定量引物和内参引物(表1),引物委托生工生物工程(上海)股份有限公司合成;以姜曲海猪子宫组织cDNA为模板进行ATP2B1基因PCR扩增,产物用柱式DNA胶回收试剂盒回收,委托生工生物工程(上海)股份有限公司进行测序,得到姜曲海猪ATP2B1基因的cDNA序列。
1.5 生物信息学分析
利用MegAlign软件比对姜曲海猪与其他物种ATP2B1基因CDS区序列的同源性并构建系统进化树;利用ProtParam分析姜曲海猪ATP2B1蛋白理化性质;利用PSORT预测姜曲海猪ATP2B1蛋白亚细胞定位;利用SignalP 5.0预测姜曲海猪ATP2B1蛋白信号肽;利用TMHMM 2.0预测姜曲海猪ATP2B1蛋白跨膜结构域;利用ProtScale预测姜曲海猪ATP2B1蛋白疏水性;利用NetPhos 3.1预测姜曲海猪ATP2B1蛋白磷酸化位点;利用NetNGlyC 1.0预测姜曲海猪ATP2B1蛋白糖基化位点;利用SOPMA和SWISS-MODEL分别预测姜曲海猪ATP2B1蛋白二级结构和三级结构(表2)。
1.6 姜曲海猪ATP2B1基因子宫组织表达分析
利用实时荧光定量PCR检测1月龄和8月龄姜曲海猪子宫组织中ATP2B1基因的表达量。PCR反应体系20.0 μL:2×SybrGreen qPCR Master Mix 10.0 μL,上下游引物各0.4 μL,ddH2O 7.2 μL,cDNA 2.0 μL。PCR反应程序:95 ℃ 3 min;95 ℃ 5 s,60 ℃ 30 s,共45个循环。每个样品重复3次,以GAPDH基因为内参,使用2-ΔΔCT法分析结果。数据采用SPSS 19.0软件分析,结果采用“平均值±标准差”,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 姜曲海猪ATP2B1基因克隆及序列分析
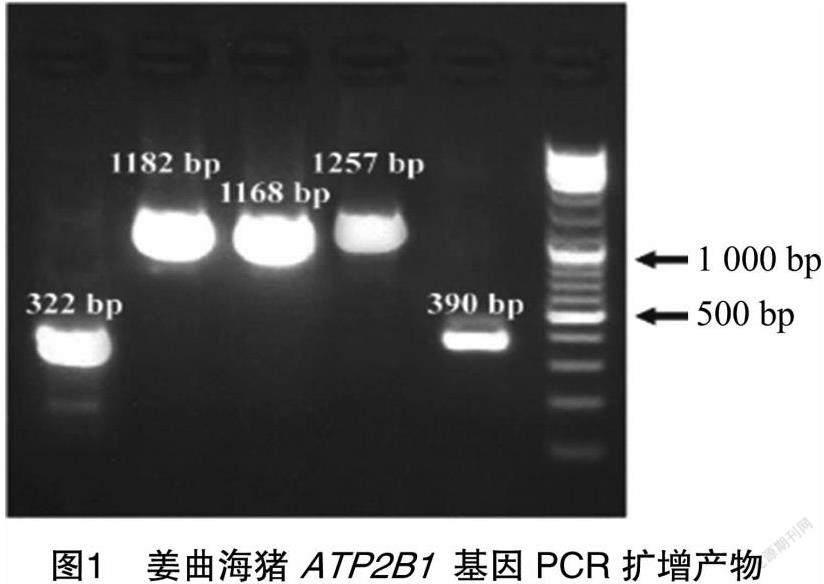
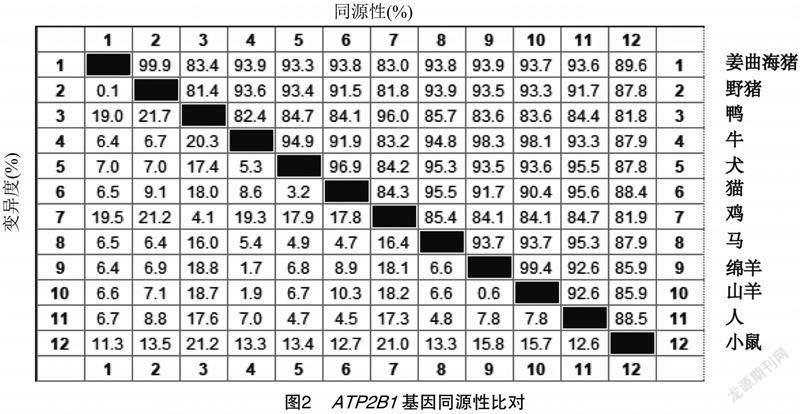
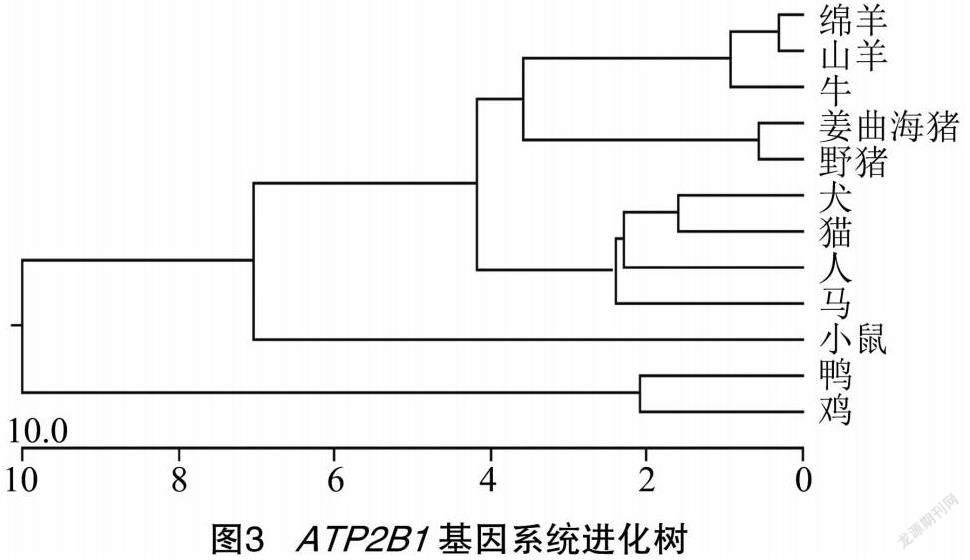
姜曲海猪ATP2B1基因PCR扩增产物的琼脂糖凝胶电泳图(图1)显示,在322、1 182、1 168、1 257、390 bp处分别有单一条带,与预期相符。测序结果显示克隆所得的姜曲海猪ATP2B1基因CDS区长度为3 663 bp,编码1 220个氨基酸。由图2可知,姜曲海猪ATP2B1基因CDS区序列与野猪同源性最高(99.9%),与鸡同源性最低(83.0%);由系统进化树(图3)可知,姜曲海猪与野猪、牛、绵羊、山羊亲缘关系较近,与鸡、鸭亲缘关系较远。
2.2 生物信息学分析
2.2.1 理化性质
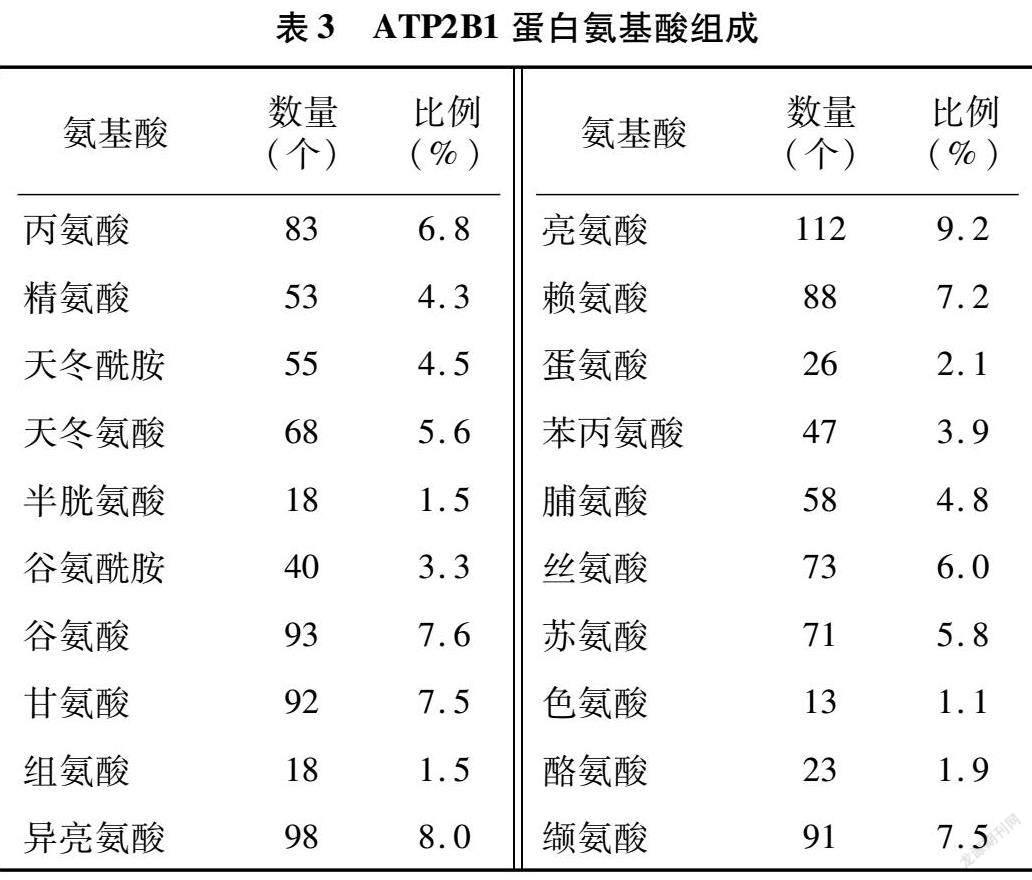
姜曲海猪ATP2B1蛋白分子式为C6 009H9 633N1 611O1 805S44,分子质量约为 134 737.94 u,原子总数为19 102个,理论等电点(pI)为5.63,偏酸性。由表3可知,在组成姜曲海猪ATP2B1蛋白序列的20种氨基酸中,亮氨酸占比最高,为9.2%;色氨酸占比最低,为1.1%;141个氨基酸带正电荷,161个氨基酸带负电荷。姜曲海猪ATP2B1蛋白理论半衰期为30 h(哺乳动物网织红细胞、体外)、>20 h(酵母、体内)、>10 h(大肠杆菌、体内);蛋白不稳定系数为42.97,说明该蛋白为不稳定蛋白;脂溶指数为95.57,表明该蛋白为脂溶性蛋白且流动性好;平均亲水系数(GRAVY)为 -0.156,推测该蛋白为亲水性蛋白。
2.2.2 亚细胞定位
利用PSORT对姜曲海猪ATP2B1蛋白亚细胞定位进行预测,结果(表4)表明,该蛋白分布于细胞膜、高尔基体、细胞核和内质网(膜),概率分别为0.600、0.400、0.320和0.300。
2.2.3 信号肽和跨膜结构域
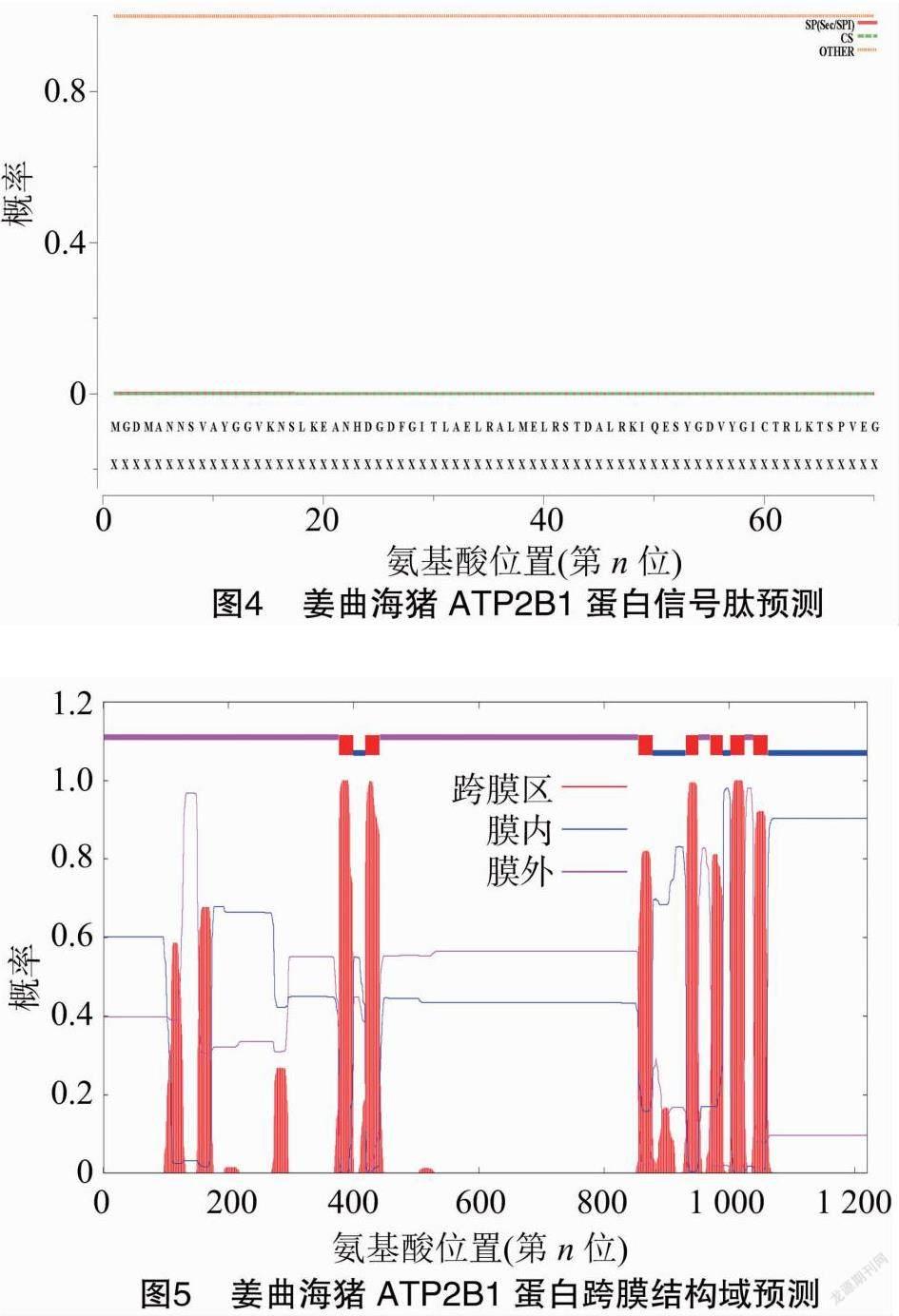
利用SignalP 5.0 server预测姜曲海猪ATP2B1蛋白信号肽,结果(图4)表明,该蛋白无信号肽,说明该蛋白是非分泌蛋白;利用TMHMM预测姜曲海猪ATP2B1蛋白跨膜结构域,由图5可知,该蛋白为跨膜蛋白,有7个跨膜螺旋区,分别位于377~399、419~441、855~877、931~950、970~989、1 002~1 024、1 039~1 061 位氨基酸之间。
2.2.4 疏水性
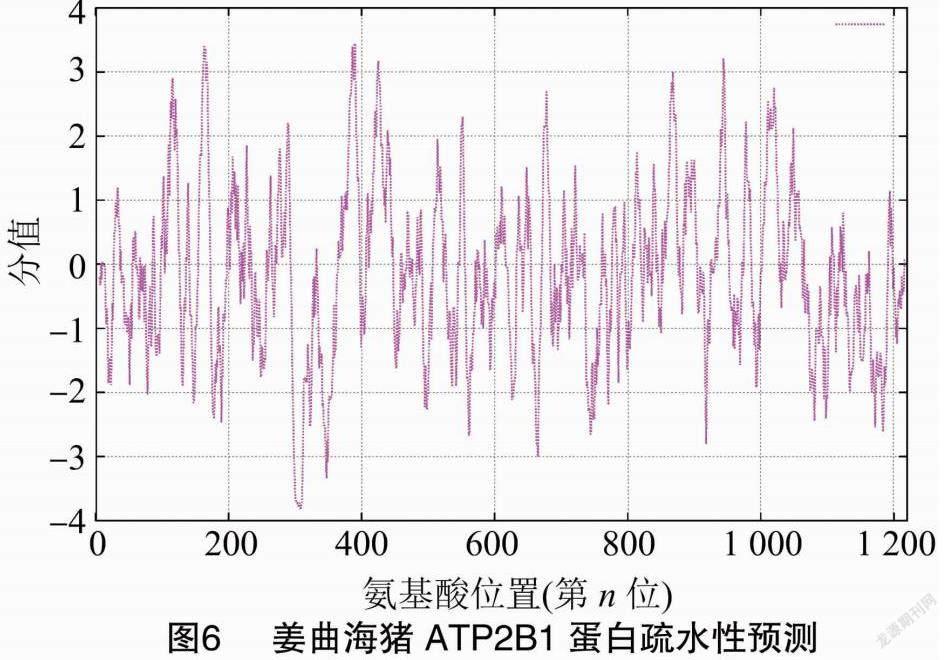
利用Expasy ProtScale对姜曲海猪ATP2B1蛋白进行疏水性预测,结果(图6)表明,最大分值是3.444,为第390位的亮氨酸(Leu),代表其疏水性最强,最小分值是-3.811,为第308位的赖氨酸(Lys),代表其亲水性最强,亲水性氨基酸残基多于疏水性氨基酸残基。
2.2.5 磷酸化位点和N-糖基化位点
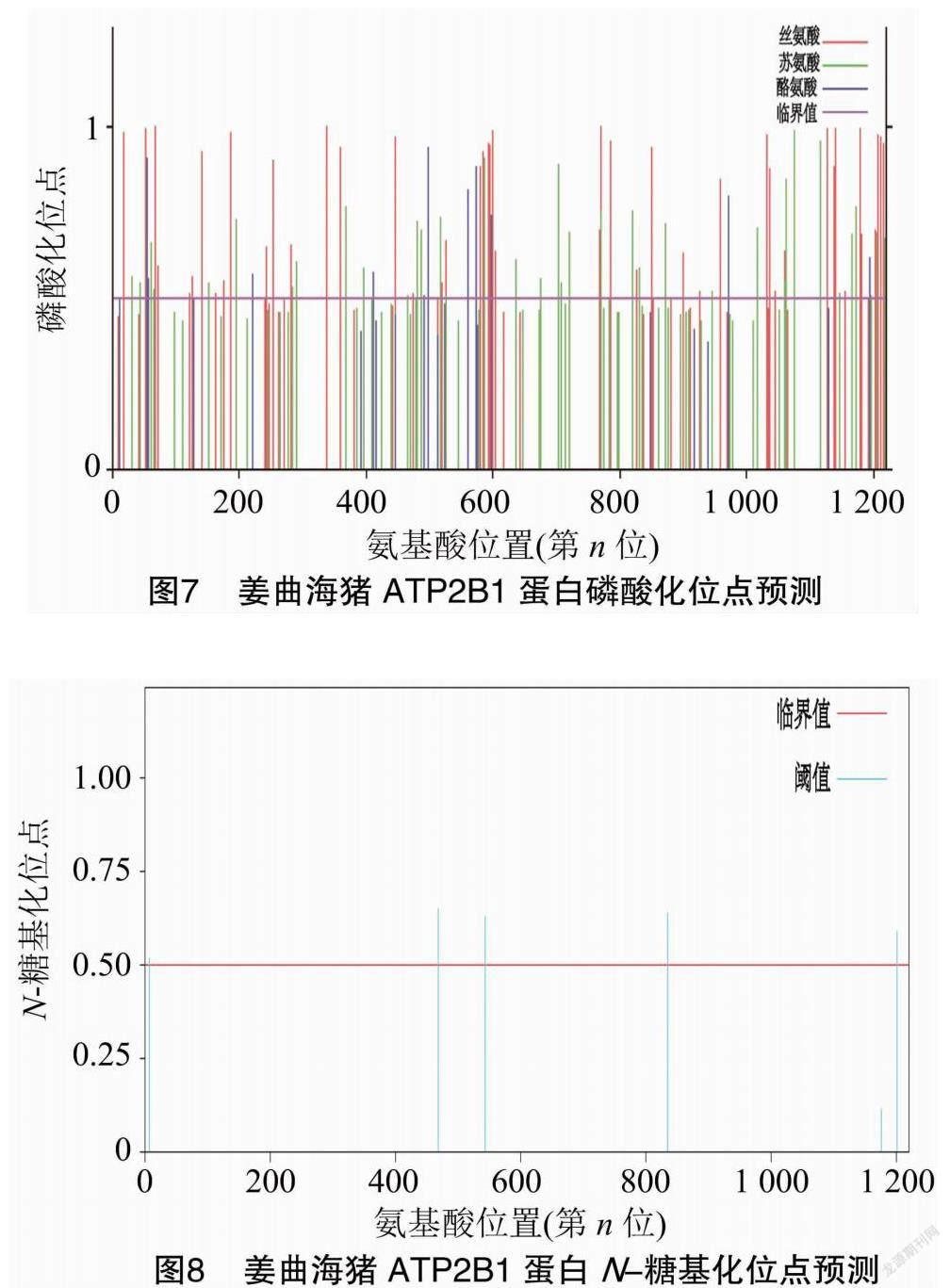
利用NetPhos 3.1和NetNGlyC 1.0分别对姜曲海猪ATP2B1蛋白磷酸化位点和糖基化位点进行预测分析,结果(图7、图8)表明,该蛋白有159个磷酸化位点,存在5个N-糖基化位点,分别位于第6、468、543、834、1 201 位氨基酸处。
2.2.6 二级结构和三级结构
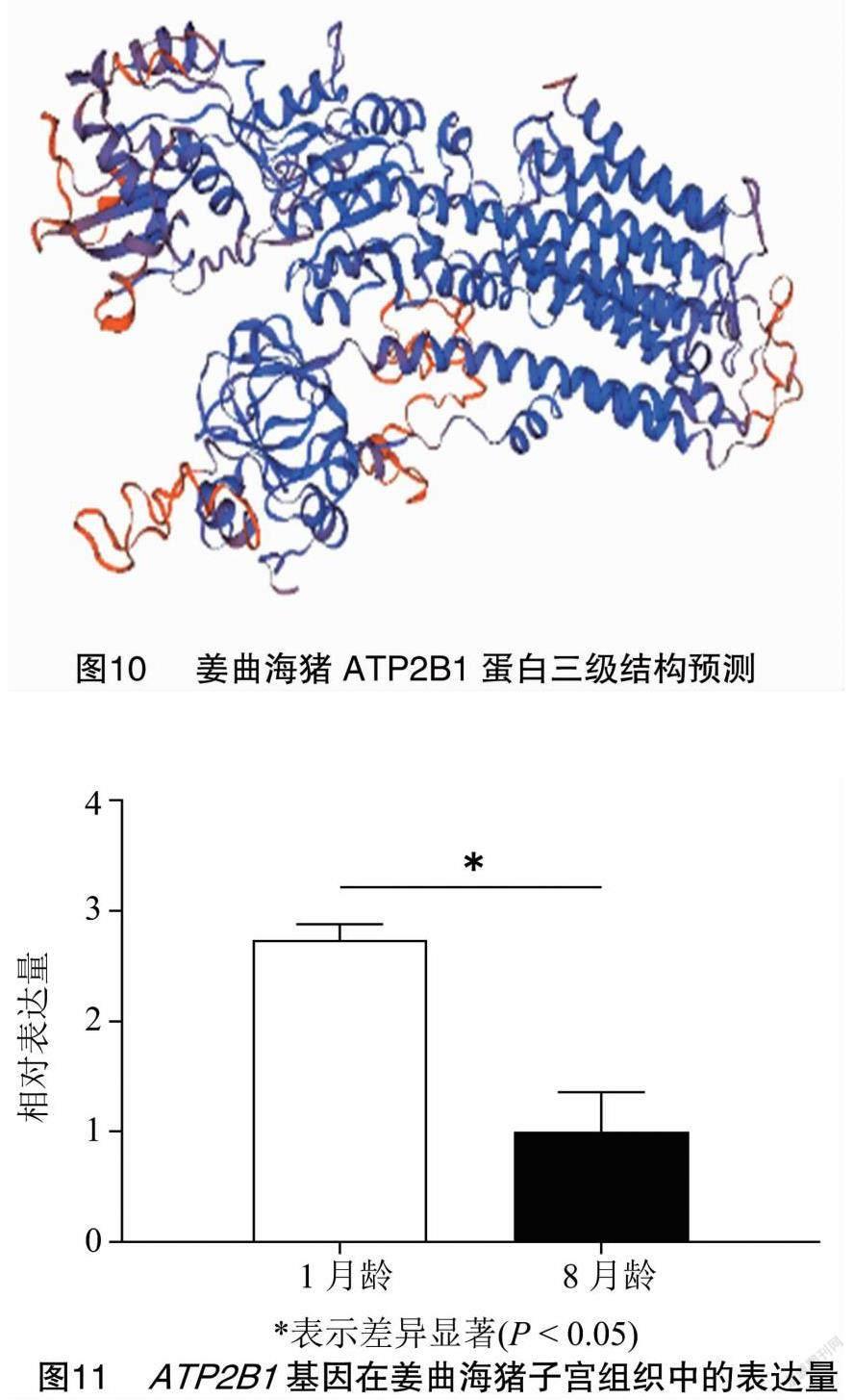
利用SOPMA预测姜曲海猪ATP2B1蛋白二级结构,结果(图9)表明,α-螺旋、β-转角、无规则卷曲和延伸链分别占36.80%、5.74%、39.26%和18.20%。利用SWISS-MODEL构建姜曲海猪ATP2B1蛋白可能的三级结构模型,结果(图10)表明,全局模型质量估计(global model quality estimation,GMQE)值为0.73,且与模板的相似性为99.34。
2.3 ATP2B1基因在1月龄和8月龄姜曲海猪子宫组织中的表达量
利用实时荧光定量PCR技术检测ATP2B1基因在1月龄和8月龄姜曲海猪子宫组织中的表达量,结果(图11)表明,ATP2B1基因在8月龄姜曲海猪子宫组织中的表达量显著低于1月龄姜曲海猪子宫组织(P<0.05)。
3 讨论
猪的繁殖性状主要包括产仔数、初生体质量、断奶体质量等,其中产仔数最为重要。排卵率、受精率、子宫容积、胚胎成活率等是影响产仔数的主要因素,子宫是胚胎发育生长的场所,因此子宫对母猪高产意义重大。钙是哺乳动物骨骼形成、肌肉收缩和胞吐等生理过程中的必要成分,同时,它也是细胞内信号传递的第二信使和细胞黏附分子的激活剂[4-7],在胚胎植入期对滋养外胚层和母体子宫内膜之间的细胞黏附至关重要[8-10]。ATP2B1基因在细胞内钙动态平衡中起关键作用。
本研究以高繁殖力的姜曲海猪子宫组织为材料,克隆出ATP2B1基因的CDS区,进行了相关生物信息学分析和组织表达分析。同源性比对结果显示,姜曲海猪ATP2B1基因CDS区序列与野猪、牛、羊等哺乳动物同源性较高,与鸡、鸭等非哺乳动物同源性较低;系统进化树显示,姜曲海猪与野猪、牛、羊等哺乳动物亲缘关系较近,与鸡、鸭等非哺乳动物亲缘关系较远,验证了同源性比对的结果。潘鹏丞等研究发现,陆川猪与野猪、牛、绵羊同源性较高、亲缘关系较近,与原鸡同源性较低、亲缘关系较远[11]。这2项研究结果相似,其原因是地方猪与野猪属于同一个物种,猪和牛、羊均属于偶蹄目。亚细胞定位显示姜曲海猪ATP2B1蛋白分布于细胞膜的概率为0.600,且跨膜结构域预测结果显示该蛋白为跨膜蛋白,有7个跨膜螺旋区。Yang等通过免疫组化分析发现ATP2B1基因在子宫内膜上皮层和腺上皮细胞中大量表达[12];Choi等通过原位杂交分析表明,ATP2B1基因主要定位于子宫内膜腔上皮、腺上皮和基质细胞[13]。由此可推测,ATP2B1基因可能通過调节子宫内膜钙离子浓度而在妊娠的建立和维持中发挥重要作用。
除了在細胞内钙动态平衡中起关键作用,ATP2B1基因还对血管平滑肌收缩及血压起重要作用[14]。ATP2B1基因是高血压的重要候选基因,是第一个在针对高血压的不同全基因组关联分析研究中交叉验证的基因。Levy等通过全基因组关联分析发现ATP2B1基因多态与收缩压、舒张压和高血压显著相关[15],该结果也在欧洲和亚洲人群中得到验证[16-20]。子痫是一种妊娠期严重的高血压疾病,是胎儿死亡的重要原因之一。该疾病可能与肥胖、高龄、外部环境和其他因素有关[21-22]。此外,遗传性慢性高血压也可能是该病的重要原因。多项研究表明,ATP2B1基因多态性与子痫的发生密切相关[23-24]。Kobayashi等使用Cre-loxP系统培育了血管平滑肌细胞特异性敲除ATP2B1基因小鼠,相比野生型小鼠,ATP2B1基因敲除小鼠的血管平滑肌细胞内钙离子水平及收缩压上升[25]。这些结果表明,ATP2B1基因通过改变血管平滑肌细胞的钙转运和血管收缩来调节血压。此外,ATP2B1基因的2个拷贝丢失会导致胚胎死亡[26]。本研究中ATP2B1基因在8月龄姜曲海猪子宫组织中的表达量显著低于1月龄姜曲海猪子宫组织,提示ATP2B1基因可能影响姜曲海猪繁殖性状。
4 结论
本研究以姜曲海猪子宫组织为材料,成功克隆了姜曲海猪ATP2B1基因CDS区,长度为3 663 bp,编码1 220个氨基酸,与野猪同源性最高、亲缘关系最近。姜曲海猪ATP2B1蛋白分子质量约为 134 737.94 u,原子总数为19 102个,理论等电点(pI)为5.63,带正电荷和负电荷的氨基酸数分别为141个和161个。该蛋白最可能位于细胞膜上,为跨膜、非分泌型疏水蛋白质,有159个磷酸化位点和5个N-糖基化位点,无规则卷曲在预测的二级结构中占比最大。ATP2B1基因在8月龄姜曲海猪子宫组织中的表达量显著低于1月龄姜曲海猪子宫组织,说明该基因可能影响姜曲海猪繁殖性状。
参考文献:
[1]Xu P,Ni L,Tao Y,et al. Genome-wide association study for growth and fatness traits in Chinese Sujiang pigs[J]. Animal Genetics,2020,51(2):314-318.
[2]Peng J B,Brown E M,Hediger M A. Apical entry channels in calcium-transporting epithelia[J]. News in Physiological Sciences,2003,18:158-163.
[3]Ma X,Li P,Zhang Q,et al. Transcriptome analysis of the endometrium from Chinese Erhualian sows that differ in calcium ion concentration and litter size[J]. Animal Genetics,2019,50(4):326-333.
[4]Hirano S,Nose A,Hatta K,et al. Calcium-dependent cell-cell adhesion molecules (cadherins):subclass specificities and possible involvement of actin bundles[J]. The Journal of Cell Biology,1987,105(6 Pt 1):2501-2510.
[5]Kemler R,Ozawa M,Ringwald M. Calcium-dependent cell adhesion molecules[J]. Current Opinion in Cell Biology,1989,1(5):892-897.
[6]Berridge M J,Bootman M D,Roderick H L. Calcium signalling:dynamics,homeostasis and remodelling[J]. Nature Reviews Molecular Cell Biology,2003,4(7):517-529.
[7]Long Y,Xia J Y,Chen S W,et al. ATP2B1 gene silencing increases insulin sensitivity through facilitating Akt activation via the Ca2+/calmodulin signaling pathway and Ca2+-associated eNOS activation in endothelial cells[J]. International Journal of Biological Sciences,2017,13(9):1203-1212.
[8]Wang J,Mayernik L,Armant D R. Integrin signaling regulates blastocyst adhesion to fibronectin at implantation:intracellular calcium transients and vesicle trafficking in primary trophoblast cells[J]. Developmental Biology,2002,245(2):270-279.
[9]Jha R K,Titus S,Saxena D,et al. Profiling of E-cadherin,β-catenin and Ca2+in embryo-uterine interactions at implantation[J]. FEBS Letters,2006,580(24):5653-5660.
[10]Li H Y,Shen J T,Chang S P,et al. Calcitonin promotes outgrowth of trophoblast cells on endometrial epithelial cells:involvement of calcium mobilization and protein kinase C activation[J]. Placenta,2008,29(1):20-29.
[11]潘鵬丞,温斌华,谢 婉,等. 陆川猪PDK4基因序列分析、真核表达载体构建及组织表达分析[J]. 中国畜牧兽医,2020,47(8):2337-2347.
[12]Yang H,Choi K C,Hyun S H,et al. Coexpression and estrogen-mediated regulation of TRPV6 and PMCA1 in the human endometrium during the menstrual cycle[J]. Molecular Reproduction and Development,2011,78(4):274-282.
[13]Choi Y,Seo H,Shim J,et al. Calcium extrusion regulatory molecules:differential expression during pregnancy in the porcine uterus[J]. Domestic Animal Endocrinology,2014,47:1-10.
[14]Tabara Y,Kohara K,Miki T. Hunting for genes for hypertension:the millennium genome project for hypertension[J]. Hypertension Research,2012,35(6):567-573.
[15]Levy D,Ehret G B,Rice K,et al. Genome-wide association study of blood pressure and hypertension[J]. Nature Genetics,2009,41(6):677-687.
[16]Newton-Cheh C,Johnson T,Gateva V,et al. Genome-wide association study identifies eight loci associated with blood pressure[J]. Nature Genetics,2009,41(6):666-676.
[17]Cho Y S,Go M J,Kim Y J,et al. A large-scale genome-wide association study of Asian populations uncovers genetic factors influencing eight quantitative traits[J]. Nature Genetics,2009,41(5):527-534.
[18]Tabara Y,Kohara K,Kita Y,et al. Common variants in the ATP2B1 gene are associated with susceptibility to hypertension[J]. Hypertension,2010,56(5):973-980.
[19]Lu X F,Wang L Y,Lin X,et al. Genome-wide association study in Chinese identifies novel loci for blood pressure and hypertension[J]. Human Molecular Genetics,2014,24(3):865-874.
[20]Takeuchi F,Akiyama M,Matoba N,et al. Interethnic analyses of blood pressure loci in populations of East Asian and European descent[J]. Nature Communications,2018,9:5052.
[21]Dong X Y,Nao J F.Influential factors and clinical significance of an atypical presentation of posterior reversible encephalopathy syndrome in patients with eclampsia[J]. Neurological Sciences,2019,40(2):377-384.
[22]Macuácua S,Catalo R,Sharma S,et al. Policy review on the management of pre-eclampsia and eclampsia by community health workers in Mozambique[J]. Human Resources for Health,2019,17(1):15.
[23]Sun X M,Yang M,Jiang C X. Association of ATP2B1 gene polymorphism with incidence of eclampsia[J]. European Review for Medical and Pharmacological Sciences,2019,23(24):10609-10616.
[24]Zhou Z Y,Wang X J,Chen G Z.ATP2B1 gene rs71454161,rs73196661 and rs73196675 polymorphisms in eclampsia[J]. European Review for Medical and Pharmacological Sciences,2022.
[25]Kobayashi Y,Hirawa N,Tabara Y,et al. Mice lacking hypertension candidate gene ATP2B1 in vascular smooth muscle cells show significant blood pressure elevation[J]. Hypertension,2012,59(4):854-860.
[26]Okunade G W,Miller M L,Pyne G J,et al. Targeted ablation of plasma membrane Ca2+-ATPase (PMCA) 1 and 4 indicates a major housekeeping function for PMCA1 and a critical role in hyperactivated sperm motility and male fertility for PMCA4[J]. Journal of Biological Chemistry,2004,279(32):33742-33750.
