腐殖酸对盐胁迫下山定子砧苹果嫁接苗的缓解效应
2023-05-23曹依静逯韵赵莉霞张红飞刘利民赵红亮孙昂聂琳卢航
曹依静 逯韵 赵莉霞 张红飞 刘利民 赵红亮 孙昂 聂琳 卢航
摘要:为探究腐殖酸对盐胁迫下苹果嫁接苗生长是否有缓解作用及其作用机理,以山定子作砧木、金冠作接穗的嫁接苗为试材,采用盆栽方式模拟盐渍化土壤环境,研究腐殖酸对盐胁迫下苹果嫁接苗根系构型、抗氧化保护酶活性、光合色素、光合参数及矿质元素含量的影响。结果表明:单纯盐胁迫T1处理能够显著降低苹果嫁接苗根系总长度、根系平均直径、根尖数、根系表面积、根系体积和根系活力,而腐殖酸能够缓解NaCl对苹果嫁接苗根系形态建成和根系活力的抑制作用,且以腐殖酸浓度400 mg/L时效果最佳。单纯盐胁迫T1处理通过显著降低苹果嫁接苗根系SOD、POD、CAT和APX活性,增加MDA含量,打破机体活性氧产生与清除机制的动态平衡,而腐殖酸能够提升根系抗氧化酶活性、降低MDA含量以减轻活性氧积累对抗氧化酶保护体系的破坏作用。腐殖酸能够缓解NaCl对叶绿素a、叶绿素b和叶绿素(a+b)的抑制作用,但腐殖酸对盐胁迫下叶绿素含量的缓解作用随其浓度的增加呈现先升高后降低的单峰变化规律,叶绿素a含量/叶绿素b含量在总体上与叶绿素含量呈现负相关关系。单纯盐胁迫T1处理能够显著降低苹果嫁接苗净光合速率和水分利用效率,增加气孔限制值,而腐殖酸能够较好地缓解盐胁迫对苹果嫁接苗光合性能和水分利用效率的抑制作用并降低气孔限制值,且以腐殖酸浓度400 mg/L时效果最佳。单纯盐胁迫T1处理能够显著增加苹果嫁接苗地下部和地上部Na+含量,显著降低地下部、地上部K+、Ca2+含量和K+含量/Na+含量、Ca2+含量/Na+含量,而腐殖酸能够通过降低植株机体Na+含量,增加K+含量、Ca2+含量和K+含量/Na+含量 、Ca2+含量/Na+含量来缓解Na+对根系的离子毒害作用,并促进Na+与K+、Ca2+间的离子稳态。可见,适宜浓度的腐殖酸(400 mg/L)能够通过促进根系形态建成,增加根系活力和叶绿素含量,提高抗氧化保护酶活性和光合能力、水分利用效率,加大矿质元素吸收等机制增强耐盐性能,实现山定子砧苹果树苗在盐碱地的种植。
关键词:腐殖酸;盐胁迫;嫁接苗;根系构型;叶绿素;光合参数;保护酶;矿质元素
中图分类号:S661.101 文献标志码:A
文章编号:1002-1302(2023)08-0124-07
基金项目:国家现代苹果产业技术体系项目(编号:CARS-27)。
作者简介:曹依静(1987—),女,河南商丘人,硕士,助理研究员,主要从事果树逆境生理栽培研究。E-mail:874009322@qq.com。
通信作者:赵莉霞,高级农艺师,主要从事植物逆境生理生态栽培研究。E-mail:874009322@qq.com。
据统计,盐渍化土壤约占全球灌溉土壤的 1/5[1]、陆地面积的1/10,其中我国盐渍化土地面积约为3 600万hm2,可见盐渍化已成为全球性的资源与环境问题。土壤盐渍化产生的渗透胁迫、离子毒害、次级反应及矿质养分失衡等因素严重影响植株的生理代谢过程,进而降低作物的产量和品质[2],这给农业生产、生态环境与可持续发展带来严重的不利影响。但通过施用生物菌肥、改良土壤结构、选择抗盐砧木、選育耐盐品种等措施,也可以在一定水平上实现盐碱地的农作物栽培。这些措施虽然可行,但也有一定的局限性,即对栽培管理水平要求高、耐盐品种选育时间长等。
山定子是优良的苹果砧木,其优点是抗寒性极强,根系发达耐贫瘠,与苹果接穗亲和性好,结果早、产量高,缺点是不耐盐碱。山定子砧苹果树在盐碱地种植后常常表现出叶片薄而小,叶色失绿甚至发黄,移栽成活率低等特点,这使得山定子砧苹果树难以在盐碱地发挥早熟优质高产的优势,也在一定程度上制约了盐碱地果树的种植面积。腐殖酸是一类主要由C、H、O、N等元素组成的高分子有机物质[3],含有芳香族、酚基、羧基等多种官能团,具有较强的吸附、络合、交换功能[4],对增强植物抗逆性、促进植株生长发育、改善作物品质、改良土壤结构有显著作用[5-6]。吴佳利研究表明,腐殖酸可通过提高黏质盐土含水量、降低黏质盐土含盐量、改善黏质盐土离子组成、增加黏质盐土有机碳含量等方式提高盐胁迫下的小麦产量[7]。马太光等研究指出,腐殖酸能够有效缓解NaCl胁迫对西葫芦胚轴和根系生长的抑制作用,并提高西葫芦种子的抗盐性[8]。郭伟等研究得出,腐殖酸浸种能够有效缓解盐胁迫对小麦生长的影响[9]。但当前有关腐殖酸对盐胁迫下果树生长状况、生理特性等方面的研究报道较少,而有关腐殖酸对盐胁迫下山定子砧苹果树形态指标及生理指标方面的研究尚未见报道。为此,本试验以山定子砧苹果树苗为试材,借助盆栽的方式模拟盐渍化土壤环境,研究腐殖酸对盐胁迫环境下苹果嫁接苗根系构型、抗氧化保护酶活性、光合色素、光合参数及矿质元素含量的影响,探究腐殖酸提高山定子砧苹果树的耐盐机制,以期为提高盐碱地土壤苹果树的生产提供理论依据,同时为其他作物在盐碱地的种植提供资料参考。
1 材料与方法
1.1 试验材料
试验材料以山定子[Malus baccata (L.) Borkh]为嫁接砧木,金冠为接穗。
1.2 试验设计及方法
2020年1月将山定子种子在4 ℃冰箱内层积处理至2/3种子露白时,播种于苗床内,待幼苗5~6张叶时移栽至大田,8月份进行芽接。
2021年3月采用盆栽土培的方式进行试验,盆直径30 cm、高40 cm,每盆装土25 kg。大田土壤全氮、速效磷、速效钾含量分别为0.41 g/kg、3.86 mg/kg、79.35 mg/kg,pH值6.82,EC值557.61 μS/cm。试验设置1个对照和5个处理,其中以大田土为对照(CK),以50 mmol/L NaCl的大田土为处理1(T1)、50 mmol/L NaCl+100 mg/L腐殖酸的大田土为处理2(T2)、50 mmol/L NaCl+200 mg/L腐殖酸的大田土为处理3(T3)、50 mmol/L NaCl+400 mg/L腐殖酸的大田土为处理4(T4)、50 mmol/L NaCl+800 mg/L 腐殖酸的大田土为处理5(T5)。NaCl浓度50 mmol/L的大田土配制方法:按50 mmol/L的比例往大田土中添加NaCl,充分混匀后装入花盆。T2、T3、T4、T5处理为在移栽后分别按设计的浓度浇灌2 L腐殖酸溶液。腐殖酸购自上海麦克林生化科技有限公司。对照和处理均进行3次重复,每3盆作1次重复,共计54盆。4月10日进行相关指标测定。
1.3 测定项目及方法
根系总长度、根系平均直径、根尖数、根系表面积和根系体积均采用万深 LA-S 系列植物图像分析仪系统进行测定。根系活力采用氯化三苯基四氮唑还原法(TTC 法)[10]进行测定。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量分别采用氮蓝四唑光化还原法、愈创木酚比色法、高锰酸钾滴定法、硫代巴比妥酸法[11]进行测定。抗坏血酸过氧化物酶(APX) 活性参照Nakano等的方法[12]进行测定。叶绿素含量参照高俊凤的方法[13]进行测定。
在晴天09:30—10:30,使用便携式光合作用仪 LI-6800对苹果叶片的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间二氧化碳浓度(Ci)进行测定,测定时外界CO2浓度为(390±10) μmol/mol,叶室温度为(27±1) ℃。叶片水分利用效率(WUE)的计算公式为WUE=Pn/Tr[14]。气孔限制值(Ls)=1- Ci/Ca,式中:Ca为空气中CO2浓度。Na+、K+、Ca2+等离子含量采用原子吸收分光光度计法[15]进行测定。
1.4 数据处理与分析
使用Excel 2007进行数据整理和作图,用SPSS 26.0软件对数据进行统计学分析,采用最小显著极差法(LSR法)对数据进行多重比较。
2 结果与分析
2.1 腐殖酸对盐胁迫下苹果嫁接苗根系构型的影响
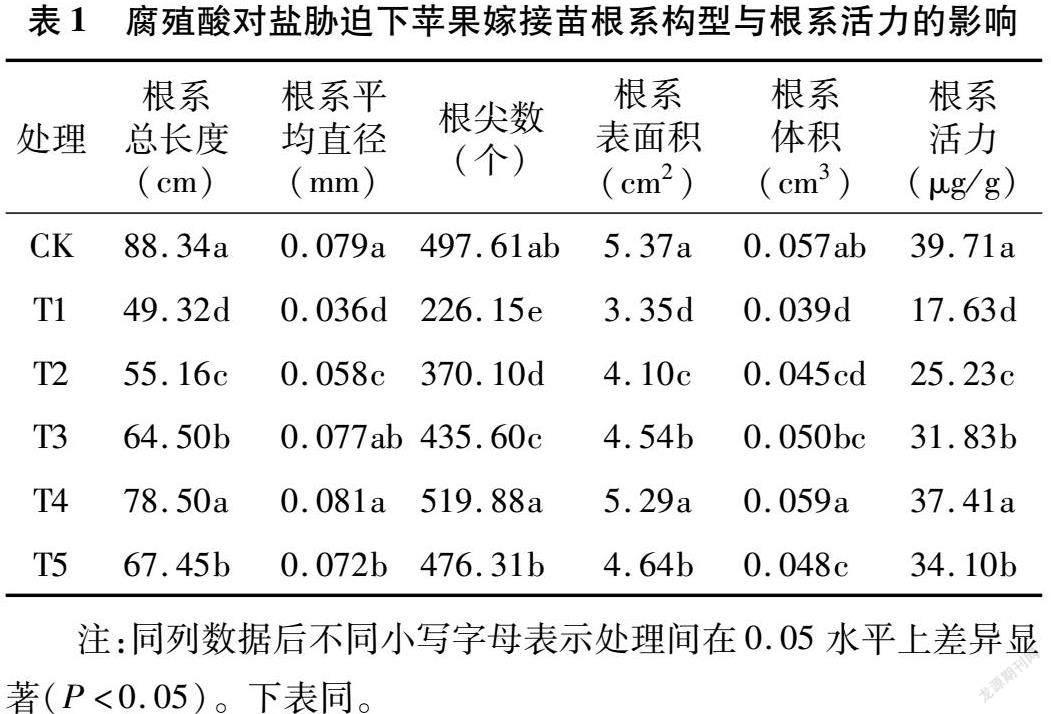
由表1可知,与对照相比,盐胁迫T1处理能够显著降低苹果嫁接苗根系总长度、根系平均直径、根尖数、根系表面积和根系体积,较CK分别降低44.17%、54.43%、54.55%、37.62%、31.58%,表明盐胁迫T1处理能够显著抑制苹果嫁接苗根系的形态建成。当腐殖酸浓度为0~400 mg/L(T1~T4处理)时,苹果嫁接苗根系总长度、根系平均直径、根尖数、根系表面积和根系体积均随着腐殖酸浓度的增加而增加,至400 mg/L时值最大,与T1处理差异显著(P<0.05);当腐殖酸浓度达到800 mg/L时,上述指标虽高于T1处理,但均显著低于T4处理,这说明腐殖酸能够缓解NaCl对苹果嫁接苗根系生长的抑制作用,但这种缓解作用受腐殖酸浓度的影响,表现为低浓度促进高浓度抑制。盐胁迫T1处理显著降低了蘋果嫁接苗的根系活力,腐殖酸能够缓解盐胁迫对根系活力的抑制作用,且以腐殖酸浓度400 mg/L时效果较好,较T1处理显著提高112.20% (P<0.05);T4处理虽低于对照,但与对照差异不显著,表明腐殖酸能够有效提高盐胁迫下的苹果嫁接苗根系活力。
2.2 腐殖酸对盐胁迫下苹果嫁接苗叶绿素含量的影响
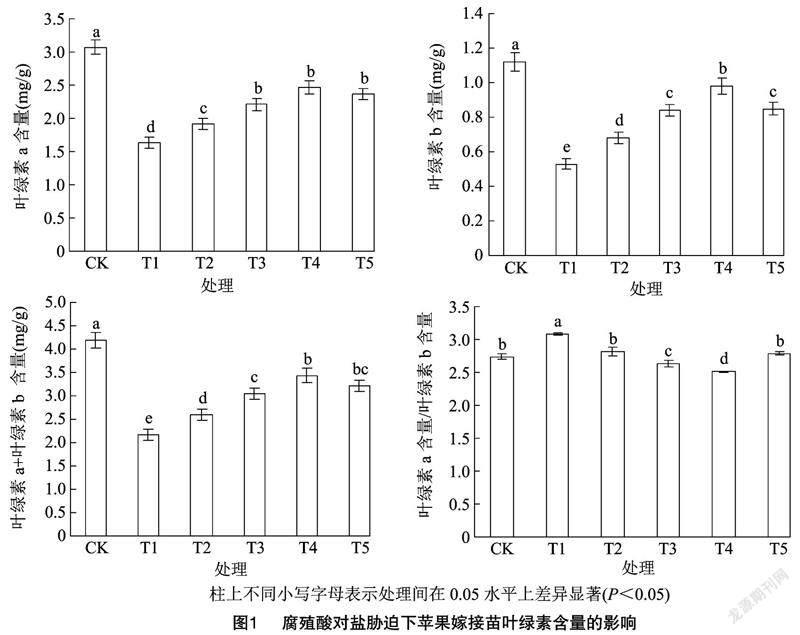
由图1可以看出,5个盐胁迫处理下的叶绿素含量与对照相比均显著降低,且以T1处理下叶绿素a、叶绿素b和叶绿素(a+b)含量降幅最大,表明盐胁迫能够降低苹果叶片叶绿素含量。添加有腐殖酸的T2、T3、T4、T5处理的叶绿素含量均高于T1处理,表明腐殖酸能够在一定程度上缓解NaCl对苹果嫁接苗叶绿素的降解作用。另外,随腐殖酸含量的增加叶绿素含量呈现先升高后降低的单峰变化规律。叶绿素a含量/叶绿素b含量以T1处理值最大,且随着腐殖酸含量的增加呈现先降低后升高的变化规律,可见叶绿素a含量/叶绿素b含量在总体上与叶绿素含量呈现负相关关系。
2.3 腐殖酸对盐胁迫下苹果嫁接苗光合参数的影响
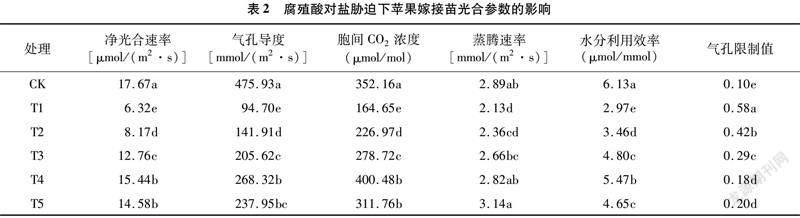
由表2可知,盐胁迫T1处理能够显著降低苹果嫁接苗的光合能力和水分利用效率,增加气孔限制值,其净光合速率、气孔导度、胞间CO2浓度、蒸腾速率和水分利用效率较CK分别显著降低64.23%、80.10%、53.25%、26.30%、51.55%,气孔限制值较CK显著增加480.00%(P<0.05),说明盐胁迫能够显著降低苹果嫁接苗的气孔导度,致使光合底物CO2分压降低,胞间CO2浓度随之减小,进而引起净光合速率下降。腐殖酸能够较好地缓解盐胁迫对苹果嫁接苗光合性能的抑制作用并降低气孔限制值,添加有腐殖酸的T2、T3、T4、T5处理其净光合速率、气孔导度、胞间CO2浓度、蒸腾速率和水分利用效率均不同程度地高于T1处理,气孔限制值均低于T1处理。随着腐殖酸浓度的增加,净光合速率、气孔导度、胞间CO2浓度、蒸腾速率和水分利用效率均表现为先升高再降低的变化规律,且以T4处理值最大,其中T4处理净光合速率和水分利用效率较盐胁迫T1处理分别增加144.30%和84.18%;气孔限制值表现出先降低再升高的变化规律,且以T4处理下值最小,较T1处理降低68.97%,这表明适宜浓度的腐殖酸更能够有效提高盐胁迫下苹果嫁接苗的光合性能、水分利用效率,并降低气孔限制值。
2.4 腐殖酸对盐胁迫下苹果嫁接苗根系抗氧化酶活性的影响
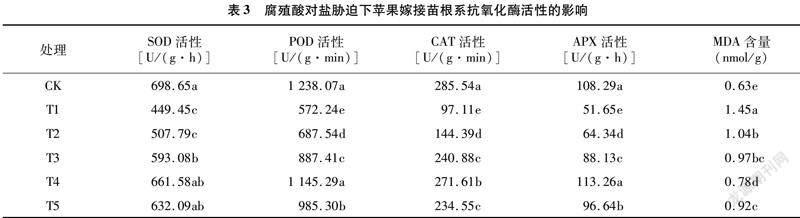
由表3可以得出,盐胁迫T1处理能够显著降低苹果嫁接苗的根系抗氧化酶活性,其SOD、POD、CAT和APX活性较CK分别降低35.67%、53.78%、65.99%、52.30%。添加不同浓度腐殖酸的T2、T3、T4、T5处理下的抗氧化酶活性均高于T1处理,且随腐殖酸浓度的增加呈现先升高后降低的单峰变化规律,尤以T4处理下的SOD、POD、CAT和APX活性较高,较T1处理分别显著增加47.20%、100.14%、179.69%、119.28%(P<0.05),表明腐殖酸对盐胁迫有一定的缓解作用,但不是腐殖酸浓度越高越好。盐胁迫T1处理下,MDA含量显著高于对照CK,较对照增加130.16%,而添加腐殖酸的4个处理MDA含量均显著低于T1处理,其中T4处理较T1处理降低46.21%,说明盐胁迫造成的苹果嫁接苗MDA含量的增加可在一定水平上被腐殖酸缓解。
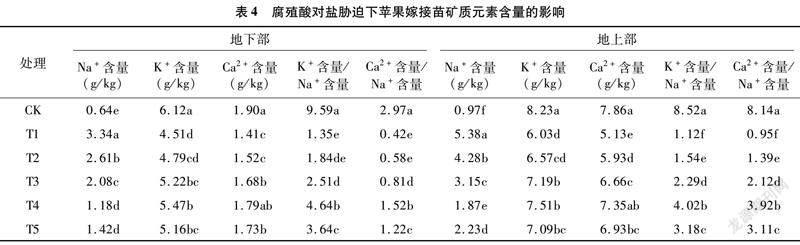
2.5 腐殖酸对盐胁迫下苹果嫁接苗矿质元素含量的影响
由表4可以得出,盐胁迫T1处理能够显著增加苹果嫁接苗地下部和地上部Na+含量,显著降低地下部、地上部K+、Ca2+含量和K+含量/Na+含量 、Ca2+含量/Na+含量,而腐殖酸能够在一定程度上抑制苹果嫁接苗地下部和地上部Na+含量的增加,并在一定程度上增加盐胁迫下苹果嫁接苗地下部、地上部K+、Ca2+含量和K+/Na+含量、Ca2+含量/Na+含量。单纯盐胁迫T1处理的地下部Na+含量较CK显著增加421.88%(P<0.05),而K+、Ca2+含量和K+含量/Na+含量、Ca2+含量/Na+含量较对照分别显著降低26.31%、25.79%、85.92%、85.86%(P<0.05),这表明地下部根系遭受Na+毒害且Na+与K+、Ca2+间的离子稳态被破坏。添加腐殖酸的T2至T5处理地下部Na+含量均低于T1处理,其中T4处理较T1处理显著降低64.67%(P<0.05);T4处理K+、Ca2+含量和K+含量/Na+含量、Ca2+含量/Na+含量均显著高于T1处理,分别显著增加21.29%、26.95%、243.70%和261.90%(P<0.05),表明腐殖酸能够减轻Na+对根系的离子胁迫,并有利于保持Na+与K+、Ca2+间的离子稳态。盐胁迫对地上部矿质元素含量的影响与地下部类似。另外,地上部的Na+、K+、Ca2+含量均对应高于地下部,表明根系吸收的元素离子更多地被运送到苹果植株的地上部。
3 讨论与结论
根系是植物从外界获取养分与水分的主要器官[16],也是植物最先感知土壤逆境胁迫和最先受到伤害的器官。盐胁迫下植株地下部表现为生长量降低、侧根数量减少、根干鲜质量下降,根系生长受到抑制[17]。腐殖酸能够通过影响植株根系侧根数量、根系细胞类型与数量、根系直径对根系生长和根系构型进行调控。赵振东等研究发现,适宜浓度的腐殖酸能够有效促进水稻根尖数、根长与地下部干质量的增加[18]。马太光等研究得出,高活性的腐殖酸能够有效缓解NaCl对西葫芦根系和下胚轴生长的抑制作用[19]。本试验结果表明,腐殖酸浓度不高于400 mg/L时,腐殖酸对NaCl胁迫下的苹果嫁接苗根系的缓解作用随腐殖酸浓度的增加而增大,当腐殖酸浓度达到800 mg/L时缓解作用降低。这可能是因为腐殖酸能够促进转录因子(GRAS1)的表达,而GRAS1是赤霉素和生长素的关键转录因子,赤霉素和生长素为植株根系生长双向调控因子[20-21],这使得腐殖酸对盐胁迫下嫁接苗苹果根系的缓解作用表现为低浓度促进高浓度抑制。盐胁迫能够显著抑制苹果嫁接苗的根系活力,但腐殖酸能够在一定水平上缓解盐胁迫的抑制作用,增强苹果嫁接苗根系耐盐胁迫能力。
叶绿素是绿色植物进行光合作用的主要场所和物质基础,在植物遭受逆境胁迫时其含量高低常常受到影响[22]。本试验条件下,单纯的NaCl胁迫显著降低了苹果叶片的叶绿素含量,这应该是因为盐胁迫使叶绿素与叶绿体蛋白解离,叶绿素酶活性升高促进叶绿素分解加速,叶绿素含量下降[23]。而在盐胁迫条件下施用腐殖酸的苹果叶片叶绿素含量均显著高于单纯盐胁迫处理,但仍低于对照,这说明在腐殖酸的作用下叶绿素含量下降幅度明显减小,这可能与腐殖酸有利于植株对Fe2+、Mg2+的吸收利用有关,因为Fe2+是叶绿素合成过程中部分酶的活化剂,Fe2+不足导致叶绿素合成受阻,Mg2+是叶绿素的组成成分,Mg2+不足直接制约叶绿素的生成。本试验结果还表明,5个盐胁迫处理下的苹果叶片叶绿素a含量/叶绿素b含量在总体上与叶绿素含量呈现负相关关系,即表现为葉绿素含量高者叶绿素a含量/叶绿素b含量低,叶绿素含量低者叶绿素a含量/叶绿素b含量高,试验结果与周黄磊等在水稻上的研究结论[24]一致,但刘行等在金露梅上的研究结果为盐胁迫下叶绿素含量与叶绿素a含量/叶绿素b含量表现出单一的变化趋势[25],可见不同植物对盐胁迫的响应表现为多态性,这可能与植物自身遗传特效、耐盐水平、试验所设置的盐浓度等因素存在差异有关。
光合作用是绿色高等植物生长发育及生物质能的物质基础,因此提高光合作用的效率是作物获得高产的前提,但植物的光合能力还受除自身遗传特性制约之外的温度、光照、水分、盐浓度等外界环境因素的影响。研究表明,盐胁迫能够降低植物的光合能力,而光合能力下降的原因主要由气孔因素和非气孔因素限制引起[26],也与叶绿素含量降低有关[27],或者是几种因素的共同作用。本试验结果表明,盐胁迫T1处理能够使苹果嫁接苗净光合速率、气孔导度和胞间CO2浓度显著下降,气孔限制值显著升高,叶绿素含量显著降低,因此在0.4%的盐浓度条件下引起的苹果嫁接苗净光合速率的降低应该是由气孔限制因素所致[28],同时还与叶绿素含量减少有关。另外,盐胁迫能够导致磷酸稀醇式丙酮酸(PEP)羧化酶与核酮糖 1,5-二磷酸羧化酶(Rubisco)活性的降低,这2种酶与光合作用密切相关,其活性的下降能够减少植物对CO2底物的吸收利用,进而降低光合强度[29]。气孔导度的下降应该是因为盐胁迫提高了叶片中Na+、Cl-含量,降低了K+含量,使气孔因防止叶片过度失水而关闭,同时还可能与盐胁迫信号刺激脱落酸在叶片中积累有关,因为脱落酸可诱导气孔的关闭[30]。适宜浓度的腐殖酸能够提高盐胁迫条件下苹果嫁接苗叶片的光合性能,且400 mg/L时气孔导度、胞间CO2浓度显著高于单纯盐胁迫处理T1,净光合速率亦显著高于T1,这说明腐殖酸能够在一定程度上降低CO2扩散阻力,减少盐胁迫引发的气孔限制,从而减弱净光合速率的下降水平。但当腐殖酸浓度达到 800 mg/L 时光合能力不升反降,这说明腐殖酸对苹果叶片净光合速率的促进作用存在一定的阈值。腐殖酸能够提高盐胁迫条件下苹果嫁接苗的水分利用效率,这表明腐殖酸能够提高苹果嫁接苗的耐盐能力,增强抗逆性。
植物在逆境胁迫下会启动抗氧化防御系统,SOD、POD、CAT、APX是植物体内抗氧化防御系统的关键酶,其对活性氧的清除能力直接影响植物抗逆性的强弱[31]。本研究结果表明,盐胁迫T1处理能够显著降低苹果嫁接苗根系保护酶SOD、CAT、POD和APX的活性,表明盐胁迫打破了苹果嫁接苗机体内活性氧产生与消除的动态平衡,对膜系统产生损伤,不利于后期生长,与周丹丹等在朴树上的研究结论[32]一致,但与廖科等在凤仙花上的结论[33]不一致,可见不同植株对盐胁迫的响应并不完全一致,这应该与植物自身遗传特性、耐盐性、盐浓度等诸多因素有关。腐殖酸能够缓解苹果嫁接苗生长的不利环境,低浓度的腐殖酸能够提高盐胁迫下上述酶的活性,但高浓度的腐殖酸却又能够降低上述酶的活性,试验结果与马太光等在西葫芦上的研究结论[19]一致,这可能是因为低浓度的腐殖酸对植物有刺激作用,提高了植物的抗逆性,促进了保护酶活性的升高,而高浓度的腐殖酸对植物产生了胁迫作用,自由基含量增加幅度超出保护酶的清理范围,机体受到损伤,酶的活性降低。MDA是膜脂过氧化的主要产物之一,其含量能够反映细胞膜脂过氧化程度。本试验结果表明,单纯盐胁迫T1处理下苹果嫁接苗MDA含量显著高于对照,这应该是因为盐胁迫逆境诱导产生的活性氧(O-2·和H2O2)超出了机体保护酶SOD、CAT、POD和APX的清除范围,活性氧产生与消除的动态平衡被打破,大量的活性氧引发膜脂过氧化反应,产生较多的MDA。而MDA又能够通过与细胞膜上的蛋白质、酶结合,使它们因发生交联聚合而失去活性,最终导致细胞膜结构和功能的破坏[34]。另外,盐胁迫使细胞中Na+浓度升高,Na+能够置换细胞膜中的Ca2+,使细胞膜产生微小的漏洞,膜产生渗漏现象,进一步破坏了细胞膜结构的完整性与稳定性[35]。添加腐殖酸的4个处理(T2、T3、T4、T5)下的MDA含量均低于单纯盐胁迫T1处理,表明腐殖酸能够在一定程度上缓解NaCl对细胞膜的毒害,这应该与腐殖酸能提高苹果嫁接苗植株机体保护酶活性有关,保护酶活性的升高减少了自由基在植株体内的积累量,进而减轻了细胞膜受损程度。
矿质元素是植物生长发育的物质基础,广泛参与植株生命活动的各个阶段,但盐胁迫能够扰乱植株对矿质元素吸收的动态平衡,并使其遭受离子毒害和渗透胁迫[36-37]。K是植株生长发育必不可少的大量元素,对细胞膨压、渗透压、离子平衡与光合性能有重要的调节作用。Ca元素对稳定细胞膜结构、细胞完整性及植株生长发育有重要作用。本试验结果表明,单纯的盐胁迫在显著增加苹果嫁接苗地下部和地上部Na+含量的同时显著降低了K+、Ca2+含量,表明盐胁迫影响了苹果嫁接苗根系对K、Ca矿质元素的吸收利用,这与杨少辉等的研究结论[38]一致,这应该是因为盐胁迫下Na+在细胞质中大量积累使细胞质膜透性增加,降低了细胞膜对离子的选择性,一部分K+被Na+取代,致使K+含量降低;Na+因与Ca2+的离子半径相近使其取代质膜上一部分Ca2+,致使Ca2+含量降低[39]。另外,Na+能够竞争K、Ca等矿质元素的吸收和活性位点,并降低K+、Ca2+的离子活度,进一步抑制植株对矿质元素的吸收[40]。添加有腐殖酸的T2、T3、T4、T5处理的地下部和地上部K+、Ca2+含量均高于盐胁迫处理T1,说明腐殖酸能够在一定程度上缓解盐胁迫对K+、Ca2+吸收的抑制作用,这可能是因为腐殖酸拥有众多活性基团,具有较大的盐基交换容量,可吸附土壤中大量的可溶性盐,阻留较多的有害阳离子,直接降低土壤盐浓度[41]。另外,腐殖酸能够有效改善土壤团粒结构,提高土壤保水保肥能力,增加植株根系活性,促进植株对K、Ca等矿质元素的吸收利用。K+含量/Na+含量、Ca2+含量/Na+含量是衡量植物耐盐性强弱的重要参考指标[42-43],本试验条件下,T3至T5处理下的地下部和地上部K+含量/Na+含量、Ca2+含量/Na+含量均显著高于T1,表明盐胁迫条件下施用腐殖酸能够提高苹果植株K+含量/Na+含量、Ca2+含量/Na+含量,促进根系对K+、Ca2+的吸收,提高植株对K+、Ca2+的选择性运输能力,有利于叶片保持一定的光合能力和机体正常的生理代谢活动,增强植株耐盐性能。
参考文献:
[1]Qadir M,Quillérou E,Nangia V,et al. Economics of salt-induced land degradation and restoration[J]. Natural Resources Forum,2014,38(4):282-295.
[2]靳 娟,鲁晓燕,王 依. 果树耐盐性研究进展[J]. 园艺学报,2014,41(9):1761-1776.
[3]Waqas M,Ahmad B,Arif M,et al. Evaluation of humic acid application methods for yield and yield components of mungbean[J]. American Journal of Plant Sciences,2014,5(15):2269-2276.
[4]Nardi S,Pizzeghello D,Reniero F,et al. Chemical and biochemical properties of humic substances isolated from forest soils and plant growth[J]. Soil Science Society of America Journal,2000,64(2):639-645.
[5]Muscolo A,Sidari M,Attinà E,et al. Biological activity of humic substances is related to their chemical structure[J]. Soil Science Society of America Journal,2007,71(1):75-85.
[6]李小华,张建民,黄占斌. 腐殖酸在退化土壤改良中的应用研究[J]. 科学,2020,72(2):31-34,4.
[7]吳佳利. 腐殖酸对滨海黏质盐土的改良效果研究[D]. 泰安:山东农业大学,2021:1-52.
[8]马太光,李海平,郭秀霞,等. 腐殖酸对NaCl胁迫下西葫芦胚轴和根生长及抗氧化特性的影响[J]. 江苏农业科学,2016,44(9):189-192.
[9]郭 伟,王庆祥. 腐殖酸浸种对盐碱胁迫下小麦根系抗氧化系统的影响[J]. 干旱地区农业研究,2011,29(6):222-226,232.
[10]赵世杰,许长成,邹 琦,等. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯,1994,30(3):207-210.
[11]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[12]Nakano Y,Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology,1981,22(5):867-880.
[13]高俊凤. 植物生理学实验指导[M]. 北京:高等教育出版社,2006:74-77.
[14]Nijs I,Ferris R,Blum H,et al. Stomatal regulation in a changing climate:a field study using Free Air Temperature Increase (FATI) and Free Air CO2 Enrichment (FACE)[J]. Plant,Cell and Environment,1997,20(8):1041-1050.
[15]鲍士旦. 土壤农化分析[M]. 3版.北京:中国农业出版社,2000:105-114.
[16]刘 静,王庆祥. NaCl 和 NaHCO3 胁迫对玉米幼苗根系的影响[J]. 杂粮作物,2010,30(1):19-21.
[17]Yeo A.Molecular biology of salt tolerance in the context of whole-plant physiology[J]. Journal of Experimental Botany,1998,49(323):915-929.
[18]赵振东,孙廉平,曹正男,等. 腐殖酸对水稻产量、品质及土壤特性的影响[J]. 中国稻米,2022,28(1):38-42.
[19]马太光,李海平,郭秀霞,等. 腐殖酸对NaCl胁迫下西葫芦胚轴和根生长及抗氧化特性的影响[J]. 江苏农业科学,2016,44(9):189-192.
[20]梅慧生,杨玉明,张淑运,等. 腐殖酸钠对植物生长的刺激作用[J]. 植物生理学报,1980,6(2):30-37.
[21]Sánchez C,Vielba J M,Ferro E,et al. Two SCARECROW-LIKE genes are induced in response to exogenous auxin in rooting-competent cuttings of distantly related forest species[J]. Tree Physiology,2007,27(10):1459-1470.
[22]肖 丽,高瑞凤,隋方功. 氯胁迫对大白菜幼苗叶绿素含量及光合作用的影响[J]. 中国土壤与肥料,2008(2):44-47.
[23]邵玺文,张瑞珍,童淑媛,等. 松嫩平原盐碱土对水稻叶绿素含量的影响[J]. 中国水稻科学,2005,19(6):570-572.
[24]周黄磊,黄升谋. 库源关系对水稻叶绿素含量及叶绿素a/b值的影响[J]. 绿色科技,2017(24):147-149.
[25]刘 行,张彦广.盐胁迫对金露梅的生长及其叶绿素含量的影响[J]. 宁夏大学学报(自然科学版),2017,38(1):90-95.
[26]Mehta P,Jajoo A,Mathur S,et al. Chlorophyll a fluorescence study revealing effects of high salt stress on photosystem Ⅱ in wheat leaves[J]. Plant Physiology and Biochemistry,2010,48(1):16-20.
[27]Munns R,Tester M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology,2008,59:651-681.
[28]吴雪霞,朱为民,朱月林,等. 外源一氧化氮对NaCl胁迫下番茄幼苗光合特性的影响[J]. 植物营养与肥料学报,2007,13(6):1105-1109.
[29]朱新广,张其德. NaCl对光合作用影响的研究进展[J]. 植物学通报,1999,16(4):332-338.
[30]Cramer G R,Quarrie S A. Abscisic acid is correlated with the leaf growth inhibition of four genotypes of maize differing in their response to salinity[J]. Functional Plant Biology,2002,29(1):111-115.
[31]孙存华,李 扬,贺鸿雁,等. 藜对干旱胁迫的生理生化反应[J]. 生态学报,2005,25(10):2556-2561. [HJ1.7mm]
[32]周丹丹,李存华,杨庆山,等. 盐胁迫对朴树叶片渗透调节物质及保护酶系统的影响[J]. 山东林业科技,2016,46(2):1-5,74.
[33]廖 科,文国琴,杜宇阳,等. 盐胁迫对诱变凤仙花保护酶活性的影响[J]. 北方园艺,2019(3):101-108.
[34]徐恒刚,张 萍,李临杭,等. 对牧草耐盐性测定方法及其评价指标的探讨[J]. 中国草地,1997,19(5):52-54,64.
[35]顏志明. 外源脯氨酸提高甜瓜幼苗耐盐性的生理调节功能[D]. 南京:南京农业大学,2011:1-129.
[36]张梦璇. 滨海盐碱地不同白榆品系的耐盐性分析[D]. 泰安:山东农业大学,2019:1-52.
[37]刘正祥,魏 琦,张华新. 盐胁迫对沙枣幼苗不同部位矿质元素含量的影响[J]. 生态学杂志,2017,36(12):3501-3509.
[38]杨少辉,季 静,王 罡. 盐胁迫对植物的影响及植物的抗盐机理[J]. 世界科技研究与发展,2006,28(4):70-76.
[39]陈少良,李金克,尹伟伦,等. 盐胁迫条件下杨树组织及细胞中钾、钙、镁的变化[J]. 北京林业大学学报,2002,24(5/6):84-88.
[40]王玉凤,薛盈文,杨克军,等. NaCl胁迫对玉米幼苗不同器官离子含量的影响[J]. 生态学杂志,2011,30(8):1654-1661.
[41]牛育华,李仲谨,郝明德,等. 腐殖酸的研究进展[J]. 安徽农业科学,2008,36(11):4638-4639,4651.
[42]Tahal R,Mils D,Heimer Y,et al. The relation between low K+/Na+ ratio and salt-tolerance in the wild tomato species Lycopersicon pennellii[J]. Journal of Plant Physiology,2000,157(1):59-64.
[43]Dasgan H Y,Aktas H,Abak K,et al. Determination of screening techniques to salinity tolerance in tomatoes and investigation of genotype responses[J]. Plant Science,2002,163(4):695-703.
