甲壳素衍生物调控瘢痕疙瘩中TSG-6/PI3K/AKT通路表达的临床研究
2023-05-22陈雷刚,周向昭,王世宁,李亚维,刘媛媛,李坤
陈雷刚,周向昭,王世宁,李亚维,刘媛媛,李坤
[摘要]目的:甲殼素衍生物调控瘢痕疙瘩中肿瘤坏死因子α刺激基因6(TSG-6)/磷酸肌醇-3-激酶(PI3K)/丝苏氨酸蛋白激酶-B(AKT)通路表达的作用。方法:选择2020年1月-2021年10月笔者医院接受手术切除的76例瘢痕疙瘩患者为研究对象,根据术前是否使用甲壳素衍生物分为甲壳素组(n=41)和对照组(n=35)。手术后,收集瘢痕疙瘩组织,采用免疫组化法检测增殖细胞核抗原(PCNA)的阳性表达率;采用TUNEL法检测细胞凋亡率;采用western blot检测TSG-6、p-PI3K、p-AKT、鼠双微基因2(MDM2)、B淋巴细胞瘤-2基因(Bcl-2)、裂解型caspase-3(Cleaved caspase-3)的表达水平;采用酶联免疫吸附法检测肿瘤坏死因子-α(TNF-α)、IL-1β、IL-6的含量。结果:甲壳素组瘢痕疙瘩组织中PCNA阳性表达率、p-PI3K、p-AKT、MDM2、Bcl-2的表达水平、TNF-α、IL-1β、IL-6的含量低于对照组(P<0.05),细胞凋亡率、TSG-6及Cleaved caspase-3的表达水平高于对照组(P<0.05)。结论:甲壳素衍生物可调控瘢痕疙瘩中的细胞增殖及凋亡,这一作用与调控TSG-6/PI3K/AKT通路有关。
[关键词]瘢痕疙瘩;甲壳素;TSG-6/PI3K/AKT通路;凋亡;炎症反应
[中图分类号]R619+.6 [文献标志码]A [文章编号]1008-6455(2023)04-0071-04
Clinical Study of Chitin Derivatives Regulating the Expression of TSG-6/PI3K/Akt Pathway in Keloid
CHEN Leigang1,ZHOU Xiangzhao1,WANG Shining1,LI Yawei1,LIU Yuanyuan1,LI Kun2
(1.Department of Dermatology; 2.Department of Pathology,the First Affiliated Hospital of Hebei North University,Zhangjiakou 075000,Hebei,China)
Abstract: Objective To study the effect of chitin derivatives in regulating tumor necrosis factor alpha stimulatedgene-6 (TSG-6)/phosphatidylinositol 3 kinase (PI3K)/serine protein kinase-B (AKT) pathway expression in keloid. Methods 76 patients with keloid who underwent surgical resection in our hospital from January 2020 to October 2021 were selected as the research object and divided into chitin group (n= 41) and control group (n= 35) according to whether to use chitin derivative before operation. After operation, keloid tissues were collected. The positive expression rate of PCNA was detected by immunohistochemical method, the apoptosis rate was detected by TUNEL method, and the expression levels of TSG-6, p-PI3K, p-AKT, mouse double microgene 2 (MDM2), B cell lymphoma-2 gene (Bcl-2) and cleaved caspase-3 were detected by Western blot, tumor necrosis factor-α(TNF-α), IL-1β, IL-6 content were detected by enzyme-linked immunosorbent assay. Results In chitin group, the positive expression rate of PCNA, the expression levels of p-PI3K, p-AKT, MDM2, Bcl-2 and the contents of TNF-α, IL-1β, IL-6 were lower than those in the control group (P<0.05), and the apoptosis rate and the expression level of TSG-6 and cleaved caspase-3 were higher than those in the control group (P<0.05). Conclusion Chitin derivatives regulate cell proliferation and apoptosis in keloid, which is related to the regulation of TSG-6/PI3K/Akt pathway.
Key words: keloid; chitin; TSG-6/PI3K/Akt pathway; apoptosis; inflammatory reaction
皮肤创伤愈合是十分精细而复杂的修复过程,但是过度愈合会造成增生性瘢痕和瘢痕疙瘩等病理性瘢痕的发生[1-2]。瘢痕疙瘩形成的病理基础是结缔组织过度增生与透明变性,肿瘤坏死因子α刺激基因6(TSG-6)/磷酸肌醇-3-激酶(PI3K)/丝苏氨酸蛋白激酶-B(AKT)通路介导的瘢痕疙瘩成纤维细胞的不断增生及凋亡在该过程中发挥重要作用[3]。瘢痕疙瘩患者会出现局部瘙痒、疼痛等不适症状,严重者可导致瘢痕性挛缩,尤其在关节处瘢痕挛缩常导致严重功能障碍,因此皮肤创伤愈合过程中瘢痕疙瘩的防治及相关机制的研究是重要临床课题。甲壳素是广泛存在于低等动物外壳细胞壁中的一种天然生物高分子,有临床研究报道,甲壳素衍生物对烧伤创面的愈合具有促进作用[4-5];有动物实验证实,甲壳素衍生物对瘢痕形成具有抑制作用[6],但目前甲壳素衍生物治疗瘢痕疙瘩的作用及机制尚缺乏临床证据。本研究将以接受手术切除治疗的瘢痕疙瘩患者为对象,观察甲壳素衍生物对瘢痕疙瘩中TSG-6/PI3K/AKT通路表达的调控作用,旨在为深入认识甲壳素衍生物在瘢痕疙瘩中的防治作用提供循证医学证据。
1 资料和方法
1.1 一般资料:选择2020年1月-2021年10月笔者医院接受手术切除的76例瘢痕疙瘩患者为研究对象,根据手术前是否使用甲壳素凝胶治疗分为甲壳素组和对照组,两组一般资料比较差异无统计学意义(P>0.05)。见表1。
1.2 纳入标准:①通过手术对瘢痕疙瘩进行切除者;②术前未接受任何治疗或仅接受过甲壳素凝胶涂抹者;③患者知晓并签署知情同意书。
1.3 排除标准:①合并恶性肿瘤、免疫功能紊乱、血液系统疾病;②合并其他皮肤疾病;③手术标本未保留。
1.4 方法
1.4.1 两组患者术前瘢痕疙瘩治疗:甲壳素组术前将改性甲壳素创面修复凝露(20克/支)涂于瘢痕疙瘩组织,涂抹厚度>1 mm,涂抹范围超过创缘1 cm,每天2次,连续涂抹14 d;对照组术前不接受任何治疗。
1.4.2 标本收集及保存:收集手術切除的瘢痕疙瘩组织,生理盐水清洗后分为两份,一份放入4%多聚甲醛溶液中固定24 h,而后进行石蜡包埋,蜡块室温保存;另一份放入冻存管,在液氮中冷冻30 min,取出后放入-80℃超低温保存箱保存。
1.4.3 免疫组化法检测增殖细胞核抗原(PCNA)阳性表达率:取瘢痕疙瘩的蜡块,制作厚度4μm的病理切片,采用SP二步法免疫组织化学试剂盒(上海邦奕生物公司)进行检测,孵育PCNA的一抗(1:200稀释,SantaCruz公司),显微镜下观察,PCNA的染色部位主要为细胞核,用已知阳性片作阳性对照,磷酸盐缓冲液代替PCNA一抗作阴性对照,盲法读片并判定PCNA的阳性表达情况、计算阳性表达率。阳性表达率=阳性细胞数/总细胞数×100%。
1.4.4 TUNEL法检测细胞凋亡率:取瘢痕疙瘩的蜡块,制作厚度4μm的病理切片,采用TUNEL试剂盒(上海碧云天公司)进行检测,分别进行TUNEL染色和DAPI染色,抗荧光猝灭封片液封片后在显微镜下观察染色情况,对TUNEL阳性细胞和DAPI阳性细胞进行计数。细胞凋亡率=TUNEL阳性细胞数/DAPI阳性细胞数×100%。
1.4.5 Western blot检测蛋白表达水平:取冻存的瘢痕疙瘩组织约30 mg,加入组织裂解液(上海碧云天公司),匀浆提取组织蛋白,蛋白定量后将含有30μg蛋白的样本用于Western blot检测,蛋白样本加入SDS-聚丙烯酰胺凝胶,电泳分离不同分子量的蛋白后电转移至硝酸纤维素膜,5%脱脂牛奶室温封闭后1:1 000稀释的TSG-6、p-PI3K、p-AKT、PI3K、AKT、Bcl-2、MDM2、Cleaved caspase-3特异性一抗4℃孵育过夜,次日孵育1:2 000稀释的二抗1 h。最后,将硝酸纤维素膜放入凝胶成像仪(Bio-rad公司)中,化学发光得到蛋白条带,计算TSG-6、Bcl-2、MDM2、Cleaved caspase-3灰度值与β-actin灰度值的比值及p-PI3K、p-AKT灰度值与PI3K、AKT灰度值的比值。
1.4.6 Elisa法检测细胞因子含量:取冻存的瘢痕疙瘩组织约30 mg,加入组织裂解液(上海碧云天公司),匀浆提取组织蛋白,采用Elisa试剂盒(上海西唐公司)检测匀浆液中TNF-α、IL-1β、IL-6的浓度,采用BCA法试剂盒(上海碧云天公司)检测匀浆液中蛋白浓度,计算TNF-α、IL-1β、IL-6浓度与蛋白浓度的比值,得到每毫克蛋白中TNF-α、IL-1β、IL-6的含量。
1.5 统计学分析:采用SPSS 21.0分析数据,计数资料以[例(%)]表示,采用卡方检验进行两组间比较;计量资料以(x?±s)表示,采用独立样本t检验进行两组间比较。以P<0.05为差异有统计学意义。
2 结果
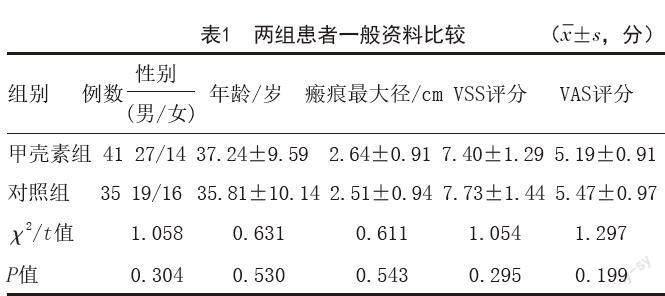
2.1 甲壳素组治疗前后瘢痕疙瘩大体观察:所有患者经甲壳素治疗后瘢痕疙瘩的形态均得到了一定程度的改善,典型病例见图1。
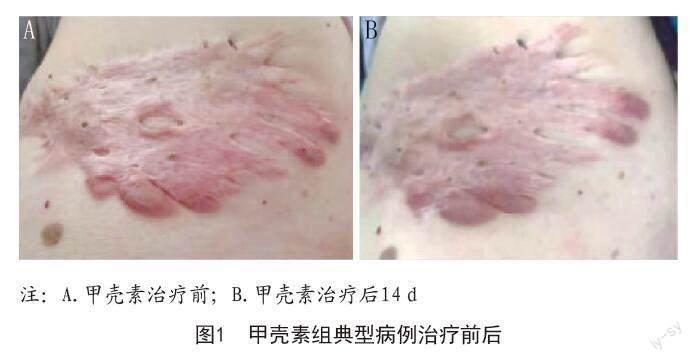
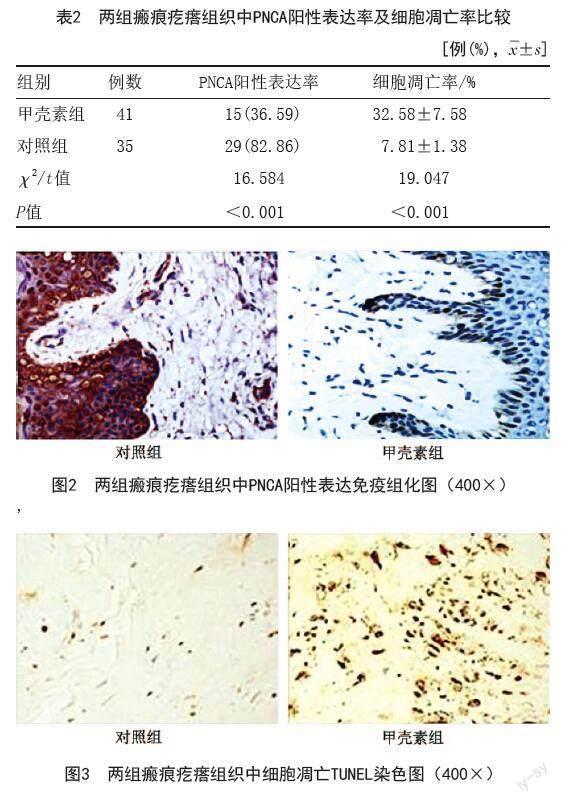
2.2 两组患者瘢痕疙瘩组织中PNCA阳性表达率及细胞凋亡率比较:甲壳素组PNCA阳性表达率低于对照组,细胞凋亡率高于对照组,差异均有统计学意义(P<0.05)。见表2、图2~3。
2.3 两组患者瘢痕疙瘩组织中TSG-6、p-PI3K、p-AKT通路表达水平比较:甲壳素组患者瘢痕疙瘩组织中TSG-6的表达水平高于对照组,p-PI3K、p-AKT的表达水平低于对照组,差异均有统计学意义(P<0.05)。见表3、图4。
2.4 两组患者瘢痕疙瘩组织中凋亡基因表达水平比较:甲壳素组患者瘢痕疙瘩组织中Bcl-2、MDM2的表达水平低于对照组,Cleaved caspase-3的表达水平高于对照组,差异均有统计学意义(P<0.05)。见表4、图5。
2.5 两组患者瘢痕疙瘩组织中炎症细胞因子含量比较:甲壳素组患者瘢痕疙瘩组织中TNF-α、IL-1β、IL-6的含量低于对照组,差异均有统计学意义(P<0.05)。见表5。
3 讨论
瘢痕疙瘩是皮肤创伤愈合过程中异常形成的病理性瘢痕,外观为高于皮肤的暗紫色硬质肿块,常超出皮肤创伤范围呈蟹足状生长,直接影响外观及功能,对患者的身心健康均造成不利影响。瘢痕疙瘩的治疗手段包括手术、药物、激光、冷冻、放疗等,治疗后局部组织中异常增生的成纤维细胞会造成瘢痕疙瘩复发,不同治疗手段的疗效均不尽如人意[7-8]。因此,深入探索瘢痕疙瘩的发病机制、发现新的瘢痕疙瘩治疗手段具有迫切的临床需求。
甲壳素又名几丁质,是壳制动物中提取得到的氨基酸多肽,其衍生物具有广泛的生物学功能,可以与结合脂肪酸结合,参与乳化并起到降脂作用,也能与肿瘤分子结合,调控免疫应答,并起到抗肿瘤作用[9-10]。近年来,甲壳素衍生物的外用制剂被越来越多的用于临床治疗。甲壳素凝胶、甲壳素生物修复膜等用于感染创面的治疗,能够起到抑菌、抗感染作用[11-12],用于烧伤创面的治疗,能够改善血液循环、加速创面愈合[4-5]。在多项甲壳素用于烧伤创面治疗的临床研究中,使用甲壳素治疗的创面均未出现瘢痕愈合[4-5]。另有动物实验在皮肤缺损大鼠模型中观察到甲壳素显著抑制瘢痕增生[6]。以上结果提示,甲壳素可能具有抑制瘢痕增生、治疗瘢痕疙瘩的价值。
目前,关于甲壳素治疗瘢痕疙瘩的研究均只停留在基础研究阶段,尚缺乏相关的临床研究证据。本文设计了非随机对照临床研究,旨在获得甲壳素治疗瘢痕疙瘩的临床证据,这也是本研究的独特性和创新性所在。成纤维细胞的过度增殖、凋亡减少是瘢痕疙瘩形成的重要生物学环节[13-14]。为了探索甲壳素治疗瘢痕疙瘩的价值,本研究在甲壳素治疗后检测了瘢痕疙瘩中PCNA的表达水平及凋亡水平。PCNA是细胞增殖的标志基因,其阳性表达水平反映了局部组织中的细胞增殖水平;TUNEL法检测细胞凋亡率直接反映细胞凋亡水平。本研究的結果显示:使用甲壳素凝胶治疗的瘢痕疙瘩组织中PCNA的阳性表达率低于对照组,细胞凋亡率高于对照组,表明甲壳素对瘢痕疙瘩中的细胞增殖具有抑制作用,对细胞凋亡具有促进作用,进而也提示甲壳素对瘢痕疙瘩具有一定的治疗价值。
本研究还深入探索了甲壳素发挥上述作用的可能分子机制。TSG-6蛋白在瘢痕疙瘩形成过程中发挥关键作用,该蛋白在正常组织和细胞中几乎不表达,在炎症、外伤等刺激下表达增加并通过下游PI3K/AKT通路进行信号转导,进而参与细胞增殖、凋亡及炎症反应的调控[15-16]。已有细胞实验在瘢痕疙瘩成纤维细胞中证实过表达TSG-6使PI3K/AKT通路失活、抑制细胞增殖、促进细胞凋亡,降低TSG-6使PI3K/AKT通路激活、促进细胞增殖、抑制细胞凋亡。本研究通过检测瘢痕疙瘩组织中该通路的表达可知:使用甲壳素凝胶治疗的瘢痕疙瘩组织中TSG-6的表达水平高于对照组,p-PI3K、p-AKT的表达水平低于对照组,表明甲壳素调控瘢痕疙瘩中TSG-6/PI3K/AKT通路,这一作用与甲壳素对瘢痕疙瘩中细胞增殖的抑制作用、细胞凋亡的促进作用吻合。
TSG-6所调控的PI3K/AKT通路是调控细胞增殖、凋亡及炎症反应的经典信号通路。该通路激活后,显著增加MDM2、Bcl-2的表达,后两者能够抑制线粒体内细胞色素C的释放、阻碍Cleaved caspase-3的生成,进而起到抑制凋亡、促进增殖的作用。同时,该通路还能起到抗炎作用,显著减少TNF-α、IL-1β、IL-6等炎症细胞因子的释放。在瘢痕疙瘩形成过程中,炎症细胞因子的大量生成已经被证实是刺激纤维结缔组织增生的重要因素[17]。为了进一步明确甲壳素用于瘢痕增生治疗时对TSG-6/PI3K/AKT通路的调控作用,本研究进一步检测了通路下游效应基因及分子的水平。结果显示:使用甲壳素凝胶治疗的瘢痕疙瘩组织中MDM2、Bcl-2的表达水平及TNF-α、IL-1β、IL-6的含量均降低,Cleaved caspase-3的表达增加,表达甲壳素对疤痕疙瘩中增殖及凋亡基因的表达、炎症细胞因子的生成均具有调控作用。
综上所述,甲壳素衍生物可调控瘢痕疙瘩中细胞增殖及凋亡,这一作用与调控TSG-6/PI3K/AKT通路有关,这为今后深入认识甲壳素在瘢痕疙瘩中的防治作用及分子机制提供了临床研究证据。
[参考文献]
[1]Ekstein S F,Wyles S P,Moran S L,et al.Keloids:a review of therapeutic management[J].Int J Dermatol,2021,60(6):661-671.
[2]Choi Y J,Lee Y H,Lee H J,et al.Auricular keloid management in asian skin:clinical outcome of intralesional excision and postoperative triamcinolone acetonide intralesional injection[J].J Cosmet Dermatol,2020,19(11):3041-3047.
[3]田小雨,李小静,李心怡,等.TSG-6调控PI3K/Akt-Bcl-2通路影响人瘢痕疙瘩凋亡机制的研究[J].安徽医科大学学报,2018,53(4):563-567.
[4]孙瑞朋,孙静,赵连魁,等.改性甲壳素生物修复膜治疗浅Ⅱ度烧伤的临床疗效[J].中华损伤与修复杂志(电子版),2019,14(4):280-284.
[5]孙瑞朋,赵连魁,孙静,等.改性甲壳素联合重组人碱性成纤维细胞生长因子治疗浅Ⅱ度烧伤创面的临床观察[J].中华损伤与修复杂志(电子版),2018,13(4):269-272.
[6]何君君,李天石,朱辉.改性甲壳素对瘢痕形成影响的动物实验[J].中国医疗美容,2017,7(4):88-90.
[7]Lee Y I,Kim J,Yang C E,et al.Combined therapeutic strategies for keloid treatment[J].Dermatol Surg,2019,45(6):802-810.
[8]Hietanen K E,J?rvinen T A,Huhtala H,et al.Treatment of keloid scars with intralesional triamcinolone and 5-fluorouracil injections -a randomized controlled trial[J].J Plast Reconstr Aesthet Surg,2019,72(1):4-11.
[9]Bugnicourt L,Peers S,Dalverny C,et al.Tunable morphology of lipid/chitosan particle assemblies[J].J Colloid Interface Sci,2019,15(534):105-109.
[10]Libreros S,Garcia-Areas R,Shibata Y,et al.Induction of proinflammatory mediators by CHI3L1 is reduced by chitin treatment:decreased tumor metastasis in a breast cancer model[J].Int J Cancer,2012,131(2):377-386.
[11]Ma M,Zhong Y,Jiang X,et al.Thermosensitive and pH-responsive tannin-containing hydroxypropyl chitin hydrogel with long-lasting antibacterial activity for wound healing[J].Carbohydr Polym,2020,15(236):116096.
[12]Matica M A,Aachmann F L,T?ndervik A,et al.Chitosan as a wound dressing starting material:antimicrobial properties and mode of action[J].Int J Mol Sci,2019,20(23):5889.
[13]Zhang M Z,Dong X H,Zhang W C,et al.A comparison of proliferation levels in normal skin,physiological scar and keloid tissue[J].J Plast Surg Hand Surg,2021,29:1-7.
[14]Zhang M Z,Dong X H,Guan E L,et al.A comparison of apoptosis levels in keloid tissue,physiological scars and normal skin[J].Am J Transl Res,2017,9(12):5548-5557.
[15]Li X,Chen Z,Li X,et al.In vitro analysis of the role of tumor necrosis factor-stimulated gene-6 in keloid[J].Mol Med Rep,2019,19(2):919-926.
[16]Li X Y,Weng X J,Li X J,et al.TSG-6 inhibits the growth of keloid fibroblasts via mediating the tgf-beta1/smad signaling pathway[J].J Invest Surg,2021,34(9):947-956.
[17]Wang Z C,Zhao W Y,Cao Y,et al.The roles of inflammation in keloid and hypertrophic scars[J].Front Immunol,2020,4(11):603187.
[收稿日期]2022-02-25
本文引用格式:陳雷刚,周向昭,王世宁,等.甲壳素衍生物调控瘢痕疙瘩中TSG-6/PI3K/AKT通路表达的临床研究[J].中国美容医学,2023,32(4):71-75.
