活化蛋白C通过调控Nrf-2/HO-1信号通道改善大鼠皮瓣缺血再灌注损伤的作用研究
2023-05-22王浩,杨建强,张彬,柯友群,湛梅圣
王浩,杨建强,张彬,柯友群,湛梅圣
[摘要]目的:研究活化蛋白C(Activated protein C,APC)對大鼠皮瓣缺血再灌注损伤的作用及可能机制。方法:将80只SD雄性大鼠随机分为四组:对照组、药物对照组、模型组和治疗组,每组20只。观察术后72 h内模型大鼠皮瓣形态变化,HE染色观察大鼠皮瓣组织病理学变化,TUNEL法染色观察皮瓣组织细胞凋亡,ELISA法检测血清中TNF-α、IL-6水平,用黄嘌呤氧化酶法和硫代巴比妥酸TBA比色法分别测定皮瓣组织中超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量,Westernblot法检测皮瓣组织中Nrf-2、HO-1、γ-GCS蛋白表达水平。结果:与模型组比较,治疗组皮瓣红肿、坏死程度、病理损伤程度减弱;TUNEL法染色观察,与模型组比较,治疗组皮瓣组织细胞凋亡率减少(P<0.05);ELISA法检测发现,与模型组比较,治疗组血清中TNF-α、IL-6降低(P<0.05);与模型组比较,治疗组SOD活性升高(P<0.05),MDA含量降低(P<0.05);Westernblot法检测发现,与模型组比较,治疗组Nrf-2、HO-1、γ-GCS蛋白相对表达水平上升(P<0.05)。结论:APC能改善大鼠皮瓣缺血再灌注损伤,其机制可能与激活Nrf-2/HO-1信号通路,抑制氧化应激反应和减少细胞凋亡、炎症反应有关。
[关键词]活化蛋白C;Nrf-2/HO-1信号通道;大鼠;皮瓣缺血再灌注损伤;皮瓣组织;细胞凋亡
[中图分类号]R622 [文献标志码]A [文章编号]1008-6455(2023)04-0066-04
Effect of Activated Protein C on the Improvement of Rat Skin Flap Ischemia-reperfusion Injury by Regulating Nrf2/HO-1 Signaling Pathway
WANG Hao,YANG Jianqiang,ZHANG Bin,KE Youqun,ZHAN Meisheng
(Department of Orthopedics,Zaoyang First People's Hospital,Zaoyang 441200,Hubei,China)
Abstract: Objective To investigate the effect of activated protein C(APC) on rat skin flap ischemia reperfusion injury and its possible mechanism. Methods Eighty male SD rats were randomly divided into 4 groups: control group, model group, treatment group and drug control group, with 20 rats in each group. The morphological changes of skin flap of model rats were observed 72 h after operation. The histopathological changes of rat skin flaps were observed by HE staining. The apoptosis of skin flap tissue was observed by TUNEL staining. The levels of TNF-α and IL-6 in serum were determined by ELISA. SOD activity and MDA content of skin flap tissue were determined by xanthine oxidase and thiobarbituric acid (TBA) colorimetry. The protein expression levels of Nrf-2, HO-1 and γ-GCS in skin flap tissues were detected by Westernblot. Results Compared with the model group, the degree of flaps redness and swelling, necrosis and pathological injury in the treatment group decreased. TUNEL staining showed that compared with the model group, the apoptosis rate in the treatment group was decreased(P<0.05). Compared with the model group,TNF-α and IL-6 in the treatment group were decreased by ELISA(P<0.05). Compared with model group, SOD activity in treatment group was increased(P<0.05), while MDA content was decreased(P<0.05). Compared with the model group,the relative expression levels of Nrf-2, HO-1 and γ-GCS were increased in the treatment group by westernblot(P<0.05). Conclusion APC can improve the rat skin flap ischemia-reperfusion injury and its mechanism may be related to the activation of Nrf-2/HO-1 signaling pathway,inhibition of oxidative stress response, reduction cell apoptosis and inflammatory response.
Key words: activated protein C; Nrf-2/HO-1 signaling pathway; rat; skin flap ischemia -reperfusion injury; flap tissue; apoptosis
皮瓣组织缺血再灌注通过影响各种炎症细胞因子、活性氧的产生及细胞凋亡加剧其损伤,成为皮瓣移植术后坏死和慢性排异反应增加的主要原因之一[1-2];因此,对皮瓣缺血再灌注损伤(Flap ischemia reperfusion injury,FIR-I)的防治措施已成为目前臨床研究的热点。APC是一种血浆丝氨酸蛋白酶,具有抗炎、抗凋亡、保护内皮细胞等作用[3]。最新研究表明,APC可通过抑制炎症因子表达、减轻组织炎性细胞浸润,保护心肌缺血再灌注损伤[4]。APC靶向作用中性粒细胞,减轻线粒体功能障碍[5]。据研究报道[6],大鼠静脉注射25μg/kg APC能提高缺血皮瓣的存活率,但其作用机制尚不明确。因此本研究通过建立大鼠背部皮瓣缺血再灌注模型,观察APC对皮瓣损伤的治疗效果,探讨其可能机制。
1 材料和方法
1.1 主要试剂与仪器:活化蛋白C购自上海春麦生物科技有限公司;SOD和MDA检测试剂盒购自北京伯乐生命科学发展有限公司;TNF-α、IL-6 ELISA试剂盒购自美国R&D公司;Nrf-2、HO-1和γ-GCS抗体购自美国圣克鲁斯生物技术公司;680酶标仪购自美国伯乐;荧光显微镜购自德国莱卡公司;BBS-DDC超净工作台购自山东博科。
1.2 实验动物:80只SD雄性大鼠,8周龄,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2019-0035。饲养条件:室温22?C±3?C,相对湿度50%±10%,昼夜时间各12 h,所有大鼠均自由摄食、饮水。将大鼠随机分为4组,对照组、药物对照组、模型组和治疗组,每组20只。实验取得三亚市人民医院医学伦理委员会批准,所有实验操作符合动物3R指导原则。
1.3 方法
1.3.1 对照组:行假手术,建立背部皮瓣后,立刻缝合,不进行处理。
1.3.2 药物对照组:于假手术前尾静脉内注射25μg/kg/d APC,连续5 d,其余同对照组。
1.3.3 模型组:大鼠经10%水合氯醛麻醉后,按照参考文献[7]建立大鼠背部皮瓣缺血再灌注损伤模型,在大鼠背部中线位设计长9 cm、宽6 cm的皮瓣,皮瓣沿设计线切开、掀起,显微血管夹阻断供血6 h,取出血管夹,观察恢复到皮瓣血供后,立刻原位缝合皮瓣。
1.3.4 治疗组:术前尾静脉内注射25μg/kg/d APC[6],连续5 d,其余同模型组。对照组和模型组术前等体积注射0.9%生理盐水。术后7 d处死所有大鼠,进行后续实验。
1.4 观察指标
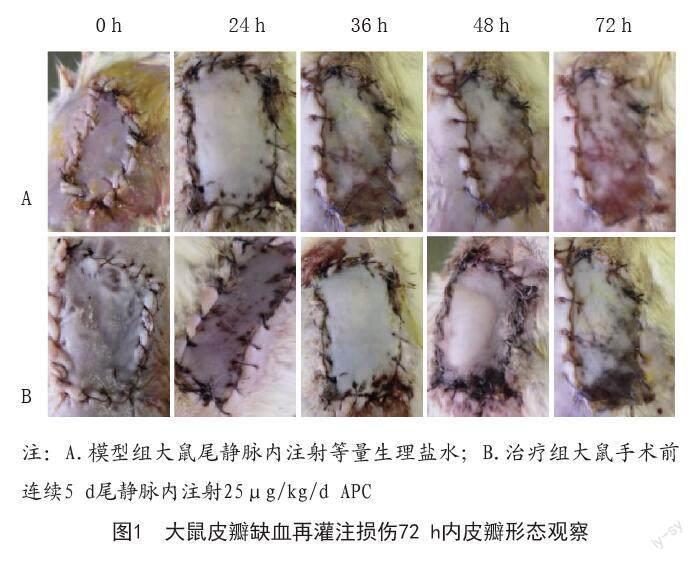
1.4.1 观察模型大鼠皮瓣形态变化:观察模型组和治疗组大鼠术后0、24、36、48、72 h背部皮瓣水肿、坏死等现象,相机拍照记录各时间段典型皮瓣。
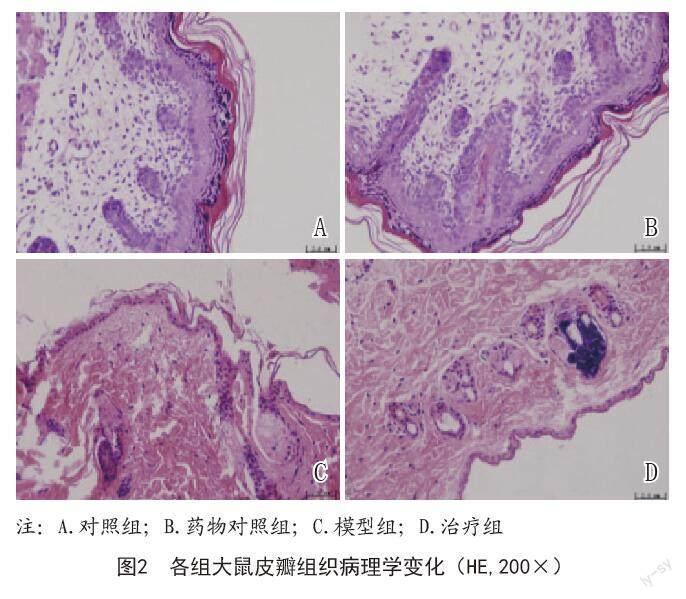
1.4.2 HE染色观察大鼠皮瓣组织病理学变化:术后7 d切取皮瓣组织,经10%多聚甲醛固定48 h,石蜡包埋,切片5μm,所有切片行苏木精-伊红(HE)染色,封片,光学显微镜下观察拍照。
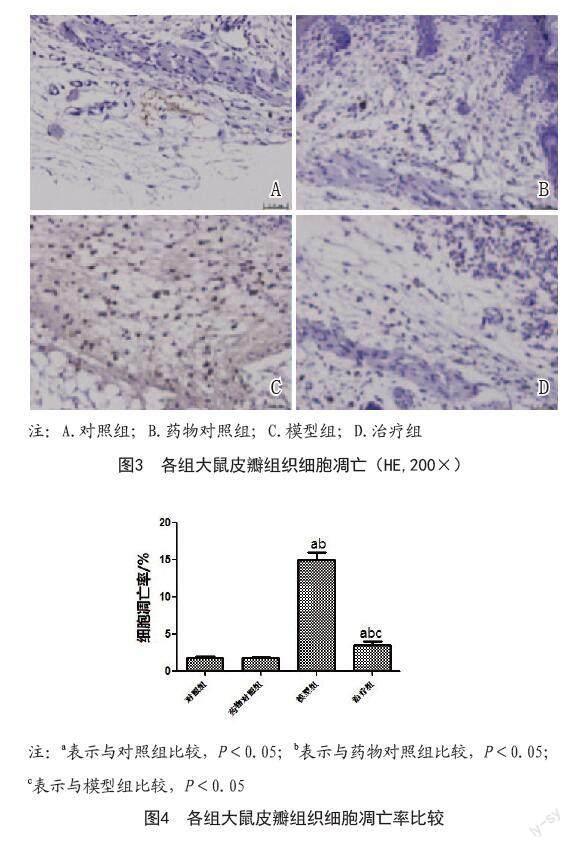
1.4.3 TUNEL法染色观察皮瓣组织细胞凋亡[8]:取石蜡切片,常规脱蜡、水化,4%多聚甲醛室温15 min,水洗,PBS冲洗浸泡5 min,5%羊血清工作液室温封阻30 min,PBS冲洗,依据TUNEL试剂盒说明书操作,光学显微镜下观察拍照。
1.4.4 ELISA法测定血清中TNF-α、IL-6水平:依据ELISA试剂盒说明书检测血清中TNF-α、IL-6的含量。
1.4.5 比色法测定SOD活性、MDA含量:取皮瓣组织,加生理盐水,制备匀浆,4℃低温离心,取上清液,采用SOD测试盒(WST-1法)和MDA检测试剂盒(TBA法)检测大鼠皮瓣组织SOD活性和MDA含量。
1.4.6 Western blot法检测皮瓣组织中Nrf-2、HO-1、γ-GCS蛋白表达水平:取皮瓣组织100 mg,加入RIPA裂解液提取组织蛋白,BCA试剂盒检测总蛋白浓度。然后上样、电泳、转膜,用5%脱脂奶粉封闭1 h后,加入一抗Nrf-2(兔多克隆,1:1 000稀释)、HO-1(兔多克隆,1:2 000稀释)以及γ-GCS(兔多克隆,1:2 000稀释),4℃轻摇过夜,加二抗37℃孵育1 h,TBST漂洗3次,ECL显色,采用Bio-Rad成像系统照相,目的蛋白相对表达量=目的蛋白IOD值/内参IOD值。
1.5 统计学分析:采用SPSS 17.0软件进行数据分析,数据以均数±标准差(x?±s)表示,各组数据进行正态检验和方差齐性检验。多组间比较采用单因素方差分析,组间比较行独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 APC对大鼠皮瓣缺血再灌注损伤皮瓣形态的影响:模型组大鼠术后出现严重水肿,72 h内皮瓣红肿、坏死现象逐渐加重;与模型组相比,治疗组大鼠于术后36 h后皮瓣损伤程度逐渐降低,呈时间依赖性。见图1。
2.2 各组大鼠皮瓣组织病理学变化:对照组和药物对照组大鼠皮瓣组织结构完整,未见明显改变。模型组大鼠皮瓣组织肌下区存在充血、炎性细胞浸润等现象,而治疗组大鼠上述病理损伤程度减少。见图2。
2.3 APC对大鼠皮瓣组织细胞凋亡的影响:与两对照组比较,模型组大鼠皮瓣组织细胞凋亡率增加(P<0.05);与模型组比较,治疗组大鼠皮瓣组织细胞凋亡率下降(P<0.05)。见图3~4。
2.4 大鼠血清TNF-α、IL-6含量变化:与两对照组比较,模型组大鼠血清TNF-α、IL-6含量升高(P<0.05)。与模型组比较,治疗组大鼠血清TNF-α、IL-6含量降低(P<0.05),而对照组和药物对照组比较,TNF-α、IL-6含量差异无统计学意义(P>0.05)。见图5。
2.5 各组大鼠皮瓣组织SOD活性及MDA含量:与两对照组比较,模型组大鼠皮瓣组织SOD活性降低(P<0.05),MDA含量升高(P<0.05)。与模型组比较,治疗组大鼠皮瓣组织SOD活性升高(P<0.05),MDA含量降低(P<0.05),而對照组和药物对照组比较,SOD活性及MDA含量差异无统计学意义(P>0.05)。见图6。
2.6 各组大鼠皮瓣组织中Nrf-2、HO-1、γ-GCS蛋白表达水平:与对照组比较,模型组大鼠皮瓣组织中Nrf-2、HO-1、γ-GCS蛋白相对表达水平均降低(P<0.05)。与模型组比较,治疗组大鼠皮瓣组织中Nrf-2、HO-1、γ-GCS蛋白相对表达水平均上升(P<0.05),而对照组和药物对照组比较,两组间各蛋白表达水平比较,差异无统计学意义(P>0.05)。见图7~8。
3 讨论
皮瓣手术在临床上十分常见,但术后易出现缺血再灌注损伤,导致皮瓣移植后部分或全部坏死,给患者带来很大的痛苦和经济负担[9-10]。APC具有广泛的生物学活性,可参与多种疾病的生理病理过程[11]。
本研究中大鼠皮瓣形态变化发现,术后36 h治疗组大鼠皮瓣损伤程度逐渐减少,且呈时间依赖性,说明APC具有减轻组织炎性细胞浸润、减轻水肿的作用;HE染色观察发现模型组大鼠皮瓣组织肌下区存在充血、炎性细胞浸润等现象,说明大鼠FIR-I建模成功,而治疗组大鼠上述病理损伤程度减少,提示APC可减轻FIR-I大鼠皮瓣损伤,与以往研究结果一致[11]。
细胞凋亡是由基因控制的细胞自主有序的死亡,在皮瓣缺血再灌注损伤病理生理过程中发挥重要作用,因此抑制细胞凋亡成为治疗FIR-I的重要方式[12-13]。TUNEL染色观察发现与对照组比较,模型组大鼠皮瓣组织细胞凋亡率增加(P<0.05),说明FIR-I可以造成皮瓣组织内细胞结构和功能上的改变,引起细胞的凋亡。而治疗组大鼠皮瓣组织细胞凋亡率较模型组下降(P<0.05),提示APC可抑制细胞凋亡改善皮瓣缺血再灌注损伤。
目前研究认为,通过使用药物抑制氧化应激、减少炎症反应可有效改善皮瓣缺血再灌注损伤[14-15]。众所周知,TNF-α和IL-6是常见的促炎因子,也是缺血再灌注损伤过程中炎症反应的重要介质。研究报道,降低TNF-α的表达可减轻缺血再灌注损伤,提高皮瓣的存活率[16]。IL-6在脑缺血再灌注损伤中含量降低,可对脑损伤起保护作用[17]。本研究中ELISA检测结果显示,与对照组比较,模型组大鼠血清TNF-α、IL-6升高(P<0.05),说明大鼠皮瓣缺血再灌注会激活炎症反应过程、促进炎症因子的释放,与报道基本一致[16]。而APC治疗后大鼠血清TNF-α、IL-6含量下降,说明APC具有抗炎作用,与文献报道基本一致[10]。
超氧化物歧化酶(SOD)是机体内氧自由基的头号杀手,丙二醛(MDA)是体内自由基与脂质发生过氧化反应的终产物,SOD活性及MDA含量可直接反映体内氧化应激状态[18]。SOD活性及MDA含量检测显示:与对照组比较,模型组大鼠皮瓣组织SOD活性降低(P<0.05),MDA含量升高(P<0.05),说明皮瓣缺血再灌注刺激引起有害因子与机体抗氧化防御系统(SOD)进行消耗,当SOD被消耗后,大量脂质过氧化产物MDA生成,可能导致氧化应激失衡,最终使细胞死亡。同时,与模型组比较,治疗组大鼠皮瓣组织SOD活性升高(P<0.05),MDA含量降低(P<0.05),提示APC可清除体内过量的自由基,导致脂质过氧化水平降低,抑制MDA的生成,达到抗氧化作用,从而减轻皮瓣损伤。
核因子E2相关因子2(Nrf2)信号通路是对抗氧化应激和炎症反应的主要防御机制,其通过调控下游细胞因子如血红素加氧酶1(HO-1)、γ-谷氨酰半胱氨酸合成酶(γ-GCS)、抗炎因子和抗氧化酶的表达抵抗机体损伤[19-20]。HO-1作为机体细胞的保护防线,其表达增多会抑制促炎细胞因子和趋化因子的产生达到抗炎作用[21];γ-GCS是Nrf2调控氧化应激的主要酶类靶蛋白,其活性和表达水平可直接调控机体抗氧化能力[22]。Western blot结果显示:与模型组比较,治疗组大鼠皮瓣组织中Nrf-2、HO-1、γ-GCS蛋白相对表达水平上升(P<0.05),说明APC可促进Nrf-2向细胞核中转运和活化,启动其下游多种抗氧化蛋白表达(γ-GCS、SOD)和Ⅱ相解毒酶(HO-1)的合成,减轻氧化应激引起的损伤,与本研究中SOD和MDA检测结果基本一致;由于氧化应激会导致机体内产生大量ROS,触发细胞损伤凋亡,而在肿瘤或炎症性疾病中ROS还可以与NRF2信号通路发生相互调控,因此后续将对两者的关系展开进一步探讨。
综上所述,APC可通过激活Nrf2/HO-1信号通路,抑制氧化应激和炎症反应,减少细胞凋亡,有效改善大鼠皮瓣缺血再灌注损伤。
[参考文献]
[1]曹畅,任肖艳,孟凡军,等.人参皂苷Rb1与皮瓣缺血再灌注损伤的研究与进展[J].中国组织工程研究,2019,23(7):1129-1135.
[2]Yu L M,Dong X,Zhang J,et al.Naringenin attenuates myocardial ischemia-reperfusion injury via cGMP-PKGI α signaling and in vivo and in vitro studies[J].Oxid Med Cell Longev,2019,20(19):1-15.
[3]童晓红,查锦芬,丁家望,等.探讨活化蛋白C对大鼠心肌缺血再灌注损伤的保护作用及机制的影响[J].中国比较医学杂志,2020,30(2):103-107.
[4]王金桥,杨晓晓,饶高峰.活化蛋白C通过降低炎症因子表达减轻大鼠缺血性脑损伤研究[J].中国卒中杂志,2019,14(9):865-871.
[5]陈焰,王岗玲,吴海明.活化蛋白C通过靶向VLA-3-中性粒细胞亚群来减轻结核杆菌诱导的人气道上皮细胞炎症反应线粒体能量代谢障碍[J].实用医学杂志,2020,36(23):54-58.
[6]赵丽娜,吴东方,王建红,等.活化蛋白C通过调控促血管生长基因及抗炎基因的表达提高缺血皮瓣的存活率[C].上海:解剖学杂志编辑部,2012.
[7]刘蕴琦,刘艺芳,肖一丁,等.两种大鼠皮瓣缺血再灌注损伤模型的比较[J].中国医药导报,2014,11(22):9-12.
[8]Baar M P,Brandt R,Putavet D A,et al.Targeted apoptosis of senescent cells restores tissue homeostasis in response to chemotoxicity and aging[J].Cell,2017,169(1):132-147.
[9]Nizeyimana H,Zhou D D,Liu X F,et al.Clinical efficacy of conjunctival flap surgery in the treatment of refractory fungal keratitis[J].Exp Ther Med,2017,14(2):1109-1113.
[10]Shane K F S,Mark K H,Michael L M,et al.Preoperative and postoperative assessment of rectus abdominis muscle size and function following diep flap surgery[J].Comparative Study Plast Reconstr Surg,2018,141(5):1261-1270.
[11]Baig MA.Comparative analysis of "APTT vs RVVT" based activated protein C resistance assay in the diagnosis of Factor V Leiden mutation[J].Indian J Pathol Microbiol,2020,63(2):247-250.
[12]Shu L L,Zhang W Z,Huang G C,et al.Troxerutin attenuates myocardial cell apoptosis following myocardial ischemia-reperfusion injury through inhibition of miR-146a-5p expression[J].J Cell Physiol,2019,234(6):9274-9282.
[13]李建军,史晓燕.甲基莲心碱对脑缺血再灌注脑损伤的调节作用[J].医学分子生物学杂志,2020,17(1):19-25.
[14]Han L M,Hua W P,Cao X Y,et al.Genome-wide identification and expression analysis of the superoxide dismutase (SOD) gene family in Salvia miltiorrhiza[J].Gene,2020,742(2):144603-144014.
[15]王雅楠,姚琳,毛文静,等.脑小血管病患者氧化应激标志物、磁共振总负担与血管性认知障碍的相关性[J].中华行为医学与脑科学杂志,2020,29(10):898-903.
[16]Chu T,Weng X,Law O K,et al.The ribosomal maturation factor P from Mycobacterium smegmatis facilitates the ribosomal biogenesis by binding to the small ribosomal protein S12[J].J Biol Chem,2019,294(1):372-378.
[17]武文文,吴诗卉,刘春红,等.人参皂苷Rg1对局灶性脑缺血再灌注损伤模型大鼠的预防作用及机制研究[J].中国药房,2020,31(11):1287-1293.
[18]Obradovic D,Andjelic T,Ninkovic M,et al.Superoxide dismutase(SOD),advanced oxidation protein products(AOPP),and disease-modifying treatment are related to better relapse recovery after corticosteroid treatment in multiple sclerosis[J].Neurol Sci,2020,42(20):3241-3247.
[19]Wang R,Yu Z,Sunchu B,et al.Rapamycin inhibits the secretory phenotype of senescent cells by a Nrf2-independent mechanism[J].Aging Cell,2017,16(3):564-574.
[20]Abdelzaher W Y,Ali A B,El-Tahawy NFG.Mast cell stabilizer modulates Sirt1/ Nrf2/TNF pathway and inhibits oxidative stress,inflammation,and apoptosis in rat model of cyclophosphamide hepatotoxicity[J].Immunopharm Immunot,2020,42(2):101-109.
[21]楊曼,于洋,谢克亮,等.氢气对野生型及Nrf 2基因敲除型脓毒症小鼠肺损伤的影响:与Nrf 2/HO-1/HMGB1通路的关系[J].中华危重病急救医学,2019,31(7):862-866.
[22]Jin X,Song L,Li Z,et al.Dichlorodiphenyldichloroethylene exposure reduces r-GCS via suppressed Nrf2 in HepG2 cells[J].Environ Toxicol,2016,31(3):350-359.
[收稿日期]2021-11-05
本文引用格式:王浩,杨建强,张彬,等.活化蛋白C通过调控Nrf-2/HO-1信号通道改善大鼠皮瓣缺血再灌注损伤的作用研究[J].中国美容医学,2023,32(4):66-70.
