一株纤维素降解菌株筛选及在低温好氧堆肥起爆应用
2023-05-22周东兴李云飞路济阳杨妍娜
周东兴,刘 煜,葛 闫,李云飞,路济阳,杨妍娜,王 旭
(东北农业大学资源与环境学院,哈尔滨 150030)
根据农业农村部《全国农作物秸秆综合利用情况报告》显示,2021年全国农作物秸秆利用量6.47亿t,综合利用率达88.1%,但大量农业废弃物仍是主要污染环境因素[1]。好氧堆肥是作物秸秆无害化处理与资源利用的重要方式[2]。但秸秆堆肥中,纤维素是作物秸秆中含量最高的一类物质,纤维素与半纤维素以及木质素等物质所组成的复杂空间结构通常阻碍微生物对秸秆资源利用,因此,提高堆肥系统对纤维素降解效率尤为重要[3]。中国东北地区,一年中有4~5 个月环境温度在0 ℃以下,内外温差导致堆肥系统热量向外流失,环境温度在15 ℃以下时,微生物代谢活性降低,堆肥过程中温度上升困难,最终堆肥失败。低温环境下堆肥迅速起温是决定堆肥进入高温期、实现无害化的关键步骤。低温环境中,中温菌和高温菌难以降解堆肥中的大分子有机物质,维持生长繁殖。传统的解决方法是加入糖、蛋白质等微生物易于利用的化学物质作物作为起爆剂,增加起始阶段微生物活性[4]。复配接种耐冷或嗜冷等活性微生物,实现低温发酵启动是目前研究热点。细菌具有较强抗逆性,是对耐冷或嗜冷微生物筛选的主要研究对象。Melo 等在南北极环境中分离具有较高纤维素分解能力的微生物[5],Chevalier 等在南极湖泊中筛选出耐冷蓝细菌[6],Dai 等在青海高原中分离出可在低温环境中生存,具有降解纤维素与几丁质能力的微生物种群[7]。除极地与高原极端环境以外,寒冷地区土壤中也有相关微生物被筛选分离的研究报道,Sun等在寒冷地区土壤中筛选一株嗜冷细菌Pseudomonas sp.[8]。
细菌同时也是堆肥过程中最重要和最丰富的微生物,硬壁菌门与变形菌门是堆肥细菌中主要门类[9]。许多细菌接种剂均由硬壁菌门中芽孢杆菌属的微生物制备,Yin等研究表明,硬壁菌门微生物可耐受高温环境,在堆肥中高温阶段最为丰富[10]。硬壁菌门微生物作为接种剂,在堆体处于较低温度前期可能达不到理想效果。变形菌门微生物在许多秸秆堆肥中被认为是关键因素,在堆肥升温期与高温期均占主导地位,更适合作为堆肥初期接种微生物[11]。
本试验从寒地农田腐烂玉米秸秆碎块中筛选耐低温纤维素降解菌株,通过显微形态检测、菌株生理生化特征检验,以及16S rDNA 分子鉴定方式鉴定菌株,结合同类型菌株培养结果优化培养条件响应面,优化最佳培养条件。同时,利用小型低温堆肥试验验证其启动效果,旨在为低温环境下秸秆好氧堆肥处理提供新的菌株资源。
1 材料与方法
1.1 样品采集
在东北农业大学向阳试验示范基地农场收集农田腐烂玉米秸秆碎块及周围土壤样品。
1.2 培养基
富集培养基:CMC-Na 15.0 g,(NH4)2SO41.0 g,酵母浸粉1.0 g,MgSO4·7H2O 0.5 g,K2HPO4·2H2O 1.0 g,NaCl 0.3 g,去离子水1 L,pH为7[12]。
鉴别培养基:CMC-Na 1.5 g,酵母浸粉0.1 g,蛋白胨0.2 g,MgSO4·7H2O 0.1 g,K2HPO4·2H2O 1.0 g,NaCl 0.25 g,Agar 4 g,去离子水200 mL,pH为7[13]。
LB培养基(Luria-Bertani):蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,去离子水1 L[14]。
休-利夫森培养基(Hugh-Leifson medium):蛋白胨2 g,K2HPO4·2H2O 0.2 g,NaCl 5 g ,葡萄糖10 g,Agar 6 g,溴麝香草酚蓝1%水溶液3 mL,去离子水1 000 mL,pH为7[15]。
1.3 菌种筛选
1.3.1 菌种初筛
在无菌环境下,将采集的土壤及玉米秸秆碎块混合样品粉碎后称取1 g,加入装有10 mL 蒸馏水离心管中,在振荡器上震荡30 min,吸取悬浊液1 mL 加入富集培养基,将样品180 r·min-1,30 ℃富集培养72 h。将富集培养的菌液梯度稀释成10-6、10-7、10-83 个 浓 度 梯 度,吸 取0.1 mL 菌液,在鉴别培养基中涂布培养,培养过程中保持环境温度5 ℃。利用刚果红染色法初筛菌株,为防止细菌降解刚果红产生假阳性结果,用培养后染色方法初期鉴别。菌株培养72 h 后,在鉴别培养基中添加1 mg·mL-1刚果红溶液,10~15 min后,倒去刚果红溶液,加入1 mol·L-1NaCl 溶液,15 min后倒掉NaCl 溶液,选取菌落周围出现透明圈菌株备用[16]。
将以上分离单菌落菌株分离纯化后,用培养前染色方式研究菌株纤维素能力。将菌株接种到添加有10 mg·mL-1刚果红溶液的鉴别培养基中央。纤维素降解能力以水解圈(R)与菌落半径(r)比值为指标,记录鉴别培养基中水解圈半径和菌落半径。
1.3.2 菌种复筛
滤纸崩解试验:选取初筛单菌落,接种LB 培养基,25 ℃恒温180 r·min-1培养72 h;将10 cm2定量滤纸片加置培养基中,25 ℃恒温120 r·min-1,以不添加菌株作为空白对照,培养72 h,根据滤纸破损程度分析菌株降解能力。
纤维素酶活性测定:选滤纸崩解复筛单菌落,接种LB 培养基中,25 ℃恒温160 r·min-1培养72 h得到菌液,将菌液使用纱布过滤,过滤后12 000 r·min-1离心5 min,取上清液制成粗酶液。在试管中加入1.5 mL 0.5%CMC-Na 的柠檬酸缓冲液,再加入0.5 mL 粗酶液,轻轻摇晃混合均匀,在50 ℃水浴锅中处理30 min 后取出立即按DNS 法测定糖[17]。通过还原的葡萄糖含量确定室温条件下(25 ℃)酶活性。
1.4 菌种鉴定
1.4.1 形态学鉴定
将待鉴定菌株在鉴别培养基划线得到单菌落,观察其菌落形态。将菌株复染色,在透射电镜下观察其微观形态。
1.4.2 生理生化鉴定
生理生化特征检测参照《常见细菌系统鉴定手册》进行鉴定[14]。微生物利用各种糖、醇类物质发酵特性使用休-利夫森培养基进行鉴别,将待测物质按比例添加用以代替培养基中葡萄糖。
1.4.3 分子生物学鉴定
使用引物27F/1492R[由生工生物工程(上海)股份有限公司合成]扩增16S rDNA 片段。PCR(Polymerase Chain Reaction)反应体系与反应程序如下。
PCR 反应体系(25 μL):ddH2O 9.5 μL,模板DNA 1 μL,引物27F 1 μL,引物1492R 1 μL,50 mmol·L-1MgSO4,5 U·μL-1TaqDNA 聚合酶,10 mmol·L-1dNTP,PCR缓冲液共12.5 μL。
PCR反应程序:95 ℃预变性5 min,94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,循环30 次,72 ℃延伸10 min。
用1%琼脂糖凝胶电泳检测PCR产物,将PCR扩增产物进行测序。测序获得的16S rDNA 基因序列与GenBank 中相关数据分析同源性,分别下载与其同源性最高的序列,用MEGA 5.0 软件“W”功能比对并手工校正后,使用MEGA 5.0 软件邻接法(NJ)构建系统发育树。
1.5 响应面法优化
根据菌株鉴定结果,结合同属菌株生物学特性及发酵参数,根据实际堆肥环境指标,以温度、pH 及接种量3 种因素作为自变量,培养菌液紫外吸光度(OD600)值作为响应变量,试验设置3次重复[18]。对该菌株进行3 因素5 水平正交旋转试验,利用响应面进行建模优化最适生长条件。完成二次回归拟合及方差分析检验,得出各变量最佳参数,检验模型拟合结果。
1.6 堆肥起爆研究
1.6.1 接种剂制备
挑取纯化后菌株单菌落接种至LB 培养基培养,调整菌液浓度为1×109cfu·mL-1,制成接种剂备用。
1.6.2 小型堆肥起爆试验
以玉米秸秆为原料进行堆肥起爆试验。堆肥试验在堆肥容器中进行,堆肥容器为聚苯乙烯泡沫箱,尺寸为460 mm×410 mm×340 mm(长×宽×高),箱内壁厚度为50 mm,将玉米秸秆粉碎至1~2 cm,填充至堆肥箱中,约2 kg干物质,添加尿素调整碳氮比为30:1,含水率控制在65%,设置接种组以及空白对照组,每个处理组3次重复。接种组(J)参考《农用微生物菌剂》(GB 20287-2006)要求,按照秸秆干重2%添加接种剂[19]。对照组(CK)添加相同量水。接种后,堆体充分搅拌均匀。堆肥全程在恒温培养箱中进行,温度保持在5 ℃,每隔12 h测温并翻动堆体保证氧气供应。
1.7 数据处理与分析
利用Excel 2019与R 4.2.0软件统计分析,标准误差用Excel 2019 计算,显著性检验用R 4.2.0 中t.test 函数进行t检验(P<0.01 为极显著)。使用Rstudio进行数据可视化。Design Expert 10.0软件分析响应面试验结果,建立回归模型。
2 结果与分析
2.1 低温纤维素降解菌株初筛
筛选得到一株在培养温度为5 ℃下,鉴别平板上具有降解圈菌株,编号为LYG-01(见图1),刚果红试验结果发现,该菌株菌落半径为4.00 mm,刚果红降解圈半径为10.67 mm。降解圈半径与菌落半径之比为2.74。该比值大于2时,一般认为该微生物具有一定纤维素酶活性[20]。刚果红染色法因刚果红易被分解,可能出现假阳性结果,需作复筛试验进一步验证。
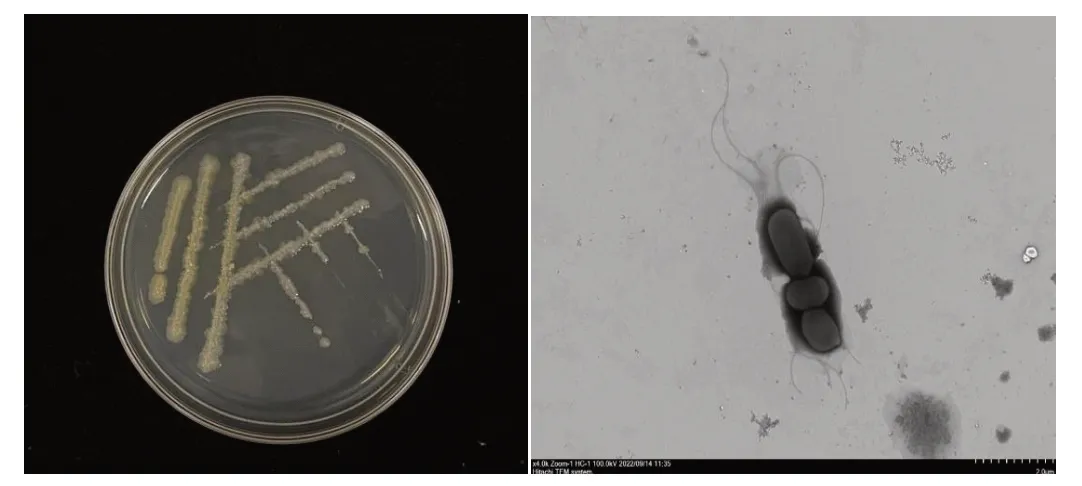
图1 LYG-01的菌落形态与显微形态Fig.1 Colony morphology and micromorphology of LYG-01
2.2 木质纤维素降解能力复筛验证
复筛菌株纤维素降解能力。①滤纸崩解试验,结果发现,72 h后,接种菌剂的培养基内滤纸成团糊状,证明筛选菌株具有降解木质纤维素的能力。②检测菌株纤维素酶活性试验。通过测定菌液制粗酶液酶活性,证实该菌株有纤维素降解能力,通过DNS 法测定该菌株纤维素酶活性为1.77 U·mL-1。
2.3 菌株鉴定
2.3.1 菌株形态学鉴定
菌株形态如图1所示,单菌落为圆形、表面光滑、湿润、菌落颜色为白色、不透明,挑取菌落呈黏稠状。使用透射电镜观察其显微结构发现,该菌呈杆状,有鞭毛,菌体长1~2 μm,宽约1 μm。
2.3.2 菌株分子生物学鉴定
系统发育树(见图2)显示菌株LYG-01 与Lelliottia属菌[Lelliottiasp. GL2(KM458060)]的亲缘关系最近(相似性99.93%),结合其形态特征,将LYG-01 鉴定为Lelliottia属一种(Lelliottiasp.)。按分类学而言,该菌属于变形菌门,γ-变形菌纲,肠杆菌目,肠杆菌科,Lelliottia属。

图2 菌株LYG-01系统发育树Fig.2 Phylogenetic tree of strain LYG-01
2.3.3 生理生化检验
生理生化特征结果显示,该菌种同变形菌门微生物一致,均为革兰氏阴性细菌。接触酶活性呈阴性。除可降解纤维素外,可利用淀粉以及阿拉伯糖。不能利用乳糖,蔗糖及葡萄糖发酵,表明该菌株属于好氧型细菌。甲基红试验呈阴性,说明该菌株为肠杆菌一种,与系统发育分类结果一致。
2.4 响应面优化试验
2.4.1 响应面试验方案与结果
选取3个对培养条件影响较大同时易于控制的因素pH,温度以及接种量,以菌液吸光度作为响应值建立模型。以pH 为6.8,温度为20 ℃,接种量为3%作为中心值建立3 因素5 水平正交旋转的响应面分析试验(见表1)。使用Design Expert 10.0得到具体试验方案(见表2)。
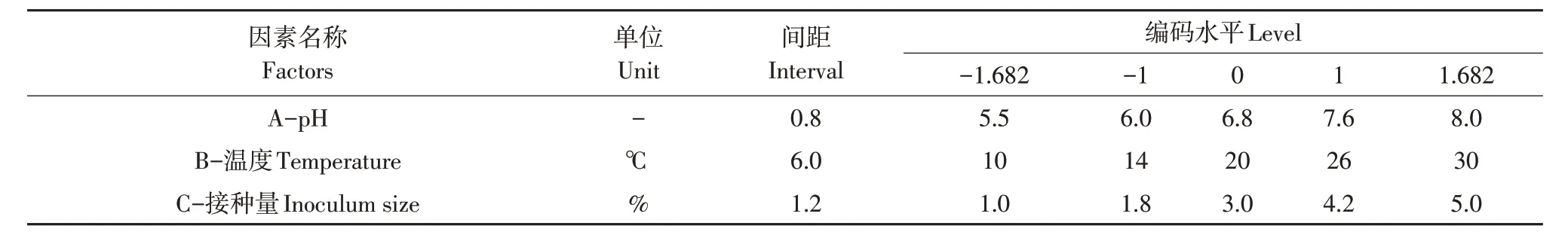
表1 各因子与水平Table 1 Factors and levels
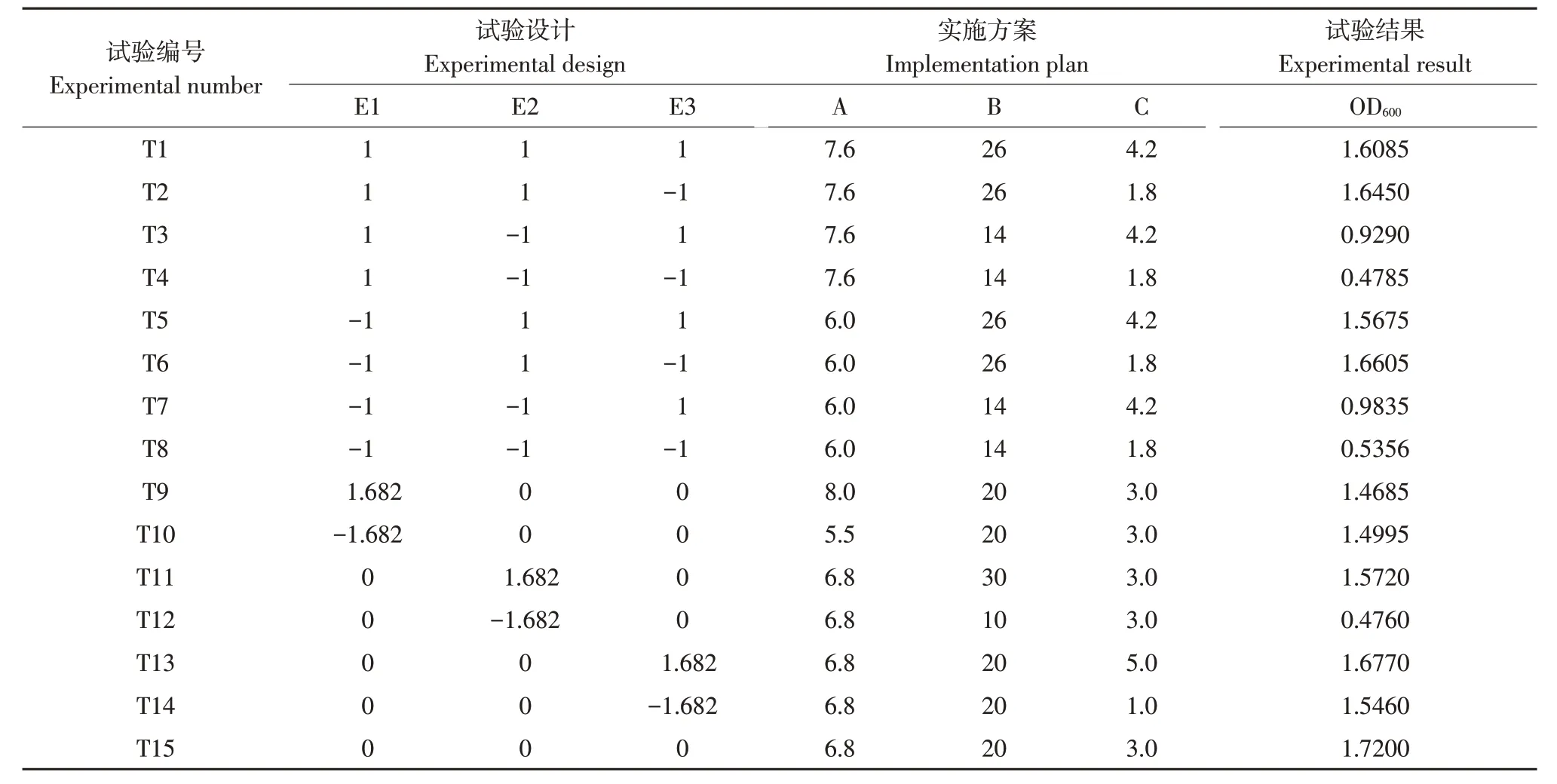
表2 响应面试验方案及结果Table 2 Response surface test scheme and results
2.4.2 回归方程与方差分析
根据试验结果,运用响应曲面法对试验结果进行二次多项式拟合,得出三因素与响应变量OD600之间二次多项式方程如下:
其中,A为pH;B为温度;C为接种量;Y为OD600。
对上述方程进行方差分析,模型F值为10.54,表明该模型拟合结果显著(见表3)。模型F值可能因干扰因素出现的概率仅为0.92%,表明该拟合结果具有高度显著性,该模型符合良好预测。根据回归模型标准化系数绝对值可见,生长条件因素对菌体生长影响作用顺序为:温度>接种量>pH。而交互项中显著性影响因素从强到弱依次是温度与接种量、pH与温度、pH与接种量。二次项中显著性影响因素从强到弱依次为温度、pH、接种量。
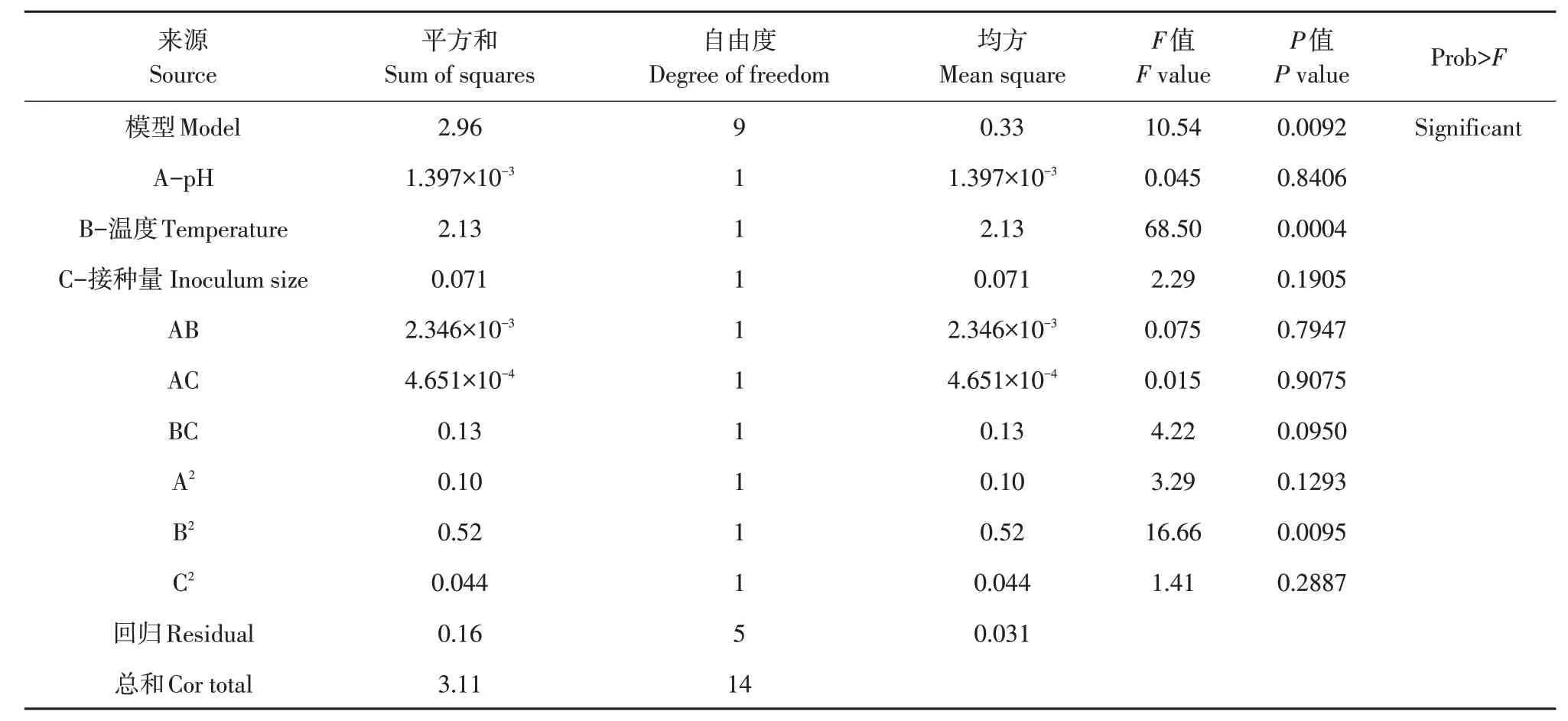
表3 模型方差分析Table 3 ANOVA of the model
对回归模型进一步分析处理,可知在试验设计各因素水平范围内,其他因素为中间水平时,OD600与pH、温度以及接种量间关系如图3 所示。当三因素均为较低水平时,pH 的主效应高于温度与接种量,pH 和接种量的数值相近;当三因素为较高水平时,温度主效应高于pH和接种量。
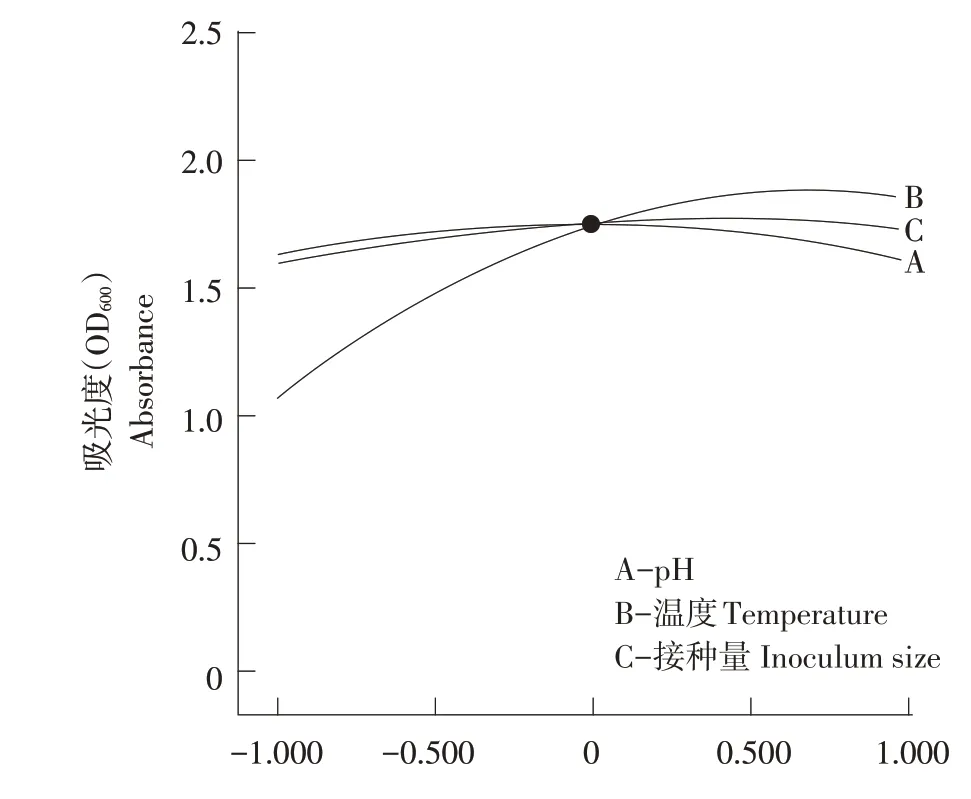
图3 单因素对吸光度的影响Fig.3 Effects of single factor on OD600
2.4.3 响应面曲线图与等高线图分析
响应曲面坡度及等高线偏离程度可反映两两因素间交互作用,响应面坡度越陡,表明二者间交互作用越显著,对微生物培养的影响较大,反之越平缓则影响越小。各因素交互作用响应曲面图以及等高线图如图4 所示。pH 与温度、温度与接种量交互作用显著高于pH与接种量交互作用,该结果与回归模型方程中方差分析检验结果一致。
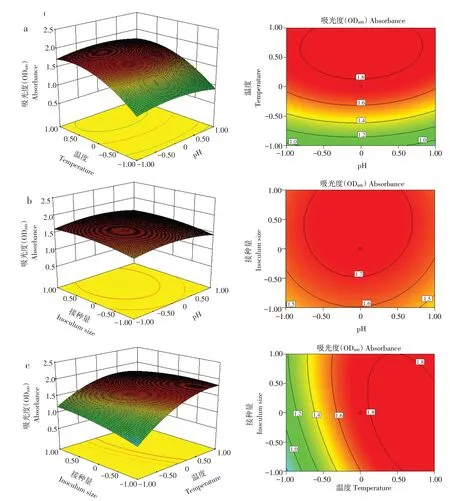
图4 三因素交互作用的响应面和等值线Fig.4 Response surface and contour plots for three factor interaction
由图4a所示,接种量固定在零水平3%时,菌液浓度随温度升高而升高,随pH 升高先升后降,温度和pH有一定负交互作用。由图4b所示,当温度固定在零水平20 ℃时,菌液浓度随接种量浓度升高而升高,随pH升高先升后降,接种量和pH有一定负交互作用。由图4c所示,当pH固定在零水平6.8 时,菌液浓度随温度以及接种量升高而升高,说明温度与接种量为正交互作用。
通过对曲线图与等高线图分析可得出,响应面存在最大值,通过Design Expert 10.0分析结果表明,当pH 为6.8,培养温度为24.18 ℃,接种量达3.12%时,为该菌株最适培养条件。
2.5 堆肥效果试验
小型低温堆肥试验温度变化规律显示(见图5),以温度达到50 ℃作为高温阶段阈值,处理组在第72 h 已达到50.3 ℃,进入高温阶段,对照组则是在第96 h 达到50.7 ℃,进入高温阶段,此时处理组温度为60.2 ℃。从进入高温阶段时间看,处理组比对照组升温时间短33%。同时,从整个升温过程中峰值温度看,处理组在第96 h达到温度峰值60.2 ℃,对照组峰值温度为58.7 ℃,略低于处理组。
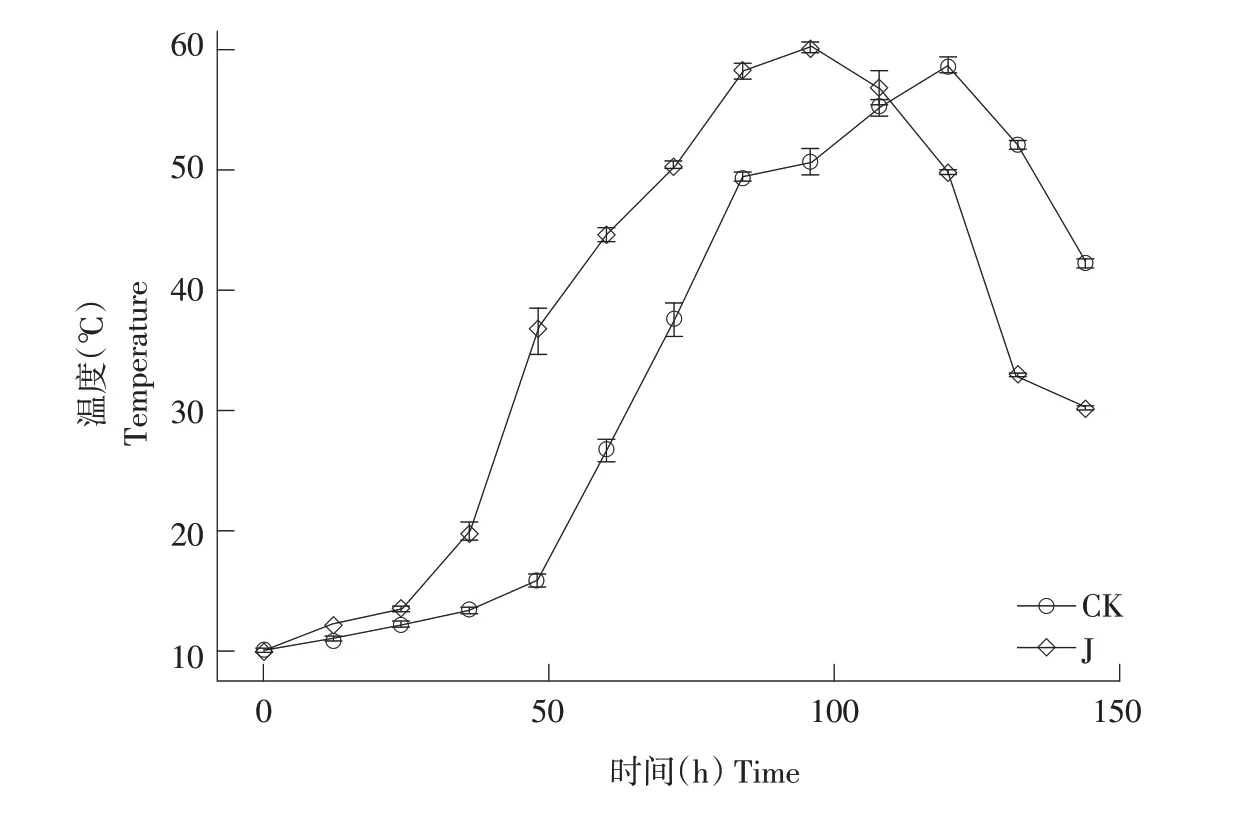
图5 堆肥过程中温度变化Fig.5 Temperature change during composting
从高温阶段持续时间看,处理组高温阶段时间为48 h,对照组高温阶段持续时间却少于24 h。处理组高温阶段比对照组长33%。
试验结果表明,高温阶段对比常温环境下好氧堆肥时间短,除环境温度(5 ℃)过低,堆肥系统内与环境温差过大致使热量迅速流失。原因可能是堆体过小导致热量流失过快,在实际应用时应选用较大体积堆肥或做好堆体保温措施,减少热量流失。
试验结果表明,该菌株可使低温环境下(5 ℃)秸秆好氧堆肥加速升温,延长高温期持续时间,提高峰值温度。综上,该菌株具备制成良好的堆低温肥起爆菌剂的潜力。
3 讨 论
3.1 耐冷纤维素降解菌筛选
本试验从农田土壤中筛选一株在低温环境具有纤维素降解能力的菌株,将其命名为LYG-01。该菌株为Protebacteria中Lelliottia属一类细菌。Protebacteria门微生物在自然界中广泛存在。土壤中分离筛选该门纤维素降解细菌的研究是以Pseudomonadaceae属微生物为主[21]。Lelliotlia作为植物促生菌及重金属污染修复的微生物,部分菌株具有纤维素降解功能[22-24]。与本试验结果一致。
3.2 菌株培养条件优化
微生物培养过程中,可建立数学模型对微生物动态变化进行预测与评价。响应面优化法对培养微生物的优化工作可发挥较好效果,该优化法可对模型进行方差检验确定优化方案准确性以及各因素重要程度。在菌株培养条件优化及菌株产酶优化方面均有应用。实际应用中,因素选择主要为培养温度、pH、接种量、培养时间和培养基转速等。李婷等对降解纤维素的耐冷细菌优化培养研究发现,培养基成分和pH影响耐冷菌生长主要条件[25]。董雪丽等对耐低温纤维素降解菌进行响应面优化发现,接种量与培养时间交互作用对菌株影响显著[26]。结合菌株耐低温的特性,本试验最终选取温度、pH以及接种量进行响应面优化试验。
通过响应面结果看,交互项中显著性影响因素从强到弱依次是温度与接种量、pH与温度、pH与接种量。二次项中显著性影响因素从强到弱依次为温度、pH、接种量。对菌体生长影响最大因素的多项式系数仅为0.4,反映实际培养中,在10~30 ℃,该菌种均可正常生长,即使10 ℃低温环境,仍保持最佳培养条件的56.25%生长速率。对影响较弱的pH,按照模型预测结果,其影响幅度低于10%。说明该菌株对低温环境及环境中pH 均有一定耐性,菌株对环境适应能力强,满足作为低温好氧堆肥接种菌条件。
3.3 接种对玉米秸秆堆肥温度的影响
通过对添加菌剂与空白对照中好氧堆肥温度的研究,验证接种Lelliottiasp.对玉米秸秆好氧堆肥腐熟的影响。温度是影响堆肥当中微生物活动以及堆肥腐熟的重要因素。在堆肥过程中,以50 ℃为阈值通过温度变化将堆肥分为3个阶段:升温阶段、高温阶段与降温阶段。温度是反映好氧堆肥过程是否顺利的标志,可用作评判堆肥过程的指标。堆肥过程中温度产生的本质为微生物进行的生命活动。试验结果表明,处理组比对照组更快进入高温阶段,这可能是因接种菌剂增加堆体初期微生物丰度,同时,因易降解物质被快速降解,处理组较对照组退出高温阶段更早,与Wang等研究结果一致[9]。因易降解的有机物及纤维素等物质被分解,导致堆体更有利于微生物生长繁殖,使处理组对比对照组保持高温阶段更久,与本试验及Sun 等研究结果一致[8]。综合升温速度以及高温阶段持续时间,Lelliottia sp.接种对玉米秸秆堆肥发挥积极影响。
本研究存在一定局限,温度仅反映部分堆肥过程信息,在后续试验中将研究堆肥过程中各类理化指标及堆肥各阶段微生物群落信息,对Lelliottia sp.接种玉米秸秆堆肥效果进行全面研究。
4 结 论
本试验利用刚果红检验法与低温环境培养筛选方法,从腐烂玉米秸秆及周围土壤中筛选出一株在低温环境具有木质纤维素降解能力菌株,DNS法测定该菌株CMC 酶活性为1.77 U·mL-1,通过滤纸崩解试验与酶活性检验证明其有一定的木质纤维素降解能力。
通过鉴定其形态及分子生物学方式,确定其为Lelliottia属菌一种。响应面分析结果表明,对菌体生长促进作用顺序为:温度>接种量>pH。当pH为6.8,培养温度为24.18 ℃,接种量达到3.12%时,为该菌株最适培养条件。
通过小型堆肥试验测试其起爆效果发现,添加菌剂处理较对照组而言,升温至高温阶段时间缩短33%,同时高温阶段时间延长33%。该菌株可显著提高堆体升温速度,并增加高温期时间。该菌株的发现对丰富低温环境下秸秆好氧堆肥接种菌剂资源具有重要意义,为进一步开发工程菌株提供新菌源。
