miR-19a对民猪前脂肪细胞分化影响的研究
2023-05-22李皓月
刘 娣 ,李皓月,马 红,汪 亮
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.黑龙江省农业科学院畜牧研究所,哈尔滨 150086)
民猪是我国地方品种,主要分布在东北地区,具有抗逆性强、肉质好、抗寒等特点[1],脂肪沉积情况直接影响民猪抗寒能力[2]。根据脂肪组织分布位置不同分为皮下脂肪、肌内脂肪及内脏脂肪。皮下脂肪占民猪总脂肪含量70%左右,大部分存在于皮下,如背部脂肪、腋下脂肪等,主要发挥保护、隔热及储存能量功能[3]。
microRNA 是内源性启动的非编码RNA,由19~25个核苷酸组成,通过和靶基因mRNA碱基配对引导沉默复合体(RISC)降解mRNA 或阻碍其翻译,发挥转录后控制基因表达作用[4]。microRNA已被发现参与多种生理过程,在细胞增殖、分化、肿瘤发生、神经元发育、脂肪形成等过程中发挥关键作用[6-7]。miR-19a属于miR-17-92基因簇,参与脂肪组织的胰岛信号转导。miR-19a已被证实促进鸡前脂肪细胞增殖[8],但在民猪中研究较少。
转录因子KLFs 家族(Krüppel-like factors)是DNA结合转录调节因子家族成员,在脂肪细胞分化过程中发挥重要作用[9]。Jiang 等研究发现,KLF13通过调节PPARγ 促进猪脂肪细胞分化[10]。生物信息学分析表明,miR-19a靶作用于KLF13基因。为揭示民猪miR-19a作用及其作用机制,本研究开展miR-19a 靶作用于KLF13 基因鉴定与分析及miR-19a对脂肪分化调控机制的研究。
脂肪在民猪抗寒过程中发挥重要作用,本研究通过对miR-19a 靶作用于KLF13 基因的鉴定分析及miR-19a 对脂肪分化标志基因的作用,探究miR-19a对民猪脂肪沉积的影响,为研究民猪脂肪分化过程调控提供依据。
1 材料与方法
1.1 主要试剂及仪器
Trizol、DMEM/F12 培养基、荧光定量试剂均购自Life techonogies 公司;Lipofectamine 2000、胰蛋白酶、反转录试剂盒、磷酸盐缓冲溶液(PBS)、胎牛血清(FBS)均购自TaKaRa 公司;青链霉素混合液、地塞米松(DEX)、三碘甲状腺原氨酸(T-3)、3-异丁基-1-甲基黄嘌呤(IBMX)、吲哚美辛、罗格列酮、胰岛素、Ⅳ型胶原酶、油红O染液均购自Sigma 公司;MicroRNA 模拟物、抑制剂、NC均由安徽通用生物系统有限公司设计合成。
1.2 样品采集
实验动物取自黑龙江省农业科学院畜牧研究所养殖基地,采集6月龄东北民猪心脏、肝脏、脾脏、肺、肾、肌肉和皮下脂肪组织用于提取RNA,采集1月龄东北民猪背部皮下脂肪组织用于前体脂肪细胞培养。
1.3 民猪前体脂肪细胞分离培养
取民猪脂肪组织,使用PBS清洗,将组织块剪碎,加入两倍体积Ⅰ型胶原酶消化、离心后,取民猪前脂肪细胞,放于37 ℃、5%CO2培养箱中。
1.4 细胞转染
待细胞密度长至70%~80%时转染(35 mm皿为例),按照说明书将合适浓度模拟物、抑制剂或NC 与250 μL 的DMEM/F 12 混 匀,5 μL Lipofectamine 2000 与250 μL 的DMEM/F 12 混匀。再将二者混合孵育15 min,逐滴加入培养皿中,24 h后换液。
1.5 前脂肪细胞诱导成脂
前脂肪细胞转染后24 h 换液,更换为2 mL 完全培养基(含1%双抗、10%FBS),每毫升培养基中含终浓度1 μmoL a.i.·L-1吲哚美辛、0.5 μmoL a.i.·L-1IBMX、5 ng a.i.·mL-1胰岛素、1 μmoL a.i.·L-1罗格列酮、1 μmoL a.i.·L-1地塞米松、1 μmoL a.i.·L-1三碘甲状腺原氨酸(T3),2 d 后换液,替换成含有终1 μmoL a.i.·L-1三碘甲状腺原氨酸(T3)、浓度5 ng a.i.·mL-1胰岛素、1 μmoL a.i.·L-1罗格列酮的完全培养基(含1%双抗、10%FBS)。
1.6 RNA提取及RT-qPCR检测
根据说明书使用Trizol 法提取RNA,提取的RNA根据反转录试剂盒说明书反转录为cDNA,在LightCycler®96荧光定量PCR仪中进行PCR反应。
1.7 KLF 13基因3′UTR双荧光素酶报告基因载体构建
以民猪前脂肪细胞cDNA为模板,用KLF13-F和KLF13-R引物,PCR扩增KLF13的3′UTR区。回收扩增片段,将目的片段插入psiCHECK-2 vector,构建psiCHECK-2-KLF13-3′-UTR-WT(野生型)。采用重叠延伸方法突变KLF 13 基因3′UTR 区中miR-19a 结合位点,构建相应的突变型KLF 13 基因报告载体(见图1)。所有构建载体均测序验证结果无误。

图1 KLF13 3′UTR序列和突变序列对比Fig.1 Comparison of KLF13 3′UTR sequence and mutant sequence
1.8 双荧光素酶报告基因活性分析
将PK15 细胞接种至12 孔板(2.5×105个·孔-1)中,待融合至80%以上时将野生型报告载体和突变型报告载体分别与miR-19a 模拟物和NC 共转染到PK 15 细胞,转染后24 h,使用Promega GloMax 20/21 和Dual Luciferase Reporter AssayKit 试 剂 盒 检测双荧光素酶活性。试验步骤严格参考试剂盒说明书操作。
1.9 油红O染色
将诱导分化至8 d 的前脂肪细胞去除培养基,PBS轻洗3次,加入1 mL 4%甲醛溶液固定30 min,PBS洗3次去除甲醛,加入油红O工作液1 mL,避光染色30 min 后,吸出工作液,再用PBS 清洗3次,使用相差显微镜观察。
1.10 统计分析
用Excel 2019处理数据,GraphPad Prism 8.0.2.236绘制图像,由SPSS 26分析获得统计学结果,采用单因素方差分析,油红O染色脂滴计数使用image J 8.0。P<0.05表示差异显著,P<0.01表示差异极显著。实时荧光定量PCR结果采用2-△△ct法计算。

表1 引物序列Table 1 Primer sequences
2 结果与分析
2.1 民猪miR-19a和KLF13组织表达谱分析
为研究miR-19a 和KLF13 在民猪不同组织中表达模式,取6 月龄民猪心、肝脏、脾、肺、肾、肌肉和脂肪组织,实时荧光定量PCR检测miR-19a及KLF13相对表达量。结果显示,miR-19a在心脏和肌肉表达量最高,其次是肝脏、肺、肾和脂肪,脾中表达量最低(见图2)。KLF13在心脏表达量最低,其次是肌肉、肝脏、脂肪、脾脏和肾脏,肺中表达量最高(见图3)。

图2 miR-19a在民猪不同组织表达情况Fig.2 Expression of miR-19a in different tissues of Min pigs

图3 KLF13在民猪不同组织表达情况Fig.3 Expression of KLF 13 in different tissues of Min pigs
2.2 KLF13基因3′UTR区miRNA结合位点分析
根据TargetScan 和Ensembl 网站分析猪KLF13基因(NM_001011505.1)mRNA 的3′ UTR 序列。结果表明,KLF13 基因是miR-19a 的一个潜在靶基因,KLF13 基 因3′ UTR 序 列 中192~197 bp 与miR-19a 成熟序列3~9 bp 完全互补。对人、小鼠、猪、兔KLF13 基因3′ UTR 序列对比发现,上述物种KLF13 基因3′ UTR 均具有该保守miR-19a 结合位点(见图4),提示KLF13 基因3′ UTR可能是miR-19a 结合位点参与KLF13 基因表达调控。

图4 不同物种KLF13基因3′UTR与miR-19a结合位点对比Fig.4 Comparison of 3'UTR and miR-19a binding sites of KLF13 gene in different species
2.3 miR-19a 模拟物和抑制剂对KLF13 3′UTR 双荧光素酶报告基因表达的影响
为进一步验证miR-19a 对KLF13 基因调控作用,构建KLF13 基因3′UTR 报告基因载体psi-CHECK-2-KLF13-3′-UTR-WT(野生型)和psi-CHECK-2-KLF13-3′-UTR-MUT(突变型),序列测序结果完全正确(见图5)。

图5 野生型载体和突变型载体测序结果对比Fig.5 Comparison of sequencing results of wild-type vector and mutant vector
共转染至PK 15细胞,转染后24 h检测荧光强度,计算比值。结果表明,miR-19a 和WT 共转海肾荧光和萤火虫荧光比值与对照组对比,结果极显著降低(P<0.01),降低1.5 倍(见图6)。而miR-19a与MUT共转则对荧光比值结果与对照组相比无差异,说明miR-19a 可与KLF 13 3′UTR 结合位点结合,抑制KLF 13表达。

图6 双荧光素酶报告基因载体荧光强度结果Fig.6 Fluorescence intensity results of dual luciferase reporter gene vector
2.4 miR-19a 模拟物和抑制剂对内源性KLF13 基因表达的影响
通过结合位点分析初步预测miR-19a 影响KLF13 基因表达,为进一步验证KLF13 是否为miR-19a 靶基因,转染miR-19a 的模拟物与抑制剂,24 h 后回收细胞,进行荧光定量PCR 检测miR-19a 和KLF13 表达量。结果表明,过表达miR-19a 模拟物后,miR-19a 表达量极显著提高(P<0.01),是对照组350 倍;KLF13 mRNA 表达水平极显著降低(P<0.01),降低至0.3 倍。过表达miR-19a 抑制剂后,miR-19a 表达量极显著降低(P<0.01),与对照组相比降低至约0.2 倍;KLF13表达水平显著提高(P<0.05),提高至1.6 倍(见图7)。结果表明,miR-19a对KLF13的表达具有负调节功能。

图7 过表达及抑制miR-19a后miR-19a和KLF13表达情况Fig.7 Overexpression,miR-19a,KLF13 expression after inhibition of miR-19a
2.5 miR-19a 模拟物和抑制剂对脂肪分化标志基因表达的影响
检测转染诱导分化后2 d 脂肪分化标志基因,脂肪分化标志基因选取KLF13、LPL、AP2、C/EBPα、NFR1、PPARα、BRCA1和ALDH1A1。过表达miR-19a 后,KLF13、LPL、C/EBPα、NFR1、ALDH1A1表达量极显著降低(P<0.01),与对照组相比,分别降低至0.2、0.1、0.2、0.15、0.3倍;AP2、PPARα、BRCA1表达量显著降低(P<0.05),降低至0.4、0.5、0.4倍。抑制miR-19a表达后,KLF13、LPL、NRF1、PPARα 表达量与对照组相比极显著升高(P<0.01),分别升高1.7、2.8、10.5、1.8 倍;AP2、C/EBPα、BRCA 1、ALDH1A1 表达量显著升高(P<0.05),升高1.3、1.35、1.3、1.37倍(见图8)。结果表明,miR-19a可负向调控脂肪分化标志基因表达。
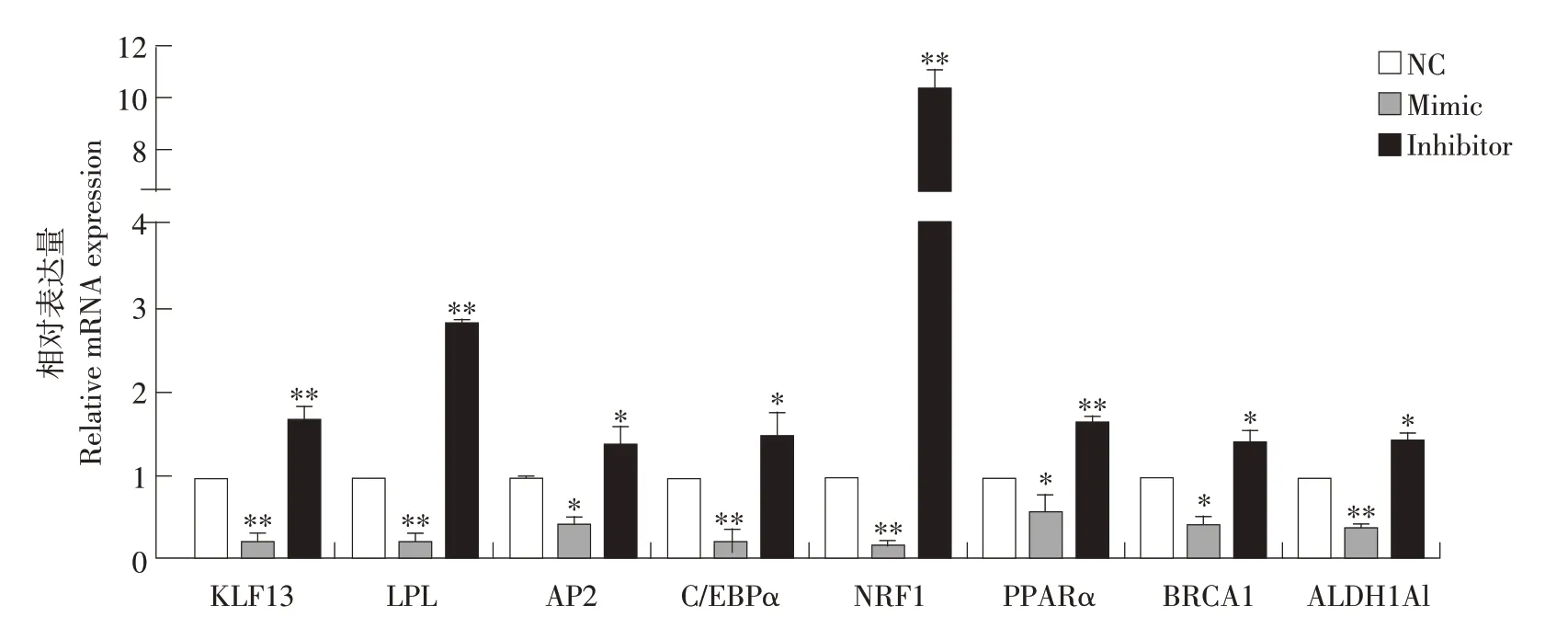
图8 脂肪分化标志基因表达情况Fig.8 Expression of adipogenic differentiation marker genes
2.6 miR-19a 模拟物和抑制剂对脂肪酸代谢标志基因表达的影响
检测转染诱导分化后2 d 脂肪酸代谢基因表达量,脂肪酸代谢标志基因选取RXRA、LIPE、PDGRFA 和RARB 基因,过表达miR-19a后,RXRA、PDGRFA 和RARB 表达量极显著升高(P<0.01),与对照组相比,分别升高2.7、2.0、1.8 倍,LIPE 表达量无变化。抑制miR-19a表达后,RXRA、PDGRFA、RARB 表达量显著降低(P<0.05),分别降低至0.6、0.5、0.4 倍(见图9),而LIPE 表达量极显著提高(P<0.01),提高1.8 倍。结果表明,miR-19a 可正向调控多个脂肪酸代谢标志基因表达,对LIPE 调控机制尚不明确。

图9 脂肪酸代谢相关基因表达情况Fig.9 Expression of genes related to fatty acid metabolism
2.7 miR-19a 模拟物和抑制剂对前脂肪细胞成脂影响及油红O染色鉴定
民猪前脂肪细胞转染miR-19a模拟物、抑制剂及对照后诱导细胞成脂,为保证模拟物和抑制剂持续发挥作用,间隔1 d对细胞转染1次,诱导成脂8 d,对细胞进行油红O 染色,结果如图10 所示。与NC 相比,转染miR-19a 模拟物诱导分化8 d 形成的脂滴数极显著降低(P<0.01),降低至105 937;转染miR-19a 抑制剂诱导分化8 d 形成的脂滴数与NC 相比极显著提高(P<0.01),提高到304 818(见图11)。结果表明,miR-19a 可负向调控民猪前脂肪细胞脂滴形成。

图10 过表达、抑制miR-19a油红O染色Fig.10 Overexpression,inhibition of miR-19a oil red O staining

图11 诱导成脂油红O染色脂滴数量Fig.11 Number of lipid droplets induced into lipid oil red O staining
3 讨 论
miRNA 对基因表达具有重要调控作用。在动物中,miRNAs 通过结合目标mRNA 3′UTR 互补序列导致翻译抑制或基因沉默[11],许多研究表明,miRNA可促进或抑制前脂肪细胞分化[5-8]。miR-19a已被证实在肌肉细胞增殖、分化和心肌细胞增殖过程中具有重要作用[13-14]。因此在组织表达谱中,心脏组织和肌肉组织有较高表达量。
为研究miR-19a在民猪前脂肪细胞分化作用的分子机制,发现过表达miR-19a下调脂肪分化标志基 因 LPL、 AP2、 C/EBPα、 NFR1、 PPARα、BRCA1 和ALDH1A1 的表达。甘油三酯脂肪酶(LPL)主要由脂肪细胞、骨骼肌细胞、心肌细胞分泌,在3T3-L1 脂肪细胞中,抑制LPL 表达可抑制脂肪积累[12],C/EBPα、脂肪酸结合蛋白(AP2)、氧化应激刺激核呼吸因子1(nuclear respiratory factor 1,NFR1)、PPARα在脂肪细胞分化过程中发挥促进作用[15-17],Jackson 等通过诱导BRCA1 DNA 修复相关基因(BRCA1 DNA repair associated,BRCA1)降低线粒体呼吸提高脂肪积累[18],Hu 等研究结果显示,乙醛脱氢酶1 家族成员A1(aldehyde dehydrogenase 1 family member A1,ALDH1A1)可促进脂肪分化[19],本试验结果说明miR-19a对脂肪分化标志基因发挥负调控作用;过表达miR-19a上调脂肪酸代谢标志基因RXRA、PDGRFA、RARB 的表达,RXRA、维甲酸受体β(维甲酸受体β,RARB),RXRA 与PPARS 结合促进糖代谢与脂代谢,RARB 和RXRA 可降低牛肌内脂肪形成[20],Lee等通过高脂饲养发现小鼠中的血小板衍生生长因子受体α(platelet derived growth factor receptor alpha,PDGFRα),PDGFR+细胞通过高脂饲养可增加脂肪细胞分化[21],Taniguchi 等研究发现PDGRFα表达量与PPARα 表达量呈负相关[22],本试验说明miR-19a 对脂肪酸代谢标志基因发挥正调控作用;过表达后诱导分化8 d脂滴数量降低,反之,miR-19a 可能对前脂肪细胞诱导分化发挥负调控作用。脂肪分化标志基因和脂肪酸代谢标志基因变化趋势与Jackson 等研究结论一致,脂肪酶E(lipase E,LIPE)通过编码调控激素敏感脂肪酶促进脂肪积累,LIPE 在过表达时无变化而抑制时显著升高,可能是因LIPE 主要作用是脂肪积累[23],过表达miR-19a时仅能减少脂肪细胞分化,不能完全抑制分化,因此LIPE 与对照组相比无明显变化,抑制miR-19a 时脂肪累计增加,LIPE 显著提高。基于模拟或抑制miR-19a表达对成脂分化标志基因和脂肪酸代谢标志基因的调控作用及诱导8 d 油红O 染色结果,证明miR-19a在民猪前脂肪细胞分化过程中发挥负调控作用。
通过在线软件预测miR-19a 可能的靶基因,KLF13是miR-19a靶基因之一,生物信息学分析显示,KLF13基因3′UTR具有保守的miR-19a结合位点,大量研究证明KLF 家族在调节脂肪细胞分化中发挥重要作用[24-25]。本试验通过转染miR-19a 模拟物或抑制剂显著降低或提高KLF13 表达量,为进一步验证二者关系,KLF13基因3′UTR报告基因分析和定点突变分析证实KLF13 是miR-19a 靶基因。Jiang 等研究结果表明,KLF13 通过结合PPARγ的Promotor区激活表达,促进猪脂肪细胞分化[26],说明miR-19a可能通过调节KLF13表达调控脂肪形成。大多数miRNAs 通过与靶基因mRNA的3′UTR 不完全互补配对,抑制靶基因mRNA 翻译,调节靶基因表达,这种作用方式影响蛋白表达水平[11]。本试验未进行蛋白层面验证,未来将补充过表达或抑制miR-19a后KLF13蛋白表达情况,进一步明确miR-19a对KLF13的调控作用。
4 结 论
本试验发现,miR-19a在民猪前脂肪分化过程中发挥负调节作用,证明促进猪脂肪分化基因KLF13 是miR-19a 靶基因,结果为进一步研究miR-19a是否通过影响KLF13表达进而影响民猪前脂肪细胞分化提供支持,也为分析microRNA 对民猪前体脂肪细胞分化调节提供参考。
