真海鞘根索和被囊乙醇提取物抑癌活性成分的分离及其作用机制研究❋
2023-05-22韩善浩李建辉祝玉婷高宏伟
韩善浩, 李建辉, 祝玉婷, 高宏伟, 董 波,3❋❋
(1. 中国海洋大学海洋生命学院 海洋生物遗传与育种教育部重点实验室, 山东 青岛 266003; 2. 青岛海关检测技术中心, 山东 青岛 266114; 3. 中国海洋大学海洋生物多样性与进化研究所, 山东 青岛 266003)
恶性肿瘤严重威胁着人类的生命健康。在中国,癌症发病率和死亡率一直在上升[1]。死亡率最高的癌症为肺癌,其次是肝癌和胃癌[2]。肿瘤的治疗方法主要有手术疗法、放射疗法以及化学药物疗法。其中化学药物疗法的成效已初步显现,肿瘤患者的生存时间明显增长。但对于一些死亡率较高的癌症,化学药物仍具有毒副作用大、治疗效率低、肿瘤细胞易耐药等问题。因此,寻求高效、毒性小、特异性强的抗肿瘤化学药物成为解决癌症疾病的当务之急[3]。
海鞘作为被囊动物,在生物进化史上处于无脊椎动物到脊椎动物的进化节点[4]。由于其多样性和广泛的适应性,决定了海鞘次级代谢产物的结构新颖性和功能多样性[5]。第一个在海鞘中发现的具有活性的化合物为香叶醇对苯二酚,具有抗白血病的细胞毒性[6]。此后,越来越多海鞘来源的天然活性化合物被报道,包括生物碱、多肽、聚酮、醌类以及甾体等物质,表明海鞘具有极大的药用挖掘价值[7],是海洋天然活性产物的重要来源[8]。从海鞘(Trididemnumsolidum)中分离得到的环肽Didemnin B在1984年进入一期临床试验阶段,成为第一个进入临床研究的海洋药物[9]。Didemnin B具有环状脱氢肽的新颖结构,对多种肿瘤细胞具有细胞毒性,此外还具有抗病毒的生物功能[10]。Didemnin B通过抑制蛋白质的生物合成来产生细胞毒性及免疫抑制作用[11]。而在这之后,又从加勒比海海鞘(Ecteinascidiaturbinate)中分离得到Ecteinascidin 743(ET-743),该化合物属于生物碱,具有广谱的抗癌活性,被称为海洋药物史上里程碑式的发现之一[12]。ET-743具有独特的作用机制,在体外能够抑制转录依赖的核苷酸切除修复途径,以及通过影响细胞周期来促进非p53途径依赖的细胞凋亡[13]。在临床上ET-743也显示出较高的应用价值[14]。
真海鞘属于脊索动物门、尾索亚门、海鞘纲[15]。主要分布于日本海南鹿半岛以北以及韩国东、南海岸。由于其含有丰富的营养物质,例如二十碳五烯酸、二十二碳六烯酸、类胡萝卜素、牛磺酸、血浆原和其他微量营养素等[16],日本、韩国和中国都开展了真海鞘的人工养殖[17]。近年来,在真海鞘中发现具有抗肿瘤活性的真海鞘内囊酶解物[18]、抗微生物的血细胞凝集素等[19]。但关于真海鞘抗肿瘤活性的天然小分子报道甚少,且缺乏作用机制方面的研究工作[20]。
本研究采用真海鞘为原料,以乙醇为介质提取真海鞘根索及被囊中的天然活性产物。利用硅胶柱层析、液相层析等方法对其进行分离纯化,并利用肿瘤细胞系研究其作用机制。
1 材料与方法
1.1 实验材料
真海鞘采于山东省荣成市寻山集团。高糖培养基(DMEM)、胎牛血清(FBS)和1X磷酸缓冲盐溶液(PBS)均购买于Biological Industries (Israel)。噻唑蓝(MTT)试剂盒购买于Sigma-Aldrich (St. Louis, MO, USA)。有机试剂均购买于国药。薄层层析(TLC)所用硅胶制备板来自默克。硅胶来自于青岛海洋化工集团。HepG2细胞来自中国海洋大学陈西广教授实验室,HeLa细胞和L929细胞来自中科院上海细胞库,HT-1080细胞来自中国海洋大学实验中心。细胞培养所用耗材包括96孔细胞培养板(Thermo Fisher,167008)、24孔细胞培养板(CORNING,3524)、6孔细胞培养板(Thermo Fisher,140675)和细胞培养瓶(Thermo Fisher,156367)。
1.2 活性物质制备与纯化
1.2.1 真海鞘根索和被囊乙醇提取物的制备 解剖取真海鞘根索和被囊,破碎机打碎约40目,将碎屑在95%乙醇中震荡浸泡1周。
1.2.2 硅胶柱层析 乙酸乙酯-石油醚体系作为流动相。将乙醇提取物原液拌于200~300目硅胶中。待样品干于硅胶中后进行干法装柱。最下端为300~400目硅胶,高度约为40 cm,上层为样品,最上层为60~80目硅胶用于缓冲。装好层析柱之后,使用极性较小的石油醚对硅胶柱进行浸润。浸润完成后依次采用洗脱剂石油醚∶乙酸乙酯=1∶3(800 mL)、1∶2(400 mL)、1∶1(200 mL)、甲醇(500~700 mL)进行洗脱,得到ST-Ⅱ。采用二氯甲烷-甲醇体系进行制备型薄层层析(PLC)。将ST-Ⅱ点于默克制备型硅胶板上,流动相条件为二氯甲烷∶甲醇=30∶1。层析结束后得到目的样品。
1.2.3 制备液相纯化 以色谱级甲醇(国药)、纯水为流动相,流动相极性由小到大(甲醇含量逐渐减小)进行分离条件的摸索,在甲醇∶水=7∶3时对ST-Ⅱ-Ⅱ的分离效果最佳。制备时每次进样量为200 μL,按照各样品出峰时间手动接样。制备液相所用色谱柱为Kromasil C18反向色谱柱,液相型号为日立L-2000型液相。
1.2.4 化合物的结构解析1H NMR谱,1H-1H COSY谱均来自BRUKER AVANCE III HD 600 MHz核磁共振波谱仪。约1 mg样品加入含有0.03%四甲基硅烷(Tetramethylsilane,TMS)的氘代DMSO,混合均匀,装入核磁管中待测,室温测定。NMR谱图通过Bruker Topspin 4.0.8及Mest Re Nova9.0.1软件处理。
1.3 体外活性及机理研究
1.3.1 细胞培养 HeLa细胞和HepG2细胞均使用含15%胎牛血清(BI)和1%青霉素-链霉素溶液的DMEM培养基培养。L929细胞使用含15%胎牛血清(Gibco)和1%青霉素-链霉素溶液的DMEM培养基培养。细胞在提供95%空气,5%二氧化碳的37 ℃培养箱(Thermo scientific)中培养。
1.3.2 MTT(噻唑蓝)比色法 采用MTT体外检测法检测ST-Ⅱ-Ⅱ对各细胞系的增殖抑制率[21]。将各细胞系种在96孔板上,37 ℃培养24 h,待细胞的密度长到60%左右时吸去旧培养液,加入含有不同浓度ST-Ⅱ-Ⅱ的培养液。继续37 ℃培养48 h后吸去旧培养液,加入配置好的MTT染液,MTT染液由90%无血清的DMEM培养基和10%的MTT染液组成。37 ℃孵育4 h后吸去染液,每孔加入100 μL DMSO,37 ℃孵育5 min后在490 nm吸光度下检测对照组和实验组的吸光度值,并计算增殖抑制率。
1.3.3 DAPI细胞核染色 使用4,6-二脒基-乙-苯基吲哚(DAPI)染细胞核,观察细胞核形态的方法作为细胞凋亡的一种指标[22]。将HepG2细胞种在6孔板上,6孔板底部放置一片细胞爬片,使HepG2细胞爬片,便于后续拍照,37 ℃孵育24 h。待细胞密度达到孔的60%~70%后,吸去旧的培养液,加入含有70 μg/mL ST-Ⅱ-Ⅱ的培养液。之后37 ℃孵育24 h,取出细胞爬片,放置于载玻片上,DAPI染色后封片,激光共聚焦显微镜(ZEISS LSM-900)拍照。
1.3.4 Annexin V-FITC/PI染色检测细胞凋亡 将HepG2细胞种在6孔板上,37 ℃孵育24 h。吸去旧培养液,实验组加入含有70 μg/mL ST-Ⅱ-Ⅱ的培养液,然后37 ℃再次孵育24 h。用胰蛋白酶消化细胞并收集于EP管中后,加入染料,避光染色15 min,随后置于冰浴中。1 000 r/min离心去除染液,加入适量PBS重悬细胞,使用流式细胞仪(贝克曼库尔特Cyto FLEX)检测对照组和实验组凋亡细胞比例。
1.3.5 细胞活性氧(ROS)检测 将HepG2种在6孔板上,37 ℃孵育24 h。吸去旧培养液,实验组加入含有70 μg/mL ST-Ⅱ-Ⅱ的培养液,再次37 ℃孵育24 h。使用DCFH-DA探针染色15 min。15 min后,使用不含血清的DMEM培养基洗涤染料3次。洗涤完成后,板中加入适量PBS缓冲液,倒置于荧光显微镜(品牌:尼康)拍摄。
1.3.6 细胞线粒体膜电位检测 将HepG2接种在6孔板上,37 ℃孵育24 h。吸去旧培养液,实验组加入含有70 μg/mL ST-Ⅱ-Ⅱ的培养液,再次37 ℃孵育24 h。使用JC-1探针对HepG2细胞进行染色,染色时在37 ℃培养箱中染色20 min。使用JC-1染色缓冲液洗涤2次,随后孔内加入适量PBS缓冲液防止细胞干燥。最后采用酶标仪(Tecan Infinite E Plex)检测荧光强度。JC-1单体采用490 nm激发波长,530 nm发射波长。JC-1聚合物采用525 nm激发波长,590 nm发射波长。
1.3.7 Western Blot检测 将HepG2接种在6孔板上,37 ℃孵育24 h。吸去旧培养液,实验组加入含有70 μg/mL ST-Ⅱ-Ⅱ的培养液,37 ℃再次孵育24 h。孵育完成后,用胰蛋白酶消化细胞,并收集于EP管中。随后裂解细胞提取蛋白。蛋白提取完成后,上样进行SDS-PAGE电泳。电泳完成后,湿法转膜。转膜完成后,使用5%脱脂牛奶封闭1 h。随后将一抗按照1∶500比例稀释后4 ℃过夜孵育。一抗孵育完成后,将PVDF膜(默克)取出,使用TBST清洗3次,每次15 min。二抗按照1∶1 000比例稀释后在室温下孵育1 h。二抗孵育完成后,再次在TBST中清洗3次,每次15 min。清洗完成后,显色拍照。
2 结果
2.1 真海鞘根索被囊乙醇提取物活性物质的分离与活性验证
真海鞘的构造可以分为3部分:外部包围着一层坚硬的壳,呈橙红色;壳顶部有生殖根;壳内部为其身体组织,呈橙色(见图1A)。

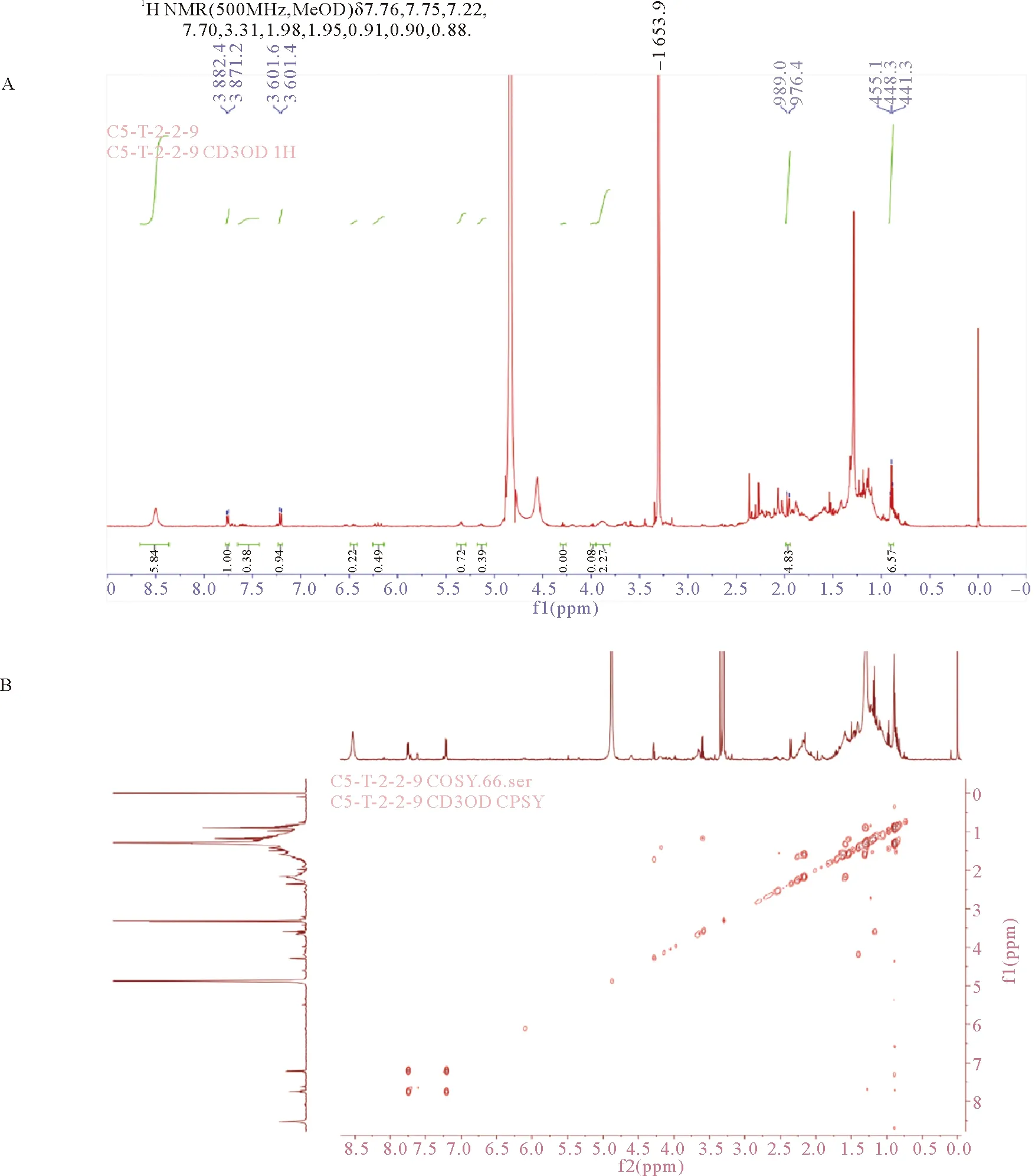
(A. 真海鞘成体及其3个组成部分;B. 根索和被囊乙醇提取物与内囊乙醇提取物对HepG2细胞的细胞毒性,2组实验组浓度均为200 μL/mL ,对照组加入含有与实验组等量乙醇的培养液,p<0.001,0.01 首先本文作者使用95%乙醇提取根索被囊以及内囊中的天然活性产物。利用MTT比色法检测两部分的乙醇提取物是否具有细胞毒性。MTT比色法检测结果表明根索被囊乙醇提取物对HepG2细胞具有极强的细胞毒性,内囊乙醇提取物对HepG2细胞具有较弱的细胞毒性(见图1B)。同时根索被囊乙醇提取物对L929细胞的毒性较小(见图1C)。采用硅胶柱层析分离根索被囊乙醇提取物得到两部分,第一部分命名为ST-Ⅰ,第二部分命名为ST-Ⅱ。MTT比色法检测结果表明ST-Ⅱ对HepG2细胞具有较强的细胞毒性(见图1D)。 得到ST-Ⅱ后,采用PLC法,在二氯甲烷∶甲醇=30∶1的情况下对ST-Ⅱ进行分离得到9个组分(见图2A)。MTT比色法对HepG2细胞的细胞毒性检测结果表明,在加样浓度为50 μg/mL、作用时间为48 h时,第二组样品的细胞毒性较为明显(见图2B),并将其命名为ST-Ⅱ-Ⅱ。对小鼠成纤维细胞L929的MTT比色法实验结果表明,ST-Ⅱ-Ⅱ对其无明显细胞毒性(见图2C)。同时本文作者选择发病率和死亡率较高的癌症细胞系-人宫颈癌细胞系HeLa细胞、人纤维肉瘤细胞系HT1080细胞、人乳腺癌细胞系MCF-7细胞和人肝癌细胞系HepG2细胞,来检测ST-Ⅱ-Ⅱ对它们的细胞毒性,结果表明,100 μg/mL浓度下,ST-Ⅱ-Ⅱ对HeLa细胞、MCF-7细胞和HepG2细胞均显示出细胞毒性,其中HepG2细胞对ST-Ⅱ-Ⅱ最为敏感(见图2D)。后续实验均利用HepG2细胞进行实验。 (A. PLC分离ST-Ⅱ得到1~9组组分;B. PLC分离ST-Ⅱ得到的9组组分(ST-Ⅱ-Ⅰ~ST-Ⅱ-Ⅸ)对HepG2细胞的增殖影响,实验组浓度均为50 μg/mL,对照组加入含有与实验组等量甲醇的培养液 ,0.001 确定ST-Ⅱ-Ⅱ对癌细胞具有毒性后,使用UPLC-MS/MS检测发现ST-Ⅱ-Ⅱ含有多种具有生物活性的天然产物。为了进一步确定ST-Ⅱ-Ⅱ中的有效活性化合物,使用制备液相对ST-Ⅱ-Ⅱ进行分离。结果表明,在甲醇∶水=7∶3的条件下,得到了9个组分(见图3A)。随后对这9组分进行了活性验证,在30 μg/mL的浓度下,第Ⅸ组分对HepG2细胞的毒性最强(见图3B),其他组分活性较弱或没有生物活性。在10 μg/mL浓度下,ST-Ⅱ-Ⅱ-Ⅸ和紫杉醇对癌细胞增殖抑制率处于同一水平。同时ST-Ⅱ-Ⅱ-Ⅸ对正常细胞L929无明显细胞毒性(见图3C)。以上结果表明ST-Ⅱ-Ⅱ-Ⅸ是ST-Ⅱ-Ⅱ中导致细胞毒性的主要组分。 (A. HPLC分离ST-Ⅱ-Ⅱ得到的9个组分;B. HPLC分离ST-Ⅱ-Ⅱ得到的9个组分的活性验证,实验组浓度均为30 μg/mL,对照组加入含有与实验组等量甲醇的培养液 ,p<0.001,0.01 以上结果表明海鞘根索被囊乙醇提取物的主要活性为组分为ST-Ⅱ-Ⅱ-Ⅸ,但实验中ST-Ⅱ-Ⅱ-Ⅸ制备得率极低。基于ST-Ⅱ-Ⅱ-Ⅸ是ST-Ⅱ-Ⅱ中的主要活性组分(见图3B),本研究后续利用ST-Ⅱ-Ⅱ进行作用机制实验。 为了研究ST-Ⅱ-Ⅱ对HepG2增殖抑制作用机制,本研究中使用Annexin V-FITC/PI染色,DAPI细胞核染色以及细胞凋亡抑制剂Nicotiflorin确认添加ST-Ⅱ-Ⅱ是否导致HepG2细胞凋亡。Annexin V-FITC/PI染色结果说明,在浓度为70 μg/mL时,作用24 h后,凋亡细胞的比例较对照组有明显提高(见图5A)。DAPI细胞核染色实验组细胞核有了较明显的形态变化。与对照组相比,实验组细胞核呈现不规则形状,有核裂解情况发生(见图5B)。细胞凋亡抑制剂Nicotiflorin与ST-Ⅱ-Ⅱ共同作用后,凋亡细胞比例显著减少(见图5C)。以上结果说明添加ST-Ⅱ-Ⅱ后引起HepG2细胞显著凋亡。 (A.ST-Ⅱ-Ⅱ-Ⅸ的核磁氢谱(1H NMR);B. ST-Ⅱ-Ⅱ-Ⅸ的1H-1H COSY谱。 A. 1H NMR of ST-Ⅱ-Ⅱ-Ⅸ; B.1H-1H COSY spectrum of ST-Ⅱ-Ⅱ-Ⅸ.) 图4 ST-Ⅱ-Ⅱ-Ⅸ的结构鉴定 为了进一步研究ST-Ⅱ-Ⅱ引起HepG2细胞凋亡的作用机制,本文作者进行了线粒体膜电位、细胞ROS以及线粒体凋亡途径相关蛋白表达情况的检测。在ST-Ⅱ-Ⅱ作用浓度为70 μg/mL,作用时间24 h后,HepG2细胞的ROS水平显著升高(见图6A),线粒体膜电位显著降低(见图6B)。ST-Ⅱ-Ⅱ处理后,HepG2细胞中促细胞凋亡蛋白p53和Bax表达水平显著升高,而抑制细胞凋亡蛋白Bcl-2表达量显著降低(见图6C)。以上结果表明,海鞘根索被囊乙醇提取物通过线粒体凋亡通路引起HepG2细胞凋亡。 (①ST-Ⅱ-Ⅱ+Nicotiflorin. A. AV/PI染色检测ST-Ⅱ-Ⅱ作用后早期凋亡细胞的比例,实验组浓度为70 μg/mL,对照组加入含有与实验组等量甲醇的培养液 ,0.001 (A. ST-Ⅱ-Ⅱ作用后HepG2细胞相关ROS水平,实验组浓度为70 μg/mL,对照组加入含有与实验组等量甲醇的培养液 ,倒置荧光显微镜拍摄及相关数据统计,0.001 本研究通过硅胶柱层析、PLC和HPLC等方法从真海鞘根索及被囊中分离得到具有抑制肿瘤细胞增殖的天然活性组分。采用制备液相分离ST-Ⅱ-Ⅱ后得到高效抑制HepG2细胞增殖的ST-Ⅱ-Ⅱ-Ⅸ组分。由于样品制备得率极低,无法制备足够量的ST-Ⅱ-Ⅱ-Ⅸ,不能对其进行完整核磁图谱检测,只检测了氢谱和1H-1H COSY谱,结合质谱数据分析,推测ST-Ⅱ-Ⅱ-Ⅸ为硬脂酸与二取代苯环酯化后形成的一类结构新颖的化合物。此构效关系与姜酚类活性产物类似。姜酚类活性产物具有抗肿瘤功效,并且其苯环所带碳链越长,抗肿瘤作用越显著[23]。另外也有多不饱和脂肪酸能够引起人源癌细胞铁死亡的报道[24]。通过本研究推测的结构同样为二取代苯环加长碳链结构。所以在此结构或结构类似物的基础上,可能存在着高效的抗肿瘤天然活性产物。 ST-Ⅱ-Ⅱ-Ⅸ无法制备得到更多样品,但ST-Ⅱ-Ⅱ-Ⅸ组分占ST-Ⅱ-Ⅱ的40%左右(见图3A),且ST-Ⅱ-Ⅱ的抗肿瘤活性集中在ST-Ⅱ-Ⅱ-Ⅸ组分,所以本研究中用ST-Ⅱ-Ⅱ进行作用机制的分析。结果发现ST-Ⅱ-Ⅱ抑制人肝癌细胞(HepG2)增殖的机制是诱导细胞凋亡。细胞凋亡也称为细胞程序性死亡,是细胞通过死亡来减少细胞增殖或对细胞DNA损伤做出反应的一种机制[25]。细胞凋亡主要通过两种途径(线粒体信号通路和死亡受体信号通路)来实现,而在线粒体信号通路控制的细胞凋亡中,Bcl-2蛋白家族起了非常关键的作用[26]。本文作者进一步研究发现ST-Ⅱ-Ⅱ能够促使HepG2细胞活性氧水平升高,线粒体膜电位降低,线粒体凋亡通路中的抗凋亡蛋白Bcl-2的表达量降低,促凋亡蛋白Bax、p53蛋白的表达量升高,所以证实ST-Ⅱ-Ⅱ通过线粒体凋亡通路诱导HepG2细胞的凋亡。线粒体是细胞的能量中心,是有氧呼吸的主要场所[27]。多种疾病都与线粒体有关,如帕金森病[28],糖尿病等[29]。此外,线粒体参与凋亡调控、细胞信号转导等,被认为是治疗癌症的一个重要靶点[30]。因此,ST-Ⅱ-Ⅱ通过线粒体通路诱导癌细胞凋亡,表明ST-Ⅱ-Ⅱ具有较强的抗肿瘤活性,本研究中的发现为该化合物在癌症治疗中的进一步研究提供理论依据。 到目前为止,越来越多来源于海鞘的天然产物被发现,其中的功能也各有异同。一些天然产物来源于海鞘本身,另一些来自海鞘的共生微生物。生物碱类物质是在海鞘及其共生微生物中发现的最多的天然化合物种类[7]。来源于海鞘(Aplidiummeridianum)本身的生物碱类化合物Meridianins[31]是多种蛋白激酶的抑制剂。已经应用于临床的生物碱类化合物ET-743来源于海鞘的共生微生物Ca.E. frumentensis[32]。关于ST-Ⅱ-Ⅱ-Ⅸ是来源于真海鞘自身还是来源于其共生微生物这个问题目前还不清楚,后续工作将会提高ST-Ⅱ-Ⅱ-Ⅸ制备得率,来确定其结构及来源。真海鞘根索及被囊中天然活性产物的报道极少,本研究结果表明,真海鞘根索及被囊中含有高效的抗肿瘤天然活性产物,具有广阔的开发应用前景。 致谢:感谢中国科学院上海药物研究所谭昌恒老师对核磁图谱以及化合物解析方面的指导。感谢中国海洋大学医药学院王长云老师,邵长伦老师给予的实验上的指导以及实验仪器上的帮助。感谢中国海洋大学食品学院徐杰老师给予的实验仪器上的帮助。2.2 ST-Ⅱ的分离与活性验证

2.3 ST-Ⅱ-Ⅱ的分离与活性验证

2.4 ST-Ⅱ-Ⅱ-Ⅸ的结构鉴定

2.5 ST-Ⅱ-Ⅱ诱导HepG2细胞凋亡
2.6 ST-Ⅱ-Ⅱ通过线粒体凋亡途径引起HepG2细胞凋亡


3 讨论
