脱管散对大鼠压力性损伤创面愈合及创面组织中TNF-α、IL-6表达的影响
2023-05-21张乐乐宋旭林
战 青,张乐乐,王 波,宋旭林,车 莹
(甘肃中医药大学 护理学院,甘肃 兰州 730000)
对于压力性损伤(Pressure Injuries,PI)起源于拉丁语“decub”翻译的褥疮[1]及1873年James Pager[2]提出褥疮定义;20世纪70年代提出“压力性溃疡”;2007年美国压疮咨询委员会(National Pressure Ulcer Advisory Panel,NPUAP)提出压力性损伤定义[3];2009年、2014年欧洲压疮咨询委员会(European Pressure Ulcer Advisory Panel,EPUAP)与NPUAP联合发布第1版和第2版《国际性压疮防治指南》[4-5];2016年NPUAP正式将“压疮”更名为“压力性损伤”[6];至2019版《压疮/压力性损伤预防和治疗临床实践指南》[7],由于压力性损伤患病率高,学术界从多学科、多层面对其进行研究与探索。最新研究显示,美国每年有300万成年人受该病困扰,住院患者中压力性损伤总体患病率为5%~15%,重症监护室和长期护理机构中患病率可能更高[8];我国一项多中心研究显示:12家医院的压力性损伤患病率为1.58%,发病率为0.63%[9]。此外,压力性损伤治疗护理费用高,NPUAP估算每年仅用于压力性损伤的治疗费用高达110亿美元,人均约3.8万美元[10-11]。依据我国第七次人口普查数据,65岁及以上人口占比为13.50%[12];近15年人口调查数据显示,我国65岁及以上老龄人口规模及比重正步入快速增长阶段。老龄化的同时压力性损伤发病率势必增加,由此对人类健康和经济造成的负担不可小觑,急需寻求安全、有效、经济的压力性损伤防治方法。
脱管散是甘肃中医药大学附属医院院内制剂,是在“去腐生肌”“煨脓长肉”理论指导下,运用传统经验法,由轻粉、宫粉、麝香、枯矾、冰片5 味中药配制而成,符合《中华人民共和国药典》2020版散剂项各项规定,规格为每瓶1g,甘药制字:Z04010880[13],在外科、骨科20多年疮疡破损、溃疡、乳痈、臁疮等较顽固疾病临床应用中效果显著[14]。在完成脱管散安全性与毒理分析前提下,以慢性难治性创面临床观察性研究和以急性创面为主的实验研究已开展,但针对压力性损伤作用机制的理论研究较为匮乏。本课题在前期研究基础之上,通过动物实验探讨脱管散对大鼠压力性损伤创面愈合及创面组织中TNF-α、IL-6表达的影响。
1 材料与方法
1.1 实验动物
SPF级Wistar大鼠180只,雌雄对半,日龄70天左右,体质量180~250g,由甘肃中医药大学SPF级实验动物中心提供,实验动物生产许可证:SCXK(甘)2020-0001,实验动物使用许可证:SYXK(甘)2020-0009。研究方案经甘肃中医药大学实验动物伦理委员会审核通过,实验过程中所有处置均符合2009版《EthicalIssuesAnimalExperimentation》中动物伦理学标准的有关条例。正式实验开始前适应性饲养1周。
1.2 主要试剂与仪器
白凡士林(河南华凯生物科技有限公司);湿润烧伤膏(汕头市美宝制药有限公司);脱管散(甘肃中医药大学附属医院药剂科)。磁铁:N35钕磁铁,直径(12±0.05)mm,厚(5±0.05)mm,质量2~4g,磁通量3 000高斯。TNF-α:一抗名称为TNF-α(货号:GB11188),一抗稀释比1∶200;对应二抗名称为CY3山羊抗兔(货号:GB21303),一抗稀释比1∶300。IL-6:一抗名称为IL-6(货号:GB11117),一抗稀释比1∶200;对应二抗名称为CY3山羊抗(货号:GB21303),一抗稀释比1∶300。抗体厂家:Servicebio。组化笔(Servicebio,型号:G6100);正置荧光显微镜(日本尼康,型号:Nikon Eclipse C1);成像系统(日本尼康,型号:Nikon DS-U3)。
1.3 分组与造模
使用随机数字表从180只大鼠中分出30只为空白对照组,其余150只造模后再分组。借鉴Stadler I等[15]体外压迫性I/R损伤造模方法,Peirce SM持续压迫缺血2h、放松再灌注0.5h的时间分配方法[16],结合谢浩煌团队深部压力性损伤造模方法[17]进行综合、改良,建造I/R损伤大鼠压力性损伤模型。造模前12h禁食。具体操作步骤如下。
1.3.1 麻醉、备皮 根据大鼠体质量按照0.3mL/100g使用10%水合氯醛腹腔注射麻醉,剃除大鼠背部脊柱两侧50mm×40mm范围内毛发并脱毛,温水擦净,0.5%碘伏消毒待干。空白对照组在相同造模部位备皮后不予造模。
1.3.2 放置磁铁 以大鼠背部正中线为纵轴,大鼠前腿到后腿距离中线为横轴,距离中线5mm在横轴上标出2块磁铁吸附位置。纵行提起备皮区域皮肤,将2片灭菌后直径12mm、厚5mm、质量2.4g、磁通量3 000高斯的圆形磁铁对称吸附于皮褶两侧产生40kPa压力,压迫局部造成缺血,2块磁铁之间间隔10mm皮肤桥,放回笼内自由活动,记录当日第一循环缺血开始时间。压迫磁铁后为防止相互吸引所有模型大鼠单笼饲养。
1.3.3 移除磁铁 压迫2h后依次移除磁铁,放回笼内自由活动0.5h,记录当日第一循环再灌注开始时间,此为一个完整循环,即缺血2h,再灌注0.5h。每日循环4次。夜间持续压迫12h至次日晨。连续压迫4d。
1.3.4 造模成功标准 随机选取2只造模后大鼠取创面组织行HE染色病理学检测。镜下见表皮、真皮以及皮下组织有不同程度损伤,表皮层以及真皮层有大量炎性细胞浸润,皮肤附属器消失,创面组织严重水肿、组织疏松,存在纤维变性及坏死。同时参照2016版《压力性损伤分类系统》[6],3、4期表现综合判断造模成功。将150只模型大鼠随机分为模型组、湿润烧伤膏组、脱管散低剂量组、脱管散中剂量组、脱管散高剂量组共5组,每组30只。
1.4 处理措施
第4天夜间持续性压迫之后开始给予各组相应处理措施。各组均按照无菌生理盐水清洁创面或备皮区域→0.5%碘伏消毒创周、待干→用药→包扎的流程处理。空白组备皮区域涂凡士林0.5g,模型组不进行药物干预,湿润烧伤膏组涂湿润烧伤膏0.5g,脱管散低、中、高剂量组分别涂撒脱管散0.1g、0.2g、0.4g(以脱管散洒满创面剂量即0.2g为中剂量组给药剂量,将0.2g减半即0.1g为低剂量组剂量,将0.2g翻倍即0.4g为高剂量组剂量)。6组创面及备皮区域均覆盖2层凡士林纱布、2层无菌纱布块,外用自制装置固定敷料,1次/d按时换药。
1.5 各组创面愈合率观察
使用分辨率2 376×1 080像素,摄像头4 800万像素+AF自动对焦的同一智能手机,镜面与创面保持平行、间距15cm,相同焦距并在创面边缘放已消毒刻度尺,拍摄大鼠用药后第3天、7天、14天创面图片。使用Image J图像处理软件测量创面面积,将测量数据导入Excel中,利用公式:创面愈合率(%)=(造模成功后创面面积-取材时创面面积)/造模成功后创面面积×100%,计算创面愈合率。为符合动物实验设计盲法原则,对使用Image J软件测量、记录创面面积和计算创面愈合率(%)人员使用盲法。
1.6 各组创面组织TNF-α、IL-6表达的检测
分别于用药后第3天、7天、14天,各组随机取10只大鼠麻醉后取下创面组织一侧分为2部分,一部分使用4%多聚甲醛固定液固定,行HE染色、组织病理切片行组织病理学检测,观察组织坏死、炎性细胞浸润、纤维细胞和毛细血管生长情况;另一部分采用免疫荧光技术(Immuno fluorescence,IF)检测创面组织中TNF-α和IL-6表达水平,使用CaseViewer 2.4软件打开光学显微镜下拍摄的不同时间点各组创面组织图片,在400放大倍数下,采集不重叠视野、相同大小图片,使用Image-Pro Plus图像分析软件对不同时间点各组创面组织所选视野下TNF-α、IL-6表达情况进行图像分析,采用半定量方法计算出该视野下的平均光密度值(Average optical density,AOD)以估计TNF-α、IL-6的表达情况。将测量得出不同时间点各组创面组织中TNF-α、IL-6的荧光强度(Integral optical density,IOD)及像素点数量(面积,Area)导入Excel中利用公式计算:平均光密度值(AOD)=荧光强度(IOD)/像素点数量(Area)。为符合动物实验设计盲法原则,对使用CaseViewer 2.4软件采图、Image-Pro Plus软件测量和Excel计算平均光密度值的人员使用盲法。
1.7 统计学处理
2 结果
2.1 各组创面愈合率观察结果
用药后第3天、7天、14天,湿润烧伤膏组和脱管散各组创面愈合率均高于模型组差异有统计学意义(P<0.05)。除用药后第3天脱管散中剂量组无显著优势(P>0.05)外,在用药后第3天、7天、14天脱管散低剂量组与湿润烧伤膏组均可有效促进创面愈合且无显著差异(P>0.05);脱管散低剂量组优于脱管散中、高剂量组(P<0.05)。说明在不同时间点,低剂量脱管散与湿润烧伤膏均具有促进创面愈合,缩小创面面积,提高创面愈合率优势,见表1、图1。
表1 不同时间点各组创面愈合率
2.2 各组创面组织TNF-α、IL-6表达检测结果
2.2.1 各组创面组织TNF-α表达检测结果 除空白组外,其余各组TNF-α表达量在用药后第3天、7天、14天均呈现先升高、后下降的“单峰”趋势,高峰出现在用药后第7天。模型组3个时间节点均高于其他各组差异有统计学意义(P<0.05);湿润烧伤膏组3个时间节点均低于脱管散各组差异有统计学意义(P<0.05),其中用药后第3天与脱管散低剂量组效果相当(P>0.05);脱管散各组3个时间节点抑制炎症效果显示,低剂量组优于中、高剂量组差异有统计学意义(P<0.05),见表2,图2-图4。
表2 不同时间点各组创面组织TNF-α表达量
2.2.2 各组创面组织IL-6表达检测结果 除空白组外,其余各组IL-6表达量在用药后第3天、7天、14天亦呈现先升高、后下降的“单峰”趋势,高峰出现在用药后第7天。模型组3个时间节点均高于其他各组差异有统计学意义(P<0.05);湿润烧伤膏组3个时间节点均低于脱管散各组差异有统计学意义(P<0.05),其中在用药后第3天、14天湿润烧伤膏组低于空白组;脱管散各组3个时间节点抑制炎症效果显示,低剂量组优于中、高剂量组;用药后第14天脱管散低剂量组明显下降,相比于中、高剂量组与湿润烧伤膏组更加接近,见表3,图5-图7。
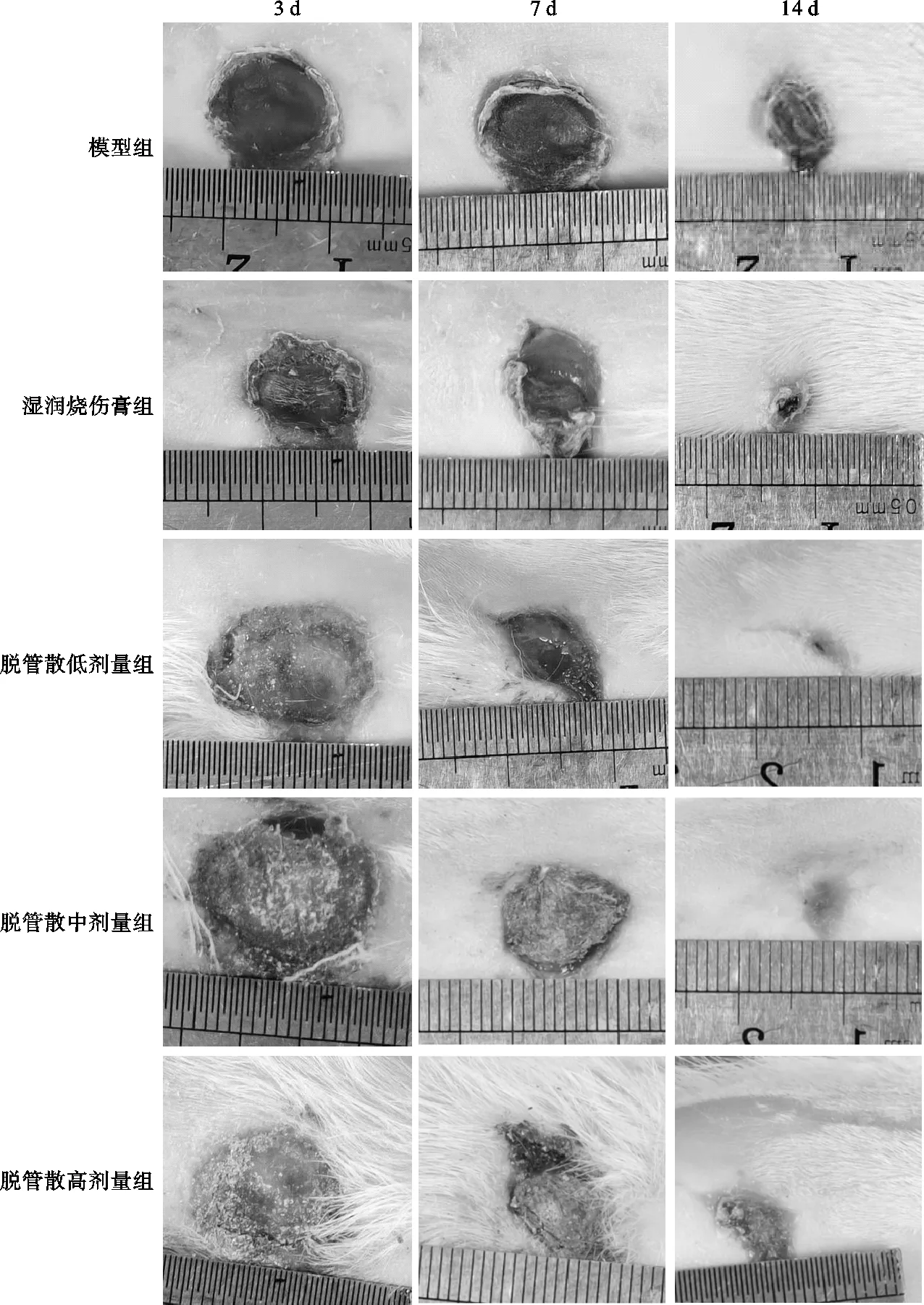
图1 不同时间各组大鼠用药后创面大体情况观察
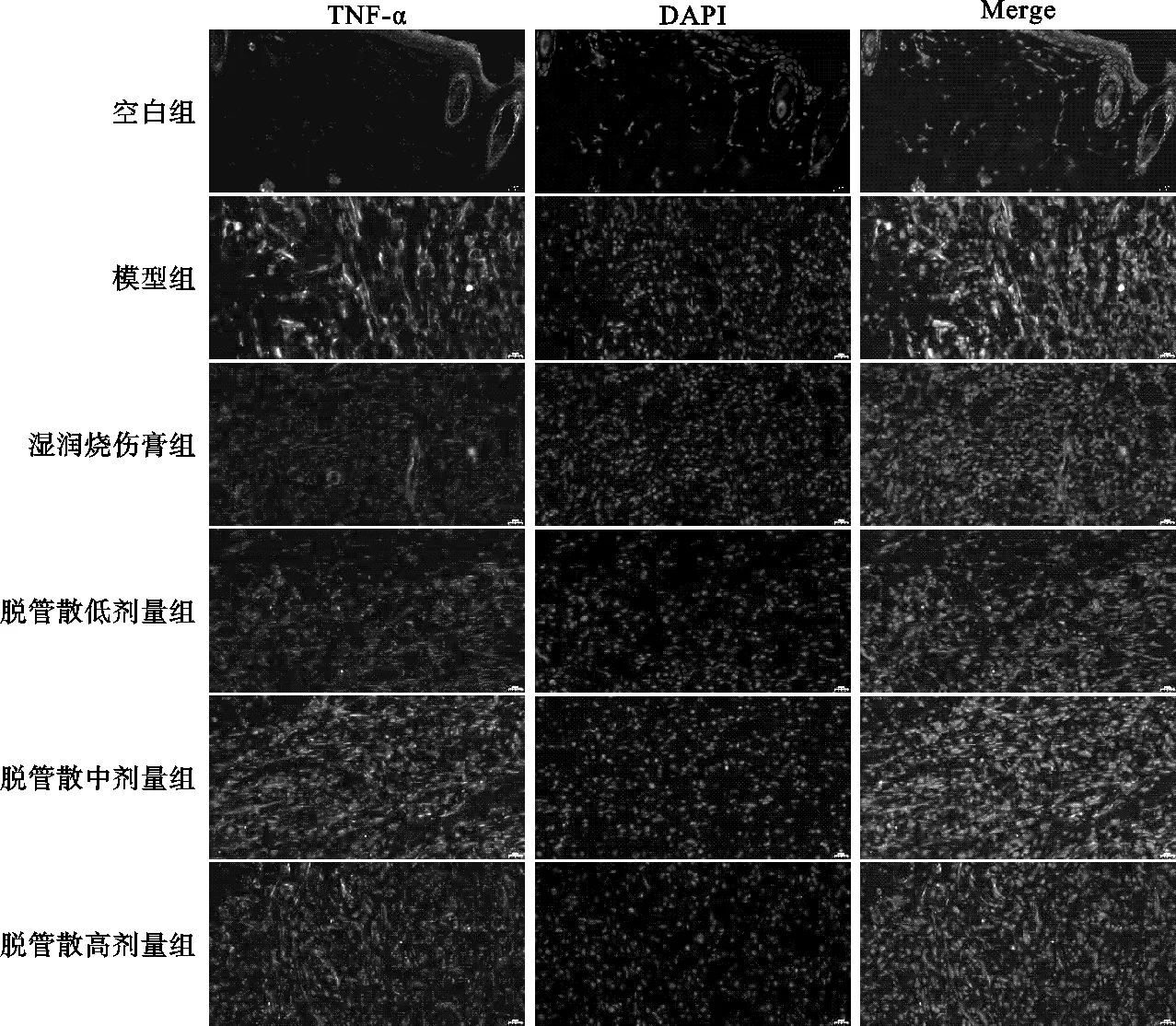
图2 IF检测用药后第3天各组创面组织TNF-α的表达(×400)
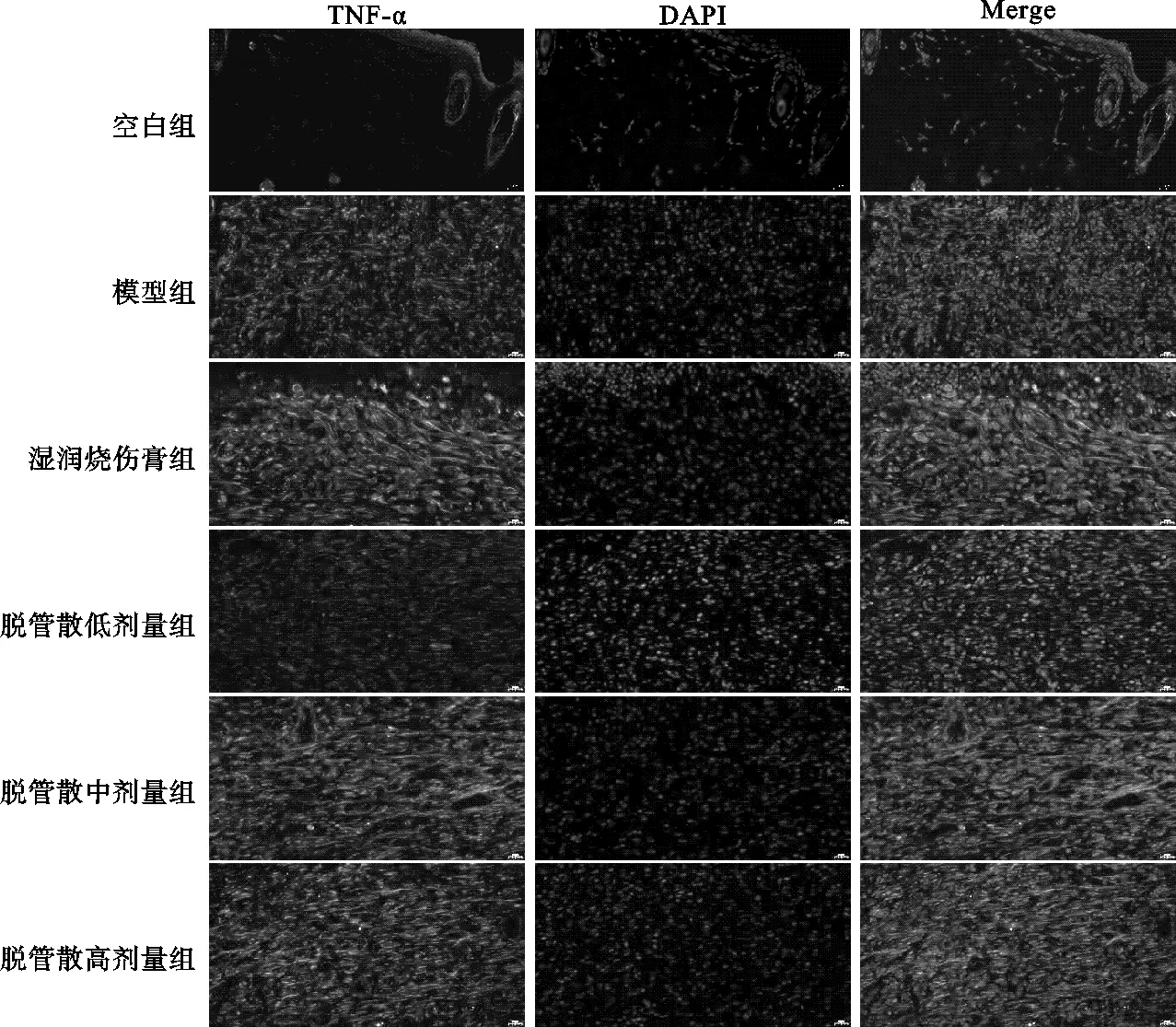
图3 IF检测用药后第7天各组创面组织TNF-α的表达(×400)
表3 不同时间点各组创面组织IL-6表达量
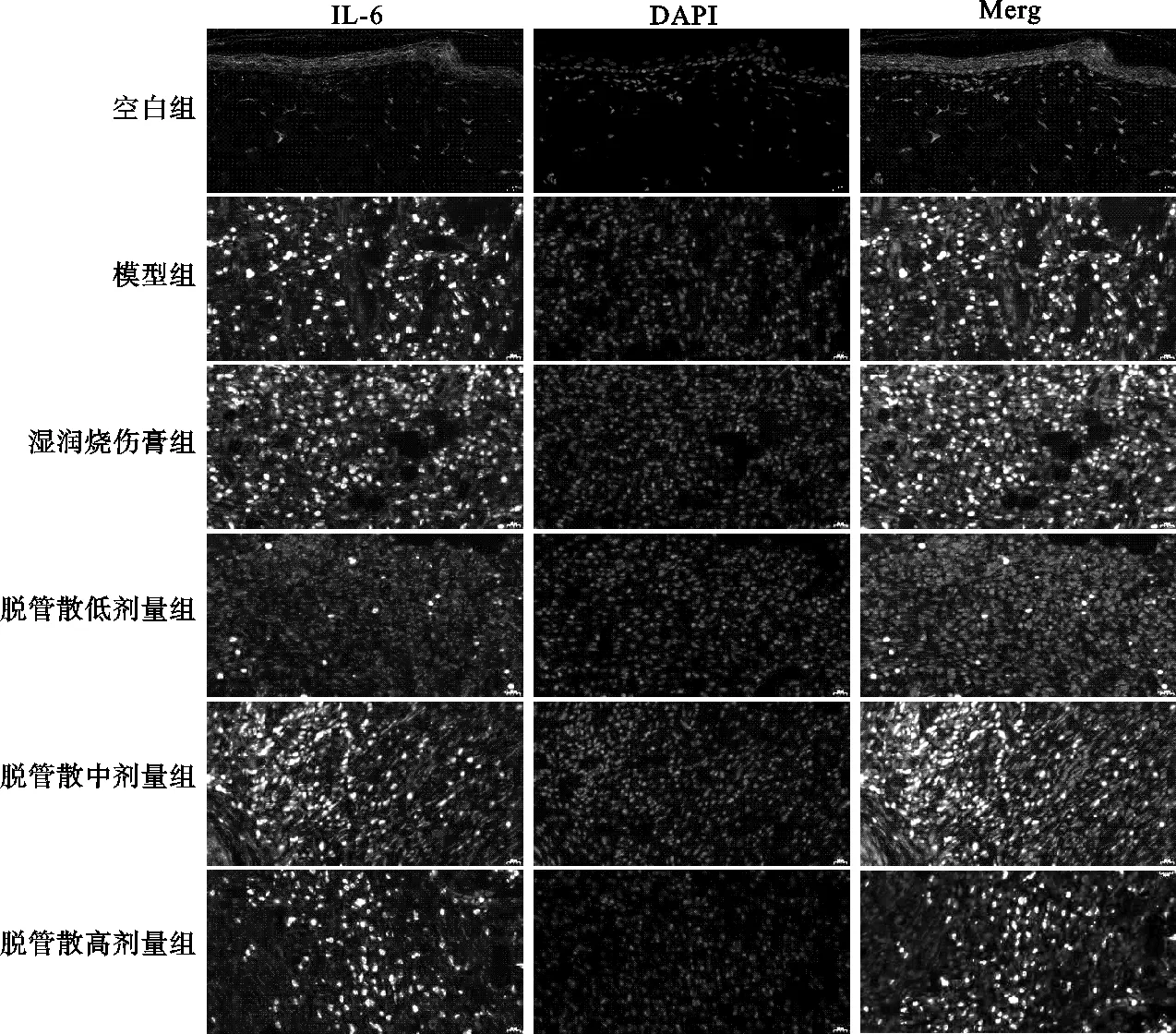
图6 IF检测给药后第7天各组创面组织IL-6的表达(×400)
3 讨论
压力性损伤是局部皮肤及软组织长期受压引起缺血缺氧、代谢障碍导致变性坏死的病理生理过程,其病理机制研究涉及领域较广,被广泛认可的有微循环障碍、细胞机械变形和I/R损伤三大学说。I/R损伤是引起慢性深部组织损伤的病理机制之一[16],主要与氧化应激、细胞凋亡和炎症反应相关,其中氧化应激是核心因素。依据I/R损伤机制建造大鼠压力性损伤模型,缺血时大量氧自由基蓄积,再灌注时蓄积氧自由基倾泻而出,激活中性粒细胞、巨噬细胞等炎性细胞,产生大量炎性介质,使炎性细胞附着于血管壁,止血同时激活血小板分泌血小板源性生长因子(PDGF)、转化生长因子(TGF-β)、表皮生长因子(EGF)等生长因子[18],以招募循环血液中炎性细胞介导炎症反应并向创面趋化,促进角质形成细胞活化与迁移,还可分泌TNF-α吞噬病原微生物、清除创面坏死组织、产生促炎细胞因子[19]。因此,TNF-α被认为是I/R之后炎症反应的关键性始动因子[20]。IL-6是一种多生物学活性细胞因子,除巨噬细胞外,内皮细胞、T细胞、成纤维细胞等也可产生。TNF-α和IL-6与炎症反应密切相关,它们相互诱导共同参与了创面愈合全程[21]。对于创面愈合,炎症反应是一把双刃剑,正常炎症反应有利于启动局部和全身免疫系统,维持创面局部微生物水平与健康组织之间平衡[22],利于角质形成细胞增殖、分化与迁移,受压部位血液循环重建,促进创面愈合;但过度和延长的炎症反应会影响创面正常愈合,导致病理性瘢痕形成。已有研究证明[23-25],TNF-α与IL-6过度表达与创面迁延不愈密切相关。
本研究显示,对各组创面大体观察结果表明,湿润烧伤膏组和脱管散各组均可促进压力性损伤创面愈合,其中脱管散低剂量组与湿润烧伤膏组在促进创面愈合方面效果相当。脱管散中、高剂量组劣于低剂量组,推测与脱管散的君药轻粉相关。轻粉主要化学成分氯化亚汞(Hg2Cl2)经现代药理研究证明[27]:毒性较低,仅能外用且需严格掌握适应证和剂量。姚昶等[26]研究表明,微量汞能激活免疫细胞活性,促进干扰素及炎性因子如白细胞介素等的产生,具有促进创面愈合之效。王斌[27]研究表明,在一定剂量范围和观察时间内脱管散对大鼠无严重毒性及皮肤刺激反应。王顺义等[28]研究表明,过量轻粉会因刺激黏膜和蓄积作用引发毒性反应。
另外,除空白组外,在创面连续用药第3天、7天、14天,各组创面组织TNF-α与IL-6表达均呈现先升高、后下降的“单峰”趋势,高峰出现在用药后第7天,推测脱管散在炎症早期发挥“煨脓”功效,促进创面微生物及失活组织坏死,而外用脱管散和坏死组织作为抗原再次刺激创面放大炎症反应,因而在炎症晚期到增殖期伴随坏死物质增多出现炎性因子表达高峰;在增殖期和重塑期发挥“长肉”功效,降低炎症因子表达、抑制炎症反应,因而在增殖期之后出现炎性因子表达降低的趋势。表明伴随创面愈合进展,脱管散对与I/R损伤密切相关的TNF-α与IL-6的表达具有双向调节作用,即在创面愈合早期上调TNF-α与IL-6表达以启动免疫反应、吞噬微生物及坏死组织为创面愈合营造良好微环境;创面愈合后期下调TNF-α与IL-6表达,促进创面由炎症期向增殖期过渡,对促进压力性损伤创面愈合具有一定优势。
综上所述,脱管散可以在创面愈合不同时期,通过双向调节TNF-α与IL-6表达,调控创面炎症反应,促进炎症期向增殖期的顺利过渡,避免创面迁延不愈。但本研究仅探索脱管散对创面愈合率和与I/R损伤密切相关的炎症因子TNF-α和IL-6调控的影响,尚未从分子生物学角度探索脱管散促进创面愈合的分子机制,有待下一步深入探索。
