猪繁殖与呼吸综合征病毒感染Marc-145 细胞的长链非编码RNA 和mRNA 转录组分析
2023-05-20张小霞杨艳青王秋云杜俊阳曹瀚文梁振普
张小霞,杨艳青,王秋云,杜俊阳,曹瀚文,梁振普
(河南农业大学生命科学学院,河南 郑州 450002)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种母猪妊娠流产和仔猪呼吸困难的传染性免疫抑制疾病[1],对全球养猪业造成了巨大的经济损失[2⁃3]。PRRSV 是单股正链RNA 病毒,基因组全长约15 kb,属动脉炎病毒科动脉炎病毒属的成员[4]。PRRSV 具有严格的细胞嗜性,能在猪肺泡巨噬细胞(PAM)、非洲绿猴胚胎肾上皮细胞(Marc-145)等细胞中增殖[5]。Marc-145细胞常被用于研究PRRSV 的感染机制及相关分子操控模式[6]。由于PRRSV具有突变率高、免疫抑制、持续感染且垂直传播、抗体依赖性增强作用以及中和抗体产生延迟等特征,目前尚无有效疫苗预防[7⁃9]。因此,亟待研发有效的治疗产品。
长链非编码RNA(Long non⁃coding RNA,lncRNA)是一类长度大于200 个核苷酸的非编码RNA,可能参与癌症等人类疾病的发生[10],也可能参与宿主抗病毒反应的过程[11]。病毒入侵会引起自身或宿主产生lncRNA参与天然免疫应答[12],从而调节宿主与病毒的相互作用。如lincRNA-Tnfaip3 充当NF-κB 共调节因子调节巨噬细胞炎性基因的表达[13];lncRNA 肺腺癌转移相关转录本1(Malat1)抑制细胞核中DNA 结合蛋白(TDP43)的降解,从而抑制核干扰素调节因子3(IRF3)启动的抗病毒天然免疫[14]。
ZHANG 等[15]通过转录组测序技术(RNA-seq)对PRRSV 毒株GSWW/2015 和VR2332 感染24 h 的PAM 进行分析,发现lnc_000397 通过诱导干扰素刺激基因(ISG)的表达负调控PRRSV 复制。PRRSV抗原在感染Marc-145 细胞10~20 h 内可检测到,并在感染后3~4 d 出现细胞病变[16⁃17]。然而,关于lncRNA 在PRRSV 感染初期过程中的具体调控机制还有待研究。为探究PRRSV 感染Marc-145 细胞初期的lncRNA 和mRNA 的表达情况,对PRRSV 感染12 h的Marc-145细胞进行转录组测序,分析PRRSV感染后宿主细胞lncRNA 和mRNA 的表达谱变化及其二者的关联情况,筛选出PRRSV感染中潜在的候选lncRNA 和靶基因,以期为PRRS 的防治提供新的研究思路及药物靶点。
1 材料和方法
1.1 主要试验材料
Marc-145和PRRSV 经典毒株BJ-4均由河南省农业科学院动物免疫学重点实验室提供。胎牛血清(FBS)、0.25%-EDTA 胰酶、DMEM 培养基均购自北京索莱宝科技有限公司;24 孔板、一次性培养瓶购自Thermo Fisher 公司;TRIzol、SuperScript ⅡReverse Transcriptase 试剂购自Invitrogen 公司;TruSeq Stranded mRNA LTSample Prep Kit 试剂购自Illumina 公司;Agencourt AMPure XP 试剂购自Beckman Coulter 公司;Qubit RNA Assay Kit 和Qubit dsDNA Assay Kit 购自Life Technologies 公司;Bioanalyzer 2100 RNA-6000 Nano Kit 和Bioanalyzer 2100 DNA-1000 Kit购自Aglient公司。
1.2 样品制备
将Marc-145 细胞用含10%胎牛血清(FBS)的DMEM 培养基培养,置于37 ℃、5%CO2培养箱中,分为2 组,一组为未接种PRRSV 的MARC-145 细胞的对照组,另一组为PRRSV 经典毒株BJ-4 感染12 h的试验组(MOI=1)。每组3 个重复,用于转录组测序。
1.3 总RNA的提取和质量检测
利用TRIzol 试剂提取总RNA,用1%琼脂糖凝胶检测RNA 降解和污染情况。分别用Nanodrop、Qubit 和Agilent 2100 检测总RNA 的纯度(OD260/280)、质量浓度和RNA 完整值(RNA integrity number,RIN)。
1.4 文库制备
样品检测合格后,以总RNA 为起始样品建立cDNA 文库。使用DNase 消化初始样品中的DNA后,用带有Oligo dT 的磁珠富集mRNA,加入打断试剂,将mRNA 打断成的短片段作为模板,用随机引物合成单链cDNA,然后配制双链合成反应体系合成双链cDNA,并使用试剂盒纯化双链cDNA;将纯化后的双链cDNA 进行末端修复、加A 尾、连接测序接头、片段大小选择,最后进行PCR 扩增得到cDNA文库。将构建好的文库用Agilent 2100 质检合格后,使用Illumina HiSeqTM2500测序仪进行测序。
1.5 raw reads质控、序列比对与转录本拼接
对测序得到的raw reads 进行质量评估,去除掉raw reads 中的少量带有测序接头、poly-N 以及测序质量较低的reads,并对测序错误率检查后得到后续分析使用的clean reads。用TopHat 2 软件对clean reads 进行参考基因组的比对分析,统计其可以mapping 到参考基因组的有效数据。使用HTSeq 软件对该物种每个样品进行已知类型基因的定量分析,根据表达量统计,得到样品中各类型基因的表达情况。利用TopHat 2 软件比对的结果进行转录本的拼接,可得到尽可能小的转录本集合,并对转录本定量分析。另外,还针对链特异性文库有特定的参数,可准确提供转录本链方向信息。
1.6 lncRNA和mRNA的筛选
lncRNA 是通过外显子筛选、转录本长度筛选、数据库已知转录本筛选、转录本表达量筛选、编码潜能预测等筛选得到,并将最终筛选到的lncRNA用于后续分析。
对lncRNA 的特征进行分析,将lncRNA 与mRNA 进行转录本长度、外显子(Exon)个数以及开放阅读框(ORF)长度对比,以此验证是否符合lncRNA的一般特征。
mRNA 是通过转录本外显子个数筛选、转录本长度筛选、转录本已知注释筛选以及编码潜能筛选等筛选得到,并将筛选出的mRNA用于后续分析。
1.7 差异表达lncRNA(DElncRNA)和差异表达RNA(DEG)的分析及DEG功能分析
使用Cuffdiff 软件将筛选到的lncRNA 和mRNA进行定量分析,得到各样本转录本的FPKM信息,以此估算基因表达水平。
基于lncRNA 和mRNA 的测序结果,以q-value<0.05 和|Fold change|>1.5 为显著性差异筛选条件进行差异表达分析。将显著差异的mRNA 进行GO 和KEGG 富集分析,GO 富集分析方法为GOseq,此方法 基 于 Wallenius non-central hyper-geometric distribution。
1.8 DElncRNA靶基因的预测及功能分析
将筛选到的显著差异表达的lncRNA 进行共表达预测mRNA,并将lncRNA 共表达mRNA 进行GO和KEGG富集分析。
1.9 DElncRNA靶基因和DEG的关联分析
在lncRNA共表达mRNA的KEGG富集分析中,以相关性排名前30通路中的mRNA 为筛选数据库,筛选出显著差异表达的mRNA,将其与关联的lncRNA 作为数据来源,使用Cytoscape 软件构建lncRNA和mRNA的互作网络。
2 结果与分析
2.1 RNA-seq测序样品的总RNA提取与质量检测
选取PRRSV 感染12 h 后的Marc-145 细胞为试验组(标记为M12_1、M12_2、M12_3),未经PRRSV感染的Marc-145 细胞为对照组(标记为M0_1、M0_2、M0_3)。提取6 组细胞的总RNA,利用Agilent 2100生物分析仪精准检测RIN评分,分别为9.9、9.5、9.7、10、9.8 和9.8。6 组样品RNA 的纯度、质量浓度和RIN 评分表明,提取的RNA 质量好,可用于后续试验。
2.2 PRRSV感染Marc-145细胞的转录组高通量测序和lncRNA鉴定
利用Illumina HiSeqTM2500平台对6组样品进行测序。从113 598 015.7 个raw reads 中获得106 397 660.7(93.66%)个clean reads。采用TopHat 2软件对clean reads进行参考基因组的比对分析。
使用Cuffdiff工具将拼接的转录本合并,得到本次测序完整的转录组信息,再将转录本集合进行lncRNA 的鉴定与筛选,经过5 个步骤的过滤,得到824 个已注释lncRNA 和419 个新lncRNA,所有lncRNA 具有相似的ORF 长度和外显子数量。与mRNA 相比,lncRNA 转录本较短,外显子数量较少,ORF较短,并且表达水平较低(图1)。
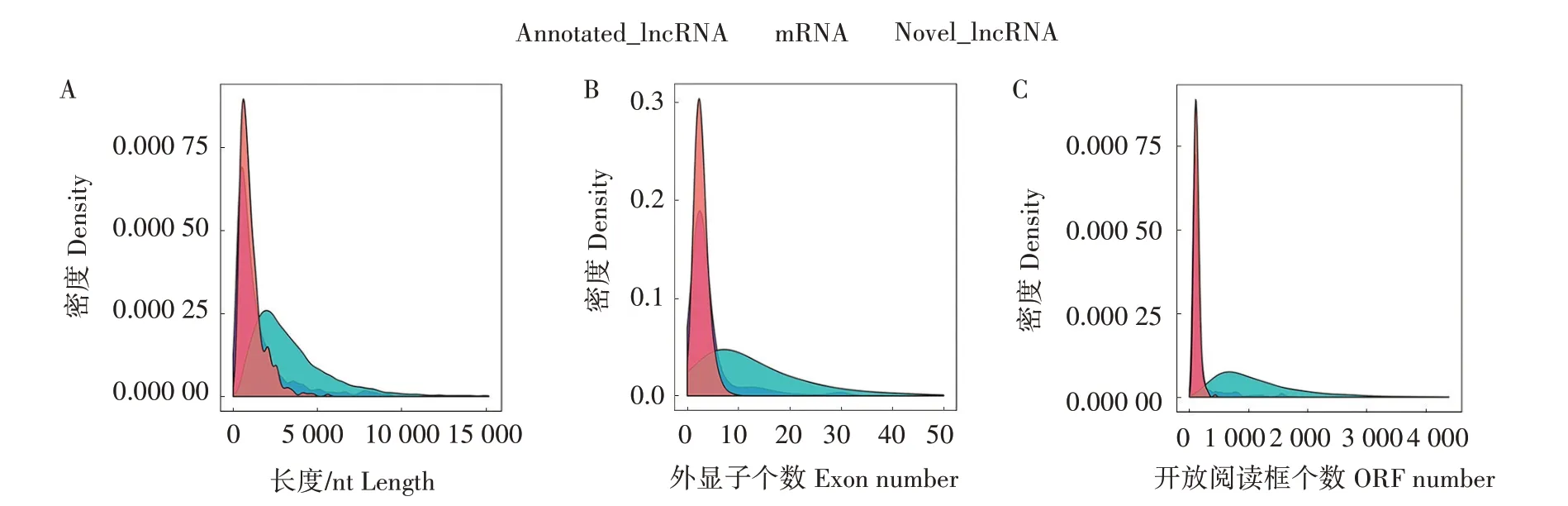
图1 lncRNA和mRNA的转录本分布(A)、外显子数量(B)和ORF长度(C)Fig.1 Transcript distribution(A),number of exons(B)and ORF length(C)of lncRNAs and mRNAs
2.3 基于RNA-seq的lncRNA差异表达分析和功能分析
以q-value<0.05 和|Fold change|>1.5 为显著性差异筛选条件对PRRSV感染组和对照组进行分析,结果显示,共有39 个差异lncRNA,其中19 个上调,20 个下调(图2A)。对差异表达的lncRNA 进行分层聚类分析,热图显示,与对照组中相比,PRRSV 感染组存在明显的自分离簇(图2B)。
为更好了解PRRSV 感染组与对照组中差异的lncRNA 的生物学功能,对lncRNA 共表达靶基因进行GO 和KEGG 富集分析。GO 分析结果显示,PRRSV 感染Marc-145 细胞中,与lncRNA 共表达的mRNA 在生物学过程(Biological process,BP)中主要与细胞代谢过程(Cellular metabolic process)和细胞含氮化合物代谢过程(Cellular nitrogen compound metabolic process)有关,在分子功能(Molecular function,MF)上主要与蛋白质结合(Protein binding)和细胞骨架蛋白结合(Cytoskeletal protein binding)有关(图2C)。
以q-value<0.05 为KEGG 富集分析条件,结果显示,PRRSV 感染组的lncRNA 共表达基因主要富集在MAPK 信号通路(MAPK signaling pathway)、胰岛素信号通路(Insulin signaling pathway)、碳代谢(Carbon metabolism)、HIF-1 信号通路(HIF⁃1 signaling pathway)和子宫内膜癌(Endometrial cancer)(图2D)。富集结果提示,PRRSV 可能通过lncRNA 调控靶基因的碳氮代谢或者MAPK 信号通路等营造宿主病毒的互作环境,这对深入解析lncRNA与PRRSV的关系有重要作用。
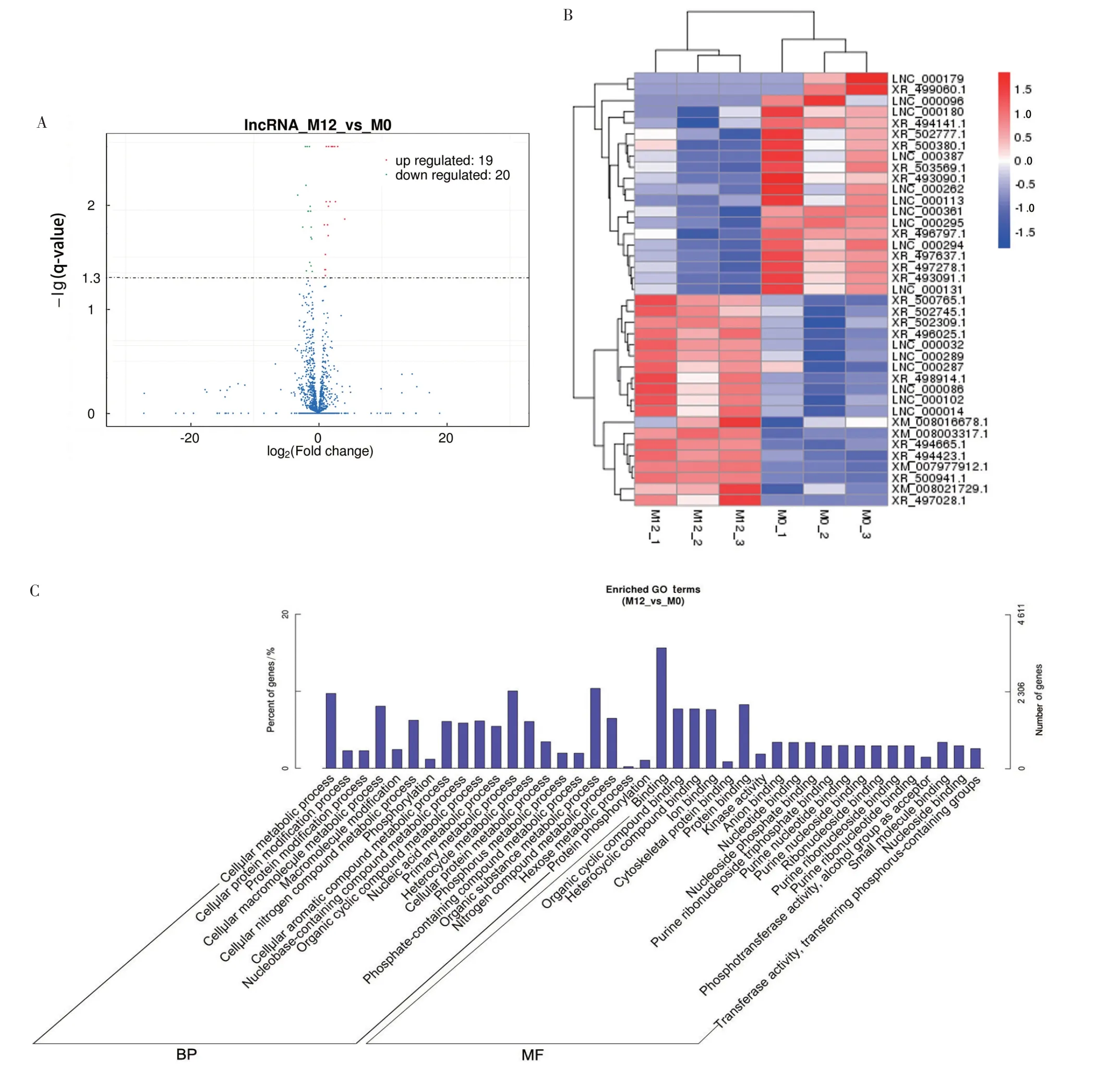

图2 基于RNA-seq的lncRNA的差异表达分析和lncRNA共表达mRNA的功能分析Fig.2 Differential expression analysis of lncRNAs and functional analysis of lncRNAs co-expressed mRNAs based on RNA-seq
2.4 基于RNA-seq的mRNA差异表达分析和功能分析
以q-value<0.05 与|Fold change|>1.5 为显著性差异筛选条件对PRRSV感染组和对照组进行分析,结果显示,共有1 320 个差异表达mRNA,其中552个上调,768 个下调(图3A)。对差异表达的mRNA进行聚类分析,结果显示,PRRSV 感染组与对照组中存在明显差异(图3B)。
为了更好地了解PRRSV 感染组与对照组之间差异表达mRNA 的生物学功能,对差异表达mRNA进行GO 和KEGG 富集分析。GO 富集分析结果显示,与对照组相比,PRRSV 感染组差异显著的mRNA 在分子功能上主要与氧化还原酶活性(Oxidoreductase activity)、醌或类似化合物受体(Quinone or similar compound as acceptor)有关;在细胞组分(Cellular component,CC)上主要与细胞内膜结合细胞器(Intracellular membrane⁃bounded organelle)和膜结合细胞器(Membrane⁃bounded organelle)有关;在生物学过程上主要与细胞对压力的反应(Cellular response to stress)、DNA 修复(DNA repair)、自噬(Autophagy)、对DNA 损伤刺激的反应(Response to DNA damage stimulus)、细胞含氮化合物代谢过程和有机环状化合物代谢过程(Organic cyclic compound metabolic process)有关(图3C)。
以q-value<0.05 为KEGG 富集分析条件,结果显示,与对照组相比,PRRSV 感染组差异显著的mRNA 主要富集在氧化磷酸化(Oxidative phosphorylation)、亨廷顿病(Huntington’s disease)、帕金森病(Parkinson’s disease)、非酒精性脂肪肝(Non⁃alcoholic fatty liver disease)、蛋白酶体(Proteasome)和碳代谢(图3D)。GO 富集结果提示,PRRSV 感染引起宿主细胞死亡与修复等应激反应;KEGG 富集结果提示,差异显著的基因与能量代谢通路和疾病信号通路有关,这些疾病的临床表征与PRRS 症状相似。因此,以能量代谢通路和疾病信号通路相关的基因为研究对象,有利于进一步研究PRRSV的致病机制。

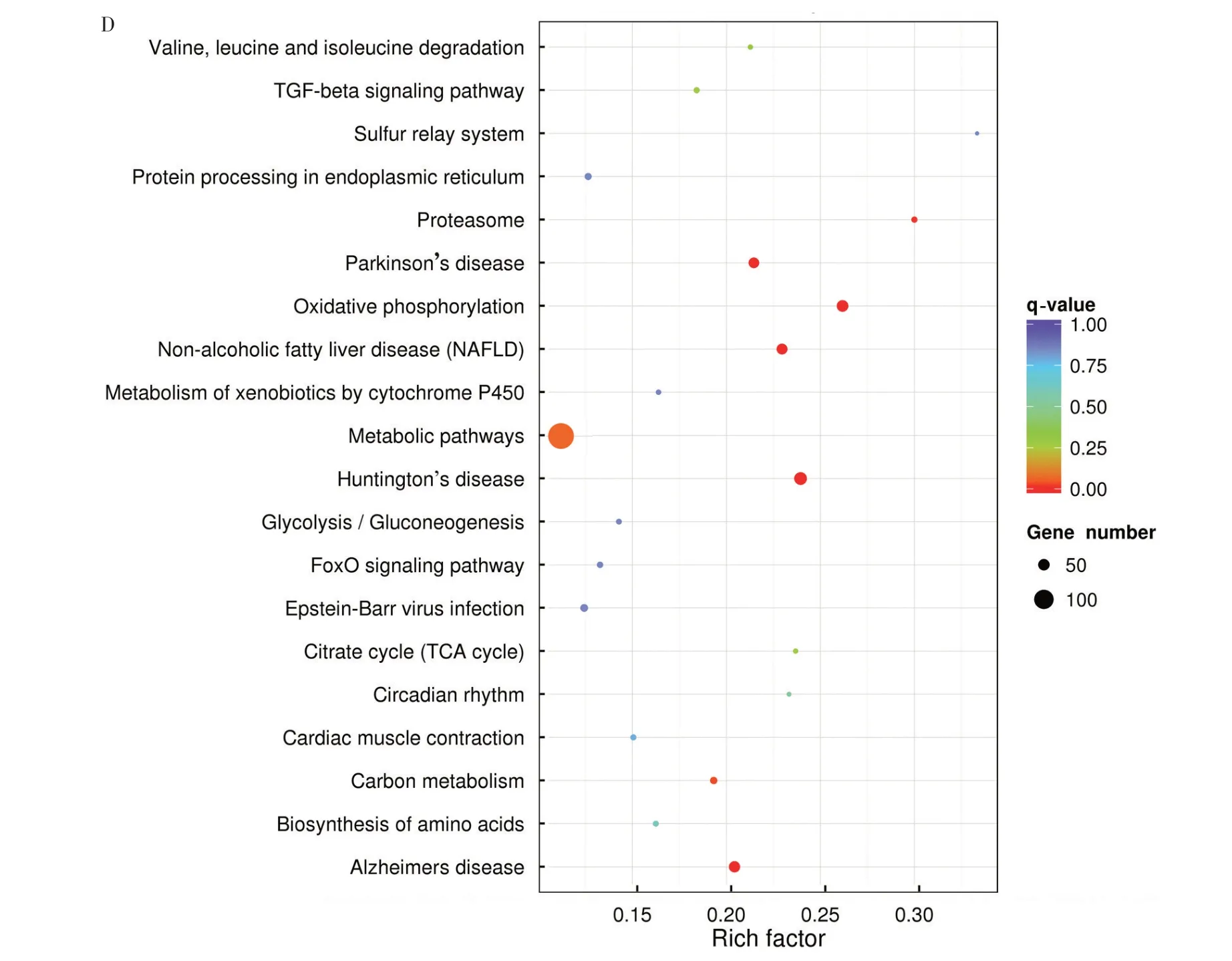
图3 基于RNA-seq的mRNA的差异表达分析和功能分析Fig.3 Differential expression analysis and functional analysis of mRNAs based on RNA-seq
2.5 基于RNA-seq的DEG和DElncRNA靶标的关联分析
为了解差异表达lncRNA 的调控功能,对差异的lncRNA 共表达mRNA 进行预测和KEGG 功能分析,以rich factor、q-value 和富集基因数量为筛选条件,筛选出富集最显著的30条pathway条目,结果显示,与lncRNA共表达mRNA大部分富集在MAPK信号通路、内质网中的蛋白质加工(Protein processing in endoplasmic reticulum)、胰岛素信号通路、碳代谢、神经营养素信号通路(Neurotrophin signaling pathway)、AMPK 信号通路(AMPK signaling pathway)、HIF-1 信号通路和前列腺癌(Prostate cancer)等。为了阐明PRRSV 感染组lncRNA 与mRNA 的关系,使用Cytoscape 软件构建差异显著的lncRNA 和lncRNA 共表达mRNA 中富集最显著的30 条pathway 条目的交互网络(图4)。结果显示,1个lncRNA 可以对应不同的靶点,如XR_497637.1靶向超氧化物歧化酶1(SOD1)和热休克因子1(HSPB1)等,lncRNA XR_500765.1 靶向FOS,XR_494665.1靶向Jun等。
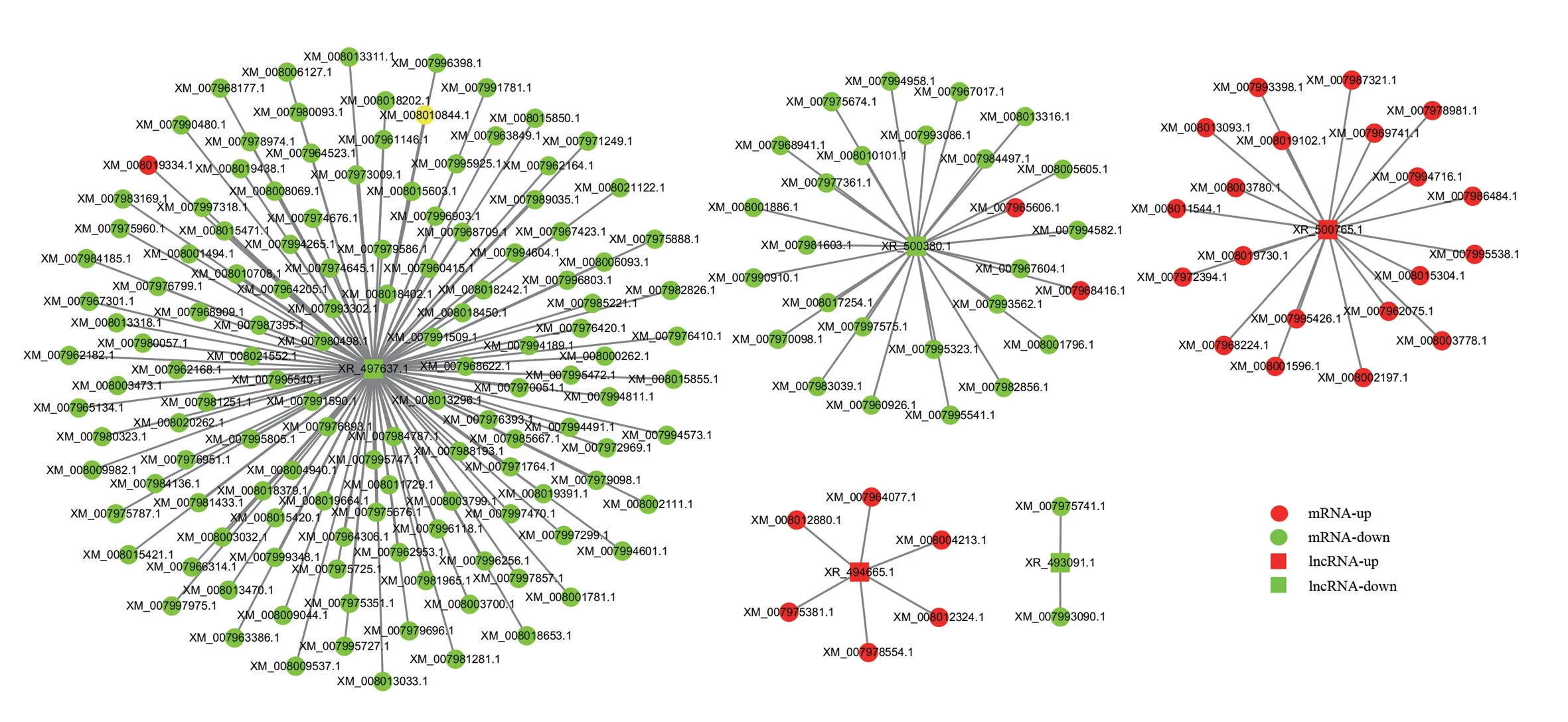
图4 基于RNA-seq的DEG和DElncRNA靶标的关联网络Fig.4 Association network of DEGs and DElncRNAs targets based on RNA-seq
3 结论与讨论
本研究通过对未感染和PRRSV 感染12 h 的Marc-145 细胞进行RNA-seq 高通量测序,揭示lncRNA 及其共表达的靶标可能在PRRSV 感染初期发挥的重要作用。经生物信息学分析,共有39个差异lncRNA 和1 320 个差异mRNA。为了解这些lncRNA 的调控功能,对差异的lncRNA 共表达的mRNA进行预测和功能分析,发现lncRNA共表达的mRNA 主要富集在MAPK 信号通路、AMPK 信号通路等。其中,HSPB1、Jun、FOS、SOD1等基因与PRRSV感染相关。
本研究中,与对照组相比,PRRSV 感染组lncRNA XR_500765.1 和XR_494665.1 的表达量均上调,同时预测其共表达的靶基因FOS和Jun的表达量也升高。通过KEGG 富集分析,发现FOS和Jun均参与MAPK 信号通路。MAPK 信号通路在细胞增殖、分化、凋亡、应激反应中发挥重要作用,与发育异常、肿瘤形成、癌症发生、自身免疫性疾病等有关[18]。细胞外信号调节激酶1/2(Extracellular signal⁃regulated kinase 1/2,ERK1/2)属于丝裂原活化蛋白激酶(Mitogen⁃activated protein kinase,MAPK)家族,其过度激活是癌症发展的一个主要因素。ERK1/2可将细胞外信号传递到细胞内,通过磷酸化调节各种核内转录因子活性,如原癌基因FOS、Jun、Myc以及含ETS结构域的蛋白质Elk-1和cAMP依赖性转录因子ATF2[19],从而促进细胞增殖、迁移、侵袭、耐药和转移的癌表型[20],最终影响细胞的特定生物学效应。这提示PRRSV 感染机体后可能通过XR_500765.1和XR_494665.1促进FOS和Jun表达。研究表明,FOS 和Jun 可激活核转录因子AP-1 的转录[21],从而进一步激活核基因的表达,以应对病毒的入侵。有研究报道,PRRSV 感染后也参与MyD88-ERK1/2-AP-1 信号通路[22],这提示FOS和Jun在PRRSV 感染初期在MAPK 信号通路中发挥重要的调节作用。
PRRSV 感染可引起动物机体产生氧化应激反应[23]。研究表明,活性氧(Reactive oxygen species,ROS)和SOD 在生物体氧化与抗氧化平衡中起重要作用[24]。本研究中,PRRSV 感染Marc-145 细胞后,lncRNA XR_497637.1 表达量下调,预测其共表达的靶标SOD1的表达量降低,推测lncRNA 可能作为内源竞争RNA(ceRNA)竞争性结合miRNA,从而调控miRNA 的靶标,导致SOD1表达下调,这可能进一步影响PRRSV的复制。ROS尤其是超氧化物的产生,是杀死入侵病原体的重要宿主防御机制,抗氧化剂SOD 含量降低可能会抑制机体对病毒感染产生的氧化应激反应,对机体起到保护的作用。但也有报道病毒感染引起机体免疫过度,ROS 大量表达造成免疫损伤,导致机体免疫功能下降,从而引起病毒复制能力增强[25]。LEE 等[26]研究发现,PRRSV 感染Marc-145 细 胞 后 ,ROS 含 量 增 加 ;CHARERNTANTANAKUL等[27]研究发现,PRRSV 感染PAM 12 h 后,PAM 中O2-·和H2O2含量增加。这与本研究中PRRSV 感染Marc-145 细胞后预测lncRNA XR_497637.1 共表达的SOD1表达下调一致。XU 等[28]研究发现,在肝癌细胞中,lncRNASNHG14表达量上调后,通过结合miRNA-217,直接靶向上调IGF1R和KLF5表达量,以促进癌细胞的增殖。前人研究表明,lncRNACTC-497E21.4 与miR-22 竞争以调节NET1的表达,并通过RhoA 信号通路调节胃癌的恶性进展[29]。LNC00689 直接与miR-338-3p 相互作用促进丙酮酸激酶M2(PKM2)的表达,发挥ceRNA 的作用[30]。这与本研究中lncRNA XR_497637.1 可能作为ceRNA 竞争性结合miRNA,导致SOD1表达量下调的预测结果一致。本研究中,PRRSV 感染Marc-145 细胞12 h 后lncRNA XR_497637.1 表达下调,预测其共表达的HSPB1的表达量下调。
综上,本研究对差异表达的lncRNA 和mRNA进行功能分析,以及差异表达的lncRNA 与mRNA联合分析,筛选出PRRSV 感染中潜在的候选lncRNA 和靶基因,如lncRNA XR 靶向500765.1 靶向FOS、XR_494665.1 靶向Jun、XR_497637.1 靶向SOD1、HSPB1。下一步可以对这些lncRNA 和靶基因进行缺失和过表达的功能研究,以便进一步了解lncRNA 在PRRSV感染宿主中的作用,为PRRS的治疗提供新的研究思路。
