二甲双胍对高糖诱导的RF/6A细胞增殖、迁移和血管形成的影响及其可能机制△
2023-05-18孟婷宇杨彬彬丁芝祥
孟婷宇 范 晶 郑 柳 杨彬彬 丁芝祥
糖尿病视网膜病变(DR)是2型糖尿病患者常见的微血管并发症,也是劳动年龄人群失明的主要原因之一。DR的特征是视网膜微血管功能和完整性发生改变,导致视网膜进行性缺血,最终促使其新生血管形成。尽管关于DR新生血管形成的研究繁多,但其潜在的分子机制仍不清楚。近年来,Hippo信号通路与DR之间的关系成为研究热点,越来越多的证据表明,Hippo信号通路在DR视网膜新生血管形成的过程中起着突出作用。
二甲双胍(MET)是一种廉价且安全的双胍衍生物,被广泛用于2型糖尿病治疗的一线药物。MET治疗DR的作用机制存在抑制血管内皮生长因子(VEGF)信号转导、抑制视网膜炎症反应、改善胰岛素抵抗等多种学说[1-3]。以往许多研究证实了MET对DR患者和动物模型的有益作用[4-5]。同时,MET作为Hippo信号通路的阻断剂,已在细胞水平证实它可通过Hippo信号通路起到抑制肿瘤的作用[6]。基于此,我们设计本实验来观察MET对高糖诱导的恒河猴脉络膜-视网膜内皮细胞RF/6A增殖、迁移和血管形成的影响,并分析其与Hippo信号通路的关系,为开发新的DR治疗方法提供参考。
1 材料与方法
1.1 材料
1.1.1 实验细胞RF/6A细胞购自武汉普诺赛生命科技有限公司。
1.1.2 主要实验试剂及仪器特级胎牛血清、MEM(ATCC改良)基础培养基(武汉普诺赛生命科技有限公司);D-无水葡萄糖、MET、组织细胞固定液(多聚甲醛)、结晶紫染色液、RIPA细胞裂解液、PMSF溶液、蛋白质上样缓冲液(北京索莱宝科技有限公司);Cell Counting Kit-8(CCK-8)(美国GLPBIO公司);Matrigengel(上海诺娃医药科技有限公司);MonScriptTMRTIII All-in-One Mix with dsDNase、MonAmpTM2×Taq Mix Pro(+Dye)(莫纳生物科技有限公司);一步法Western blot专用封闭液(北京康为世纪生物科技有限公司)。酶标仪(南宁博美生物科技有限公司);核酸检测仪(北京凯奥科技发展有限公司);凝胶成像分析仪(上海天能科技有限公司)。
1.2 方法
1.2.1 细胞培养将RF/6A细胞置于含体积分数10%特级胎牛血清的MEM(含1000 mg·L-1D-葡萄糖)完全培养基中,在37 ℃、体积分数5%CO2、饱和湿度的细胞培养箱中正常培养。每周换液2~3次。当细胞融合度超过80%时进行传代处理,传代比例为12~14。取复苏后第2代至第5代对数生长期的RF/6A细胞进行消化、重悬、计数,用于实验。
1.2.2 CCK-8法检测MET对高糖诱导的RF/6A细胞增殖活性的影响取RF/6A细胞制成 1.2×105个·mL-1的细胞悬液,以每孔100 μL接种于96孔板上,在MEM基础培养基(无血清)中饥饿24 h后,NC组细胞置于MEM基础培养基中培养48 h,HG组细胞置于高糖培养基(含4500 mg·L-1D-葡萄糖)中培养48 h,HG+15 mmol·L-1MET组、HG+30 mmol·L-1MET组、HG+45 mmol·L-1MET组细胞分别置于含不同浓度(15 mmol·L-1、30 mmol·L-1、45 mmol·L-1)MET的高糖培养基中培养48 h。然后,弃掉上清液,每孔加入含体积分数10% CCK-8的MEM基础培养基100 μL,孵育2 h后,使用酶标仪检测450 nm波长下的吸光度。
1.2.3 CCK-8法检测MET对RF/6A细胞毒性的影响取按1.2.2方法饥饿了24 h的RF/6A细胞,NC组细胞置于MEM基础培养基中培养48 h,NC+15 mmol·L-1MET组、NC+30 mmol·L-1MET组、NC+45 mmol·L-1MET组细胞分别置于含不同浓度(15 mmol·L-1、30 mmol·L-1、45 mmol·L-1)MET的MEM基础培养基中培养48 h。然后,弃掉上清液,每孔加入含体积分数10% CCK-8的MEM基础培养基100 μL,孵育2 h后,使用酶标仪检测450 nm波长下的吸光度。
1.2.4 细胞划痕法检测MET对高糖诱导的RF/6A细胞迁移的影响用记号笔在6孔板每孔的背面画5条平行的横线,每隔0.5~1.0 cm一条。取RF/6A细胞制成细胞浓度为1.5×105个·mL-1的细胞悬液,以每孔2 mL接种于6孔板上。培养至100%铺满板底后,用200 μL枪头垂直板底,垂直于背面的5条平行横线自上而下划痕。弃掉上清液,沿6孔板侧壁缓慢加入1 mL PBS,轻摇使板底铺满PBS后弃掉,重复3次,去除划下的细胞。NC组置于MEM基础培养基、HG组置于高糖培养基、HG+15 mmol·L-1MET组置于含15 mmol·L-1MET的高糖培养基中培养48 h。加药后0 h、48 h时,在倒置生物显微镜下拍照记录。采用ImageJ软件测量并计算细胞迁移率。细胞迁移率=(0 h划痕面积-48 h划痕面积)/0 h划痕面积×100%。
1.2.5 Transwell法检测MET对高糖诱导的RF/6A细胞迁移的影响取RF/6A细胞制成细胞浓度为5×104个· mL-1的细胞悬液,以每孔200 μL接种于Transwell上室,在Transwell下室加入500 μL MEM完全培养基后培养24 h。然后,弃掉Transwell上室、下室中的液体。NC组的上室加入MEM基础培养基200 μL,下室加入含体积分数20%特级胎牛血清的MEM基础培养基500 μL。HG组、HG+15 mmol·L-1MET组上室分别加入高糖培养基和含15 mmol·L-1MET的高糖培养基200 μL,下室加入含体积分数20%特级胎牛血清的高糖培养基500 μL。培养48 h后,用40 g·L-1多聚甲醛固定30 min,1 g·L-1结晶紫染色液染色20 min。待自然干燥后,在倒置生物显微镜下随机取5个视野拍照记录。采用ImageJ软件测量细胞迁移数,所得细胞迁移数的平均值用于统计分析。
1.2.6 Matrigengel法检测MET对高糖诱导的RF/6A细胞血管形成的影响取RF/6A细胞制成细胞浓度为1×105个·mL-1的细胞悬液,以每孔2 mL接种于6孔板上。待细胞贴壁后,弃掉上清液,NC组细胞置于MEM完全培养基、HG组细胞置于高糖完全培养基、HG+15 mmol·L-1MET组细胞置于含15 mmol·L-1MET的高糖完全培养基中培养 48 h。Matrigengel置于4 ℃冰箱过夜后,用MEM基础培养基稀释1倍。将Matrigengel以每孔50 μL加入96孔板中,孵育60 min使胶凝固。取培养了48 h的RF/6A细胞制成1.2×105个·mL-1的细胞悬液,以每孔100 μL接种于铺好胶的96孔板上,孵育6 h。然后,在倒置生物显微镜下随机取3个视野拍照记录。采用ImageJ软件测量血管的总长度,所得血管的总长度的平均值用于统计分析。
1.2.7 RT-PCR检测MET对高糖诱导的RF/6A细胞中YAP、TEAD1 mRNA表达的影响取按 1.2.6 方法培养了48 h的RF/6A细胞,用TRIzol法提取RNA。使用核酸检测仪检测提取的RNA浓度和纯度并记录,要求样品的OD260/OD280处于1.8~2.0。然后,使用MonScriptTMRTIII All-in-One Mix with dsDNase合成第一链cDNA。PCR扩增反应组分为第一链cDNA、正向引物、反向引物各1 μL,MonAmpTM2×Taq Mix Pro(+Dye)10 μL,ddH2O 7 μL。反应程序为94 ℃预变性3 min,94 ℃变性15 s,55 ℃退火15 s,72 ℃延伸15 s,72 ℃终延伸5 min(变性、退火、延伸循环25次)。反应程序结束后,取5 μL PCR反应液进行琼脂糖凝胶电泳。通过凝胶成像分析仪对其进行拍照记录。采用ImageJ软件检测mRNA表达量并以β-actin为内参计算YAP、TEAD1的mRNA相对表达量。YAP:正向引物为5’-AACACTGGAGCAGGATGGTG-3’,反向引物为5’-GGGTTCGAGGGACACTGTAG-3’;TEAD1:正向引物为5’-CAAGGTTTGAGAATGGCCGATTT-3’,反向引物为5’-GTTGTGGCTCCGTGTTCACTATTT-3’;β-actin:正向引物为5’-CTCACCATGGATGATGATATCGC-3’,反向引物为5’-CACATAGGAATCCTTCTGACCCA-3’。
1.2.8 Western blot检测MET对高糖诱导的RF/6A细胞中YAP、TEAD1蛋白表达的影响取按 1.2.6 方法培养了48 h的RF/6A细胞,用RIPA细胞裂解液和PMSF溶液(100 mmol·L-1)(1001)裂解细胞,再用超声波细胞破碎仪进一步裂解。4 ℃ 12 000 r·min-1离心30 min,用BCA法测定蛋白浓度。取上清液,加入相应体积的蛋白质上样缓冲液(4倍稀释)。100 ℃热浴10 min使蛋白变性,-80 ℃储存。SDS-PAGE电泳、转膜,用一步法Western专用封闭液封闭1 h。放入稀释好的一抗(均按 11000稀释)中,4 ℃孵育过夜。1×TBST充分洗膜后放入稀释好的二抗(均按12000稀释)中,常温孵育2 h。1×TBST充分洗膜后化学发光。采用 ImageJ 软件检测蛋白表达量,并以β-actin为内参计算 YAP、TEAD1的蛋白相对表达量。
1.3 统计学方法采用GraphPad Prism 8统计学软件进行统计分析,数据以均数±标准差表示。多组间整体比较采用单因素方差分析,组间两两比较采用t检验。检验水准:α=0.05。
2 结果
2.1 MET对高糖诱导的RF/6A细胞增殖活性的影响CCK-8法检测结果显示,与NC组比较,HG组RF/6A 细胞的增殖活性升高;与HG组比较,HG+15 mmol·L-1MET组、HG+30 mmol·L-1MET组和HG+45 mmol·L-1MET组RF/6A细胞的增殖活性降低,差异均有统计学意义(均为P<0.001)(图1)。

图1 MET对高糖诱导的RF/6A细胞增殖活性的影响 与HG组比较,***P<0.001,****P<0.000 1。
2.2 MET对RF/6A细胞增殖的影响CCK-8法检测结果显示,与NC组比较,NC+30 mmol·L-1MET组和NC+45 mmol·L-1MET组细胞增殖活性均降低,差异均有统计学意义(均为P<0.000 1)。而NC组与NC+15 mmol·L-1MET组比较,细胞增殖活性差异无统计学意义(P=0.227 3),表明15 mmol·L-1的MET对RF/6A细胞的存活率无影响,因此选择15 mmol·L-1MET进行后续实验(图2)。

图2 MET对RF/6A细胞增殖的影响 与NC组比较,****P<0.000 1。
2.3 MET对高糖诱导的RF/6A细胞迁移的影响细胞划痕法检测结果显示,NC组、HG组、HG+15 mmol·L-1MET组RF/6A细胞迁移率分别为(10.790±0.948)%、(23.040±2.149)%、(2.823±1.188)%。与NC组比较,HG组RF/6A 细胞的迁移率升高(P<0.01);与HG组比较,HG+15 mmol·L-1MET组RF/6A 细胞的迁移率降低(P<0.01)(图3)。Transwell法检测结果显示,NC组、HG组、HG+15 mmol·L-1MET组RF/6A细胞的迁移个数分别为(359.30±3.84)个、(772.80±65.68)个、(278.90±23.42)个。与NC组比较,HG组RF/6A 细胞的迁移个数增加(P<0.01);与HG组比较,HG+15 mmol·L-1MET组RF/6A 细胞的迁移个数减少(P<0.01)(图4)。

图3 细胞划痕法检测MET对高糖诱导的RF/6A细胞迁移的影响
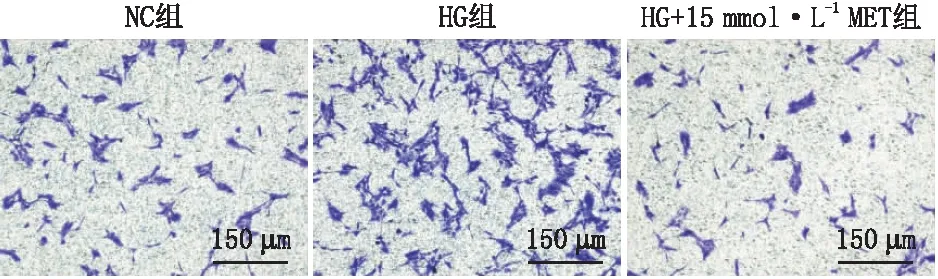
图4 Transwell法检测MET对高糖诱导的RF/6A细胞迁移的影响
2.4 MET对高糖诱导的RF/6A细胞血管形成的影响Matrigengel法检测结果显示,NC组KF/6A细胞的血管总长度为100.00±15.79,HG组、HG+15 mmol·L-1MET组RF/6A细胞的血管相对总长度分别为212.80±20.64、88.82±13.92。与NC组比较,HG组RF/6A 细胞的血管相对总长度增加(P<0.05);与HG组比较,HG+15 mmol·L-1MET组RF/6A 细胞的血管相对总长度减少(P<0.01)(图5)。

图5 MET对高糖诱导的RF/6A细胞血管形成的影响
2.5 MET对高糖诱导的RF/6A细胞中YAP、TEAD1 mRNA表达的影响RT-PCR检测结果显示,与NC组比较,HG组RF/6A 细胞的YAP、TEAD1 mRNA相对表达量均增加(均为P<0.05);与HG组比较,HG+15 mmol·L-1MET组RF/6A 细胞的YAP、TEAD1 mRNA相对表达量均减少(均为P<0.05)(图6)。

图6 MET对高糖诱导的RF/6A细胞中YAP、TEAD1 mRNA表达的影响 与HG组比较,*P<0.05,**P<0.01。
2.6 MET对高糖诱导的RF/6A细胞中YAP、TEAD1蛋白表达的影响Western blot法检测结果显示,与NC组比较,HG组RF/6A 细胞的YAP、TEAD1蛋白相对表达量均增加(均为P<0.05);与HG组比较,HG+15 mmol·L-1MET组RF/6A 细胞的YAP、TEAD1蛋白相对表达量均减少(均为P<0.05)(图7)。
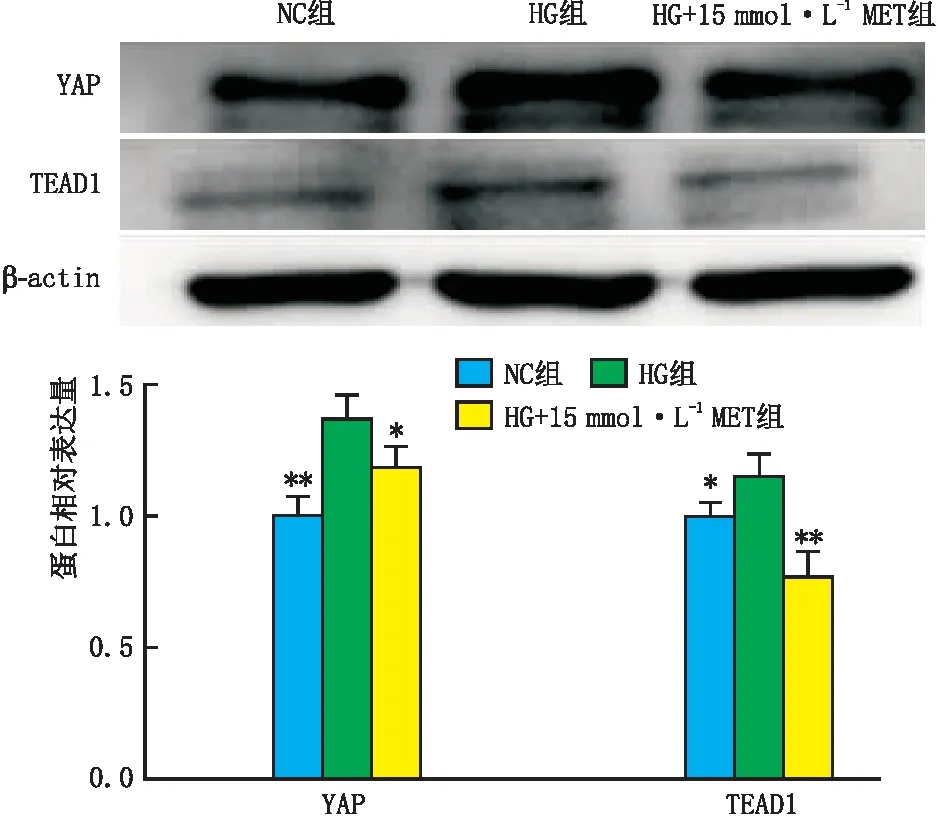
图7 MET对高糖诱导的RF/6A细胞中YAP、TEAD1蛋白表达的影响 与HG组比较,*P<0.05,**P<0.01。
3 讨论
DR是临床上十分常见的致盲性眼病。随着生活水平的改善和人口老龄化程度的加深,DR已成为全球重大公共卫生问题。DR新生血管发生的机制错综复杂。高血糖所导致的氧化应激、多元醇通路激活、蛋白激酶C活化、晚期糖基化终末产物堆积、炎症等不同程度地造成了视网膜微血管损伤,血-视网膜屏障的破坏和毛细血管无灌注导致视网膜缺血,促血管生成因子水平上调,从而驱动病理性新生血管形成[7]。
Hippo信号通路最初是在果蝇身上发现的,与细胞的存活、生长、增殖、迁移、凋亡,组织、器官的生长发育,肿瘤的发生发展,免疫调节等众多生物学反应息息相关,是组织生长的关键调节因子。Hippo信号通路在哺乳动物细胞中的主要核心组分包含:激酶级联哺乳动物STE20样激酶1/2(MST1/2)和大肿瘤抑制因子激酶1/2(LATS1/2);调节分子萨尔瓦多家族WW结构域蛋白1(SAV1)和MOB激酶激活剂1(MOB1);以及下游效应因子YAP/含有PDZ结合位点转录共激活因子(TAZ)和TEADs。MST-LATS-YAP/TAZ-TEADs轴被称为Hippo信号通路的经典轴。而越来越多的证据表明,Hippo信号通路在DR的发病机制中也扮演着重要角色。在动物水平,视网膜组织中已经检测到TEAD和YAP的表达[8-9],并且它们在视网膜血管的形成和病理过程中都起着重要作用[10-11]。Xing等[12]的研究发现:高糖环境可促进RF/6A细胞增殖、迁移、小管形成并使YAP的mRNA和蛋白、VEGF及VEGF受体表达显著增加,而YAP沉默则抑制细胞迁移、血管形成和VEGF的表达。Hao等[13]的研究进一步在动物水平揭示了Hippo信号通路与DR之间的关系:链脲佐菌素诱导的糖尿病SD大鼠的视网膜中LATS、TAZ、TEAD蛋白的表达水平明显升高,磷酸化MST和磷酸化YAP 的表达水平明显降低。本研究发现,高糖条件可促进RF/6A细胞增殖、迁移、血管形成,并使细胞中YAP、TEAD1的mRNA及蛋白表达水平升高,与既往的研究结果相符。
有大量文献描述了MET对新生血管的影响。陈冠吉等[14]的研究表明,MET被初步证实能有效抑制大鼠肝癌新生血管。而在眼的相关研究中发现,MET能抑制小鼠角膜新生血管[15]。与文献中描述的一致,本研究中,在高糖条件下,MET降低了RF/6A细胞的增殖活性,减少了RF/6A细胞的迁移个数、迁移率和血管的总长度。因此我们推测,MET对DR的作用是通过抑制新生血管形成来实现的。
MET作为2型糖尿病的一线药物,也具有抗肿瘤作用,能抑制肿瘤生长,降低癌症风险和改善预后,并具有安全性和可耐受性。MET可通过诱导腺苷酸活化蛋白激酶(AMPK),直接使YAP磷酸化,从而抑制YAP的转录活性。在细胞和动物水平,MET已被证实可通过AMPK非依赖性途径减少YAP的核定位,抑制乳腺癌的发展[16]。Zhang等[17]的研究表明,MET可使YAP磷酸化后失活,抑制YAP从细胞质到细胞核的移位,从而抑制其转录活性,进而抑制结直肠癌细胞PD-L1的表达。在本研究中,高糖诱导的RF/6A 细胞中YAP、TEAD1的mRNA及蛋白表达水平升高,MET可以下调YAP、TEAD1的mRNA及蛋白表达水平。故我们推测,MET对DR的作用机制可能与Hippo信号通路有关。
本研究结果显示,MET能抑制高糖诱导的RF/6A细胞增殖、迁移和血管形成,下调YAP、TEAD mRNA及蛋白的表达,提示MET对高糖诱导的RF/6A细胞的增殖、迁移和血管形成有抑制作用,其作用机制可能与Hippo信号通路有关。本研究首次在体外实验水平初步探索了MET在高糖条件下对RF/6A细胞增殖、迁移、血管形成的影响及其与Hippo信号通路的关系,为进一步了解Hippo信号通路在眼底新生血管疾病中的重要作用以及MET用于DR的治疗提供了新见解。但MET如何通过Hippo信号通路抑制高糖条件下RF/6A细胞的增殖、迁移、血管形成尚需要进一步研究来证实。另外,本研究仅做了体外细胞模型的实验,还需要在动物模型及人体试验中进一步验证。
