运动血流动力学检测对预测肥厚型心肌病预后的价值
2023-05-18魏俊俊王先涛栾献亭
魏俊俊,王先涛,栾献亭
肥厚型心肌病(HCM)是最常见的单基因遗传性心脏病。恶性心律失常和心力衰竭(心衰)是HCM病程中最常见的不良事件[1]。其中,恶性心律失常的危险分层是HCM临床管理中的重要部分。根据美国心脏协会(AHA)/美国心脏病学会(ACC)指南[2],40岁以下猝死家族史、晕厥、非持续性室性心动过速(NSVT)、最大左室壁厚度≥30 mm,以及运动中的异常血压反应(ABPR)为VA分层的主要危险因素。然而,欧洲心脏病学会(ESC)指南[3]推荐的心源性猝死风险模型虽包括左心室流出道梗阻(LVOTO),但不涉及包含ABPR在内的运动试验变量。在既往研究中,HCM运动血流动力学相关风险评估较为复杂,LVOTO与ABPR之间的关系尚不清楚。一些研究将ABPR归因于LVOTO的发生,但其他研究则并未显示LVOTO和ABPR之间存在相关性。目前尚无针对中国HCM合并ABPR人群的预后相关报道[4]。因此,本研究旨在描述中国队列中,HCM合并ABPR患者的临床特征,阐明HCM患者队列中ABPR和LVOTO之间的相关性,并确定ABPR是否与HCM中的不良结局独立相关。
1 资料与方法
1.1 研究对象与分组本研究回顾性纳入2014~2018年间于平顶山市第二人民医院心内科就诊并接受基线心肺运动试验和后续临床随访的成人HCM患者103例,其中男性57例,女性46例,年龄41~62(46.13±4.99)岁。纳入标准:符合HCM诊断标准;年龄≥18岁;入院时接受心肺运动试验。排除标准:排除浸润性肥大患者,合并冠心病在内的其他心血管疾病;合并肿瘤、凝血异常、自身免疫性疾病等其他系统疾病;患者失访。根据是否合并ABPR分组,其中ABPR组患者27例,对照组76例。
1.2 方法
1.2.1 定义ABPR定义为在运动时峰值收缩压(SBP)较基线升高<20 mmHg。LVOTO定义为在休息时,Valsalva动作,或运动后左心室流出道压差>30 mmHg,后续数据分析时选取三者最大压差为左心室流出道压差值。
1.2.2 研究终点事件包括恶性心律失常和(或)心衰相关事件。其中,恶性心律失常事件包括室性心动过速(VT),室颤(VF),猝死,植入式心律转复除颤器(ICD)适当放电等。心衰相关事件包括心衰相关再入院、心衰相关死亡或移植。
1.3 统计学处理所有数据均采用SPSS 22.0统计学软件及GraphPad Prism 8.0软件分析。计量资料采用均数±标准差(±s)表示,组间均数的比较采用t检验或Mann-Whitney U检验。计数资料采用例数(构成比)表示,组间比较采用χ2检验或Fisher精确检验。采用Kaplan Meier曲线分析和Cox比例风险模型进行生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 ABPR及对照组临床基线资料特点ABPR组男性比例显著低于对照组(37.04% vs.61.84%,P<0.05)。ABPR组左心室游离壁厚度显著增大[(19.67±2.17) mm vs.(17.95±1.88) mm,P<0.05]。ABPR组患者左心室流出道压差显著高于对照组[(43.22±24.52) mmHg vs.(31.11±17.12) mmHg,P<0.05]。ARRP组的运动峰值血压[(130.48±16.49)mmHg vs.(164.61±13.08)mmHg,P<0.05]、预测最大摄氧量[(65.05±16.80)% vs.(81.47±12.48)%,P<0.05]、换气比值[(1.06±0.02) vs.(1.16±0.02),P<0.05]、代谢当量[(5.39±1.44) vs.(8.20±3.34),P<0.05]等均显著低于对照组。ABPR组应用β受体阻滞剂和(或)钙离子拮抗剂类药物的比例较对照组更高(81.48% vs.48.68%,P<0.05),表1。
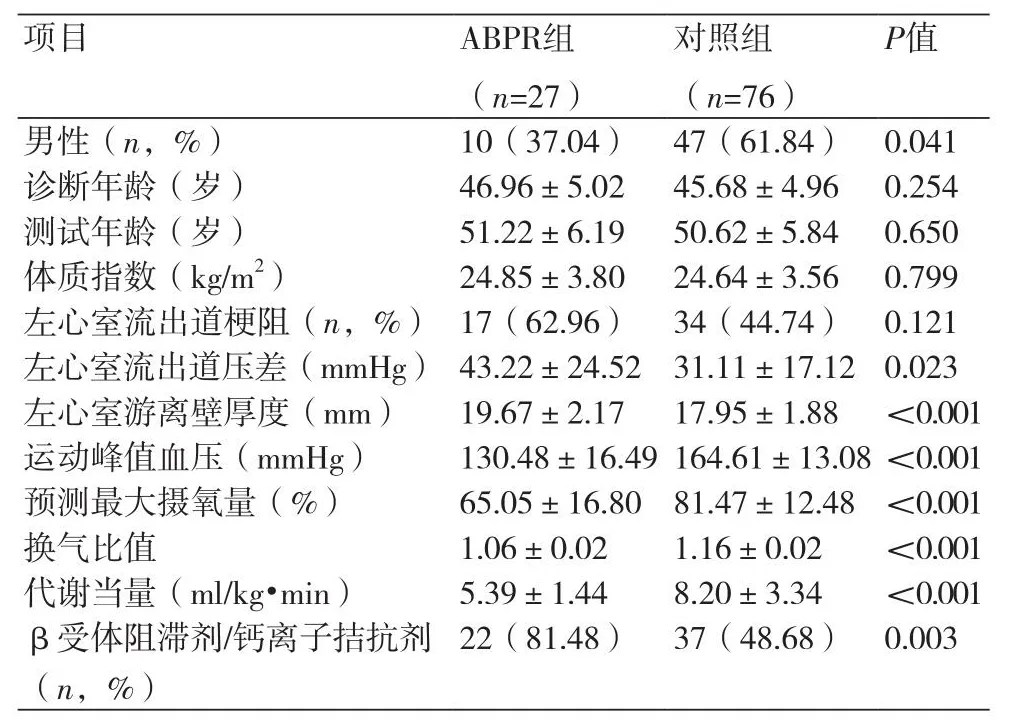
表1 ABPR组及对照组HCM患者基线资料
2.2 ABPR和LVOTO相关性分析在基线资料统计时,ABPR组及对照组中合并LVOTO的比例无显著差别。但ABPR患者是否合并LVOTO可能对HCM患者发生ABPR的原因及预后产生影响。基于此种假设,我们对ABPR组患者根据是否存在LVOTO细分亚组,并进行亚组分析。比较预测最大摄氧量,ABPR组预测最大摄氧量均显著低于对照组,提示运动能力减弱。亚组分析,ABPR组内是否存在LVOTO预测最大摄氧量无明显影响(图1)。然而,单纯合并LVOTO的HCM患者,代谢当量显著低于无LVOTO患者,且显著高于ABPR患者(图2)。
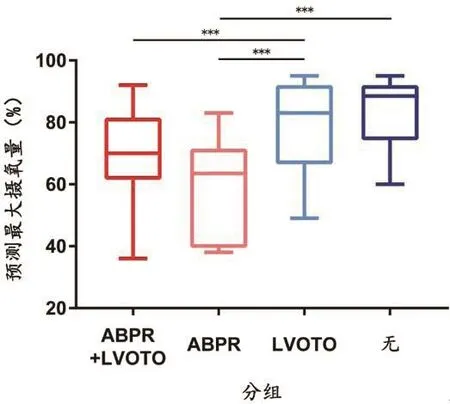
图1 不同亚组间预测最大摄氧量(%)

图2 不同亚组间代谢当量(ml/kg·min)
2.3 ABPR与生存分析所有入组HCM患者平均进行4.37±1.31年随访,共12例(11.65%)患者发生恶性心律失常事件,13例(12.62%)患者发生心衰相关事件。与对照组相比,ABPR组患者中期随访发生恶性心律失常事件的风险无明显差异(P=0.536),而发生心衰相关事件的风险则显著增加(P=0.028),(图3)。是否合并LVOTO分别在ABPR组和对照组的事件发生率均无明显影响。
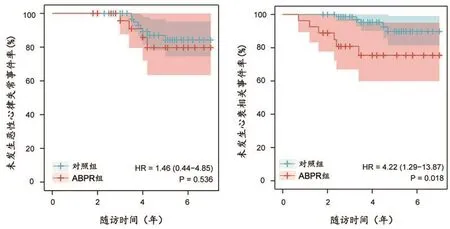
图3 ABPR组及对照组中期随访恶性心律失常/心衰相关事件发生情况
3 讨论
本研究采用单中心回顾性分析方式,比较27例合并ABPR的HCM与67例对照组HCM患者的临床特征与预后特点。研究发现,相比于对照组,ABPR组患者中男性比例更高,左心室游离壁厚度显著增加,运动峰值血压、预测最大摄氧量、换气比值显著下降,左室流出道压差显著上升,但发生LVOTO患者占比无明显差别。中期随访结果提示,ABPR组患者恶性心律失常事件无明显增加,而心衰相关事件风险显著增加。
恶性心律失常事件在HCM患者人群中发生率高且危险性大。关于HCM高危患者的恶性心律失常事件危险分层及临床管理仍是一个重大难题。考虑到ABPR在HCM患者队列发生占比较高,明确ABPR的产生机制和实际临床中的潜在应用价值具有重要意义。根据部分既往研究报告,ABPR可提示猝死风险的提高[5]。在ACC/AHA指南[2]中,ABPR仍作为HCM猝死风险的主要风险因素,并作为指导ICD植入干预治疗的单危险因素。然而,越来越多的国外最新临床队列研究结果发现,ABPR不适合纳入关于猝死和心律失常相关事件的危险分层模型[6]。1项针对HCM队列危险因素的荟萃分析[7],在纳入的6项包含ABPR的研究中,4项研究发现ABPR与心源性猝死的发生无明显相关性,在实际临床决策中的作用证据不足。因此,目前ESC提出的最新版HCM危险评分模型[3]中并未纳入ABPR作为评分指标。
本研究首次报道ABPR在中国HCM队列中的临床特征,并通过中期随访发现ABPR与恶性心律失常或猝死无关。ABPR与预测最大摄氧量降低相关,且这一趋势与LVOTO无关。该结果提示HCM患者在入组的基线条件下,ABPR可能出现一定程度的心脏储备功能下降,导致运动能力降低。而在随访中发现,ABPR组患者出院后发生心衰相关事件的可能性显著增加,而这种相关性同样与是否存在LVOTO无关。这一结果提示,ABPR可能有助于识别有进展为心衰风险的患者,具有潜在作为一种独立于LVOTO外的,提示心脏储备功能及心衰风险评估的运动试验参数。
根据研究报道,8%的HCM患者伴有左室收缩功能障碍。其中,35%的伴有收缩功能障碍的患者会经历全因死亡、心脏移植、左室辅助装置植入等心衰相关事件[8]。然而,现阶段关于HCM风险预测的研究主要基于恶性心律失常事件,特别是心源性猝死[9]。目前仍缺乏有效的特异性识别HCM心衰风险的临床指标及成熟的心衰预测模型。本研究为HCM患者心衰风险的评估提供了可供参考的心肺运动试验指标,为今后开展基于ABPR的前瞻性队列研究提供了支持。
本研究作为回顾性研究,并仅纳入了单中心的数据,存在一定的选择偏倚。同时,由于纳入患者数量有限,本研究结果更多是反应ABPR与恶性心律失常及心衰的相关性趋势,而并非准确的危险评分。同时,本研究中未对患者进行基因检测,而HCM作为一种与遗传基因突变类型密切相关的心肌病[10],未来考虑在明确基因背景的前提下,对携带特定突变的HCM患者人群展开前瞻性的心肺运动试验。
