基于PPI分析新型冠状病毒(SARS-CoV-2)受体ACE2在高血压靶点中的网络关联影响
2023-05-18吴佳芸李玲玲朱春临姚睿祺黄力
吴佳芸,李玲玲,朱春临,姚睿祺,黄力
高血压是引发新型冠状病毒肺炎感染患者危重症与死亡的重要基础疾病与危险因素,寻找二者间紧密联系作用靶点有利于剖析和发现阻断两病进程,阻止不可逆医学结局的发生。研究发现,新型冠状病毒(SARS-CoV-2)受体ACE2不仅是新型冠状病毒入侵机体的重要门户[1],更是影响高血压发生发展的关键影响因子[2,3]。然而其在高血压靶点网络中的关联影响及作用方式目前仍有待深入阐明,ACEI等降压药物在高血压合并新型冠状病毒感染的患者中的应用亦有待验证。本研究拟从PPI网络分析的角度入手,探究新型冠状病毒(SARS-CoV-2)受体ACE2在高血压靶点中的网路关联作用,以期找出关键靶点与蛋白模块,为新型冠状病毒感染合并高血压患者的治疗提供思路。
1 材料与方法
1.1 确定高血压相关疾病靶点通过以“hypertension”作为关键词检索以下四大数据库:Genecards(https://www.genecards.org)、OMIM(http://www.omim.org)、DisGeNET(https://www.disgenet.org)和TTD(http://db.idrblab.net/ttd/) ,获取与高血压相关的疾病靶点。值得注意的是,在应用DisGeNET和Genecards数据库寻找靶点时,由于所获靶点众多且部分关联分数极低,提示其与高血压的关联不大,故进一步采用靶点关联分数>关联分数整体中位数的标准对靶点进行二次筛选,最终仅保留与高血压相关性较高的靶点。结果显示,SARSCoV-2受体ACE2蛋白本身就是高血压相关的作用靶点之一。
1.2 遴选与ACE2最为直接相关的关键靶点将上述ACE2和其他所获取的靶点通过Uniprot KB数据库进行统一规范化命名,确定gene symbol。将其一并导入String在线平台(http://www.string-db.org/),获取蛋白-蛋白互相作用(protein-protein interaction,PPI)网络,物种设置为人类,导出TSV文件。通过Cytoscape3.8.0软件分析网络拓扑参数,结合度值、中心介度、紧密度等指标找出与ACE2最为密切相关的靶点。
1.3 构建靶点互作网络与核心蛋白模块功能分析将与ACE2及与其联系最为密切的33个靶点再次输入至String数据库,得到新的PPI网络。通过String自带的聚类功能提取该网络中的核心蛋白功能模块,选择K-means算法进行网络聚类分析。
1.4 生物学功能及通路富集分析通过Metascape平台(https://metascape.org/)对ACE2及与其紧密相关的三大核心蛋白模块所涉及的靶点进行生物学功能GO及KEGG富集分析,初步确定这些靶点参与发挥作用的生物学过程(biological process,BP)、细胞结构(cellular component,CC)、分子功能(molecular function,MF)以及主要集聚的细胞传导信号通路。
1.5 评估ACE2在互作网络中的关联影响将ACE2所在模块作为内网络,筛选出除去ACE2所在模块外的其他模块间的彼此关联作用(即跨模块关联),以便于更好评估ACE2所在模块在互作网络中对其他模块的作用,应用SPSS20.0进行统计并作图。根据均值和中位数确定,最终以0.7作为筛选标准进一步分选数据,保留符合标准的内容(包括跨模块关联蛋白及关联分数),对二者分别求和计算得到各自总评分。
2 结果
2.1 ACE2直接相关的核心靶点在OMIM和TTD数据库中,我们分别检索到66和107个高血压相关靶点;在Genecards数据库,最初得到了8435个靶点,通过关联分数中位数筛选(>11.96),最终得到555个相关靶点;而在DisGeNET数据库中共找到445个高血压靶点,后同样根据关联分数中位数筛选(>0.07)得到34个靶点。合并4个数据库合计共762个靶点,删除重复值,最终共得到675个高血压相关靶点(图1)。将ACE2和所得靶点一并导入String,分析显示共计得到586个节点,14 198条连线,平均节点degree值为48.5,平均局部聚类系数为0.493。其中,与ACE2直接相关的靶点共33个。将上述结果导出为TSV格式后导入Cytoscape 3.8.0软件,发现上述33个与ACE2直接关联的靶点间共形成267条连线,利用network analyzer工具进行分析,得到各靶点的网络拓扑学参数数据,表1。

表1 ACE2直接相关靶点
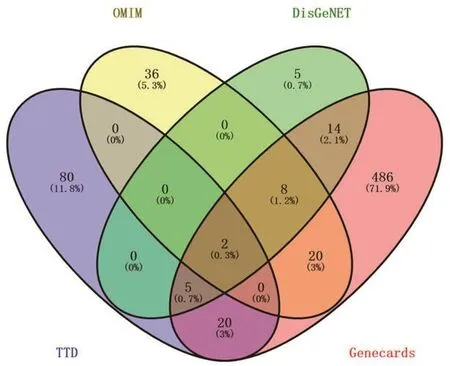
图1 高血压相关靶点分布情况
2.2 PPI网络将33个ACE2直接相关蛋白以及ACE2一并导入String数据库,得到蛋白与蛋白之间的互相作用关系网络(图2),共得到34个节点,267条连线,平均节点degree值为15.7,平均局部聚类系数为0.755。预期连线为39条,远低于实际形成连线数目,说明各靶点蛋白之间的相互作用比从基因组种随机抽取一组相似蛋白质之间的相互作用要多,联系交织较为紧密,这些蛋白整体在生物学功能上存在部分相连。
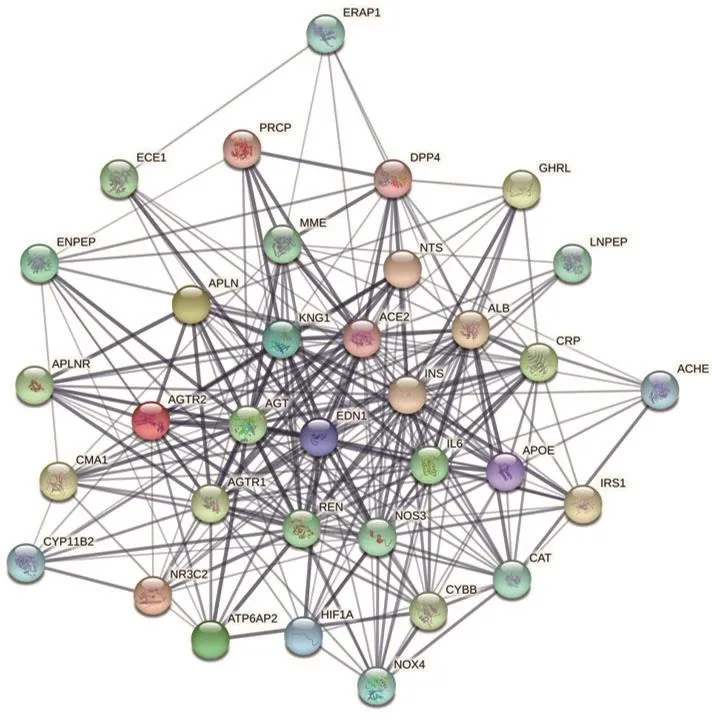
图2 PPI网络
2.3 主要蛋白模块功能分析通过K-means聚类分析的方法对PPI网络主要蛋白模块功能进行分析,最后得到红、蓝、绿3种不同颜色节点构成的三大主要蛋白模块。其中,模块1(红色)由AGTR2、ALB、APLNR、APOE、CRP、ECE1、EDN1、IL6、KNG1、NOS3、NTS、PRCP共12个节点组成;模块2(蓝色)由AGT、AGTR1、APLN、ATP6AP2、CYBB、CYP11B2、HIF1A、INS、NOX4、NR3C2、REN共11个节点构成;模块3(绿色)则由包括ACE2、ACHE、CAT、CMA1、DPP4、ENPEP、ERAP1、GHRL、IRS1、LNPEP、MME在内的11个节点构成(图3)。
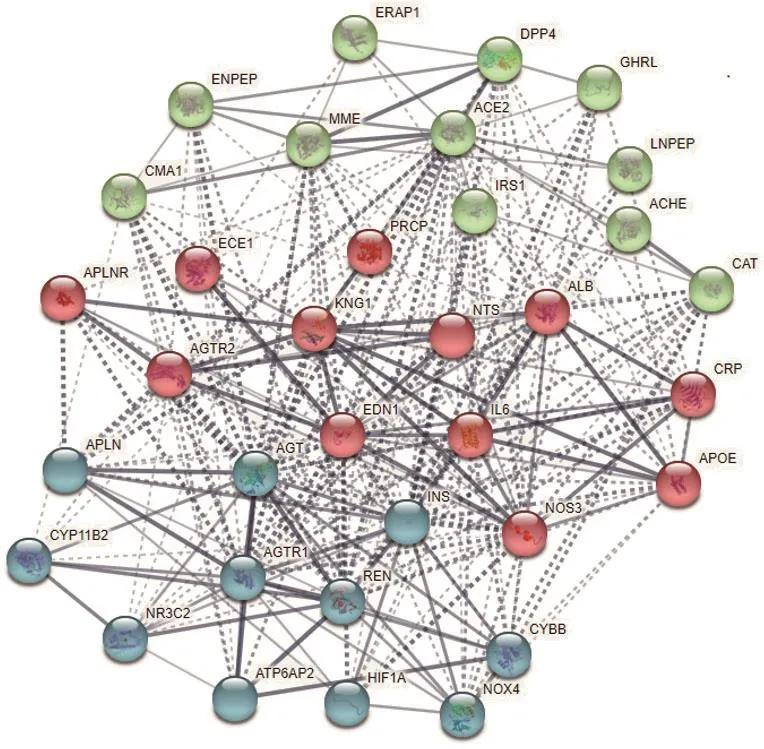
图3 ACE2直接相关蛋白功能模块
2.4 GO分析及KEGG通路富集结果将上述与ACE2蛋白关联紧密的三大模块涉及的靶点输入到Metascape数据库,物种设置为Homo sapiens,Min overlap设为3,p值截点设为0.01,Min Enrichment为1.5。结果发现,模块1主要涉及的生物学功能是管径调节,分子功能是受体调节子活性,细胞组分为内质网腔,主要富集的通路是神经活性配体受体相互作用;模块2主要涉及的生物学功能是激素水平调节,分子功能是外肽酶活性,细胞组分为脂筏,主要集中的通路是肾素-血管紧张素系统信号通路;而模块3主要涉及的生物学功能是内分泌过程,分子功能是激素活性,细胞组分是顶端细胞,主要涉及的通路是肾素-血管紧张素系统信号转导途径,表2。
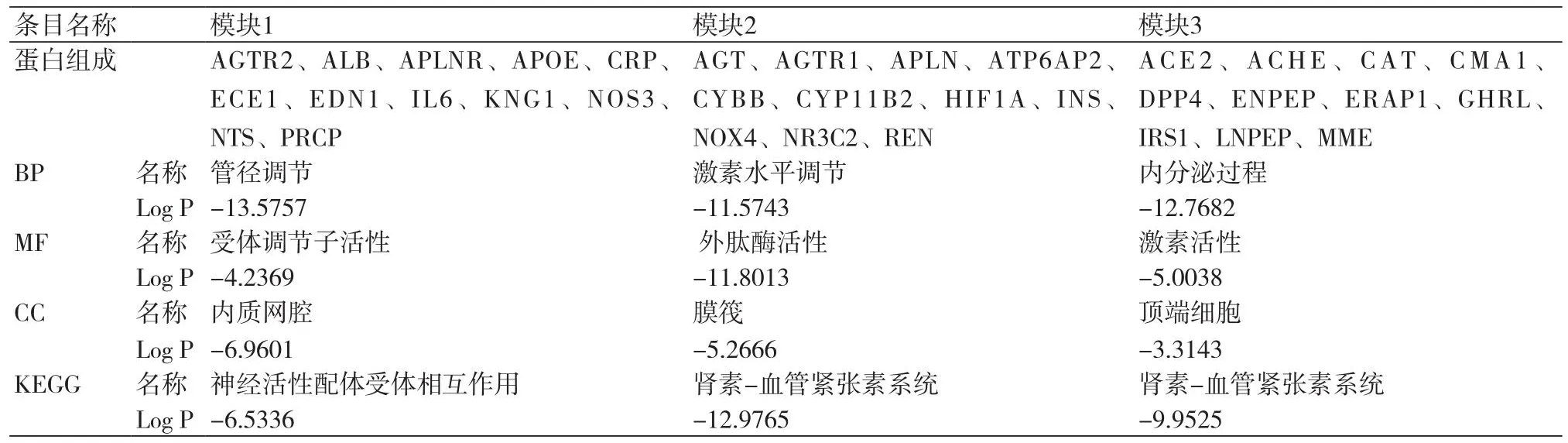
表2 各模块GO及KEGG分析结果
2.5 模块3的跨模块关联分析对ACE2所在的模块3进行跨模块关联分析发现,其一共存在184条跨模块关联,占据整体267条网络关联的68.9%,平均关联分数为0.709,中位数为0.704,如图4和表3;为进一步凸显跨模块关联网络中的关键蛋白节点,利用Cytoscape软件依照Degree值对涉及跨模块关联网络的各靶点进行排序,其中颜色透明度及节点的大小代表了靶点的重要性。由图5可知,AGT、AGTR1、ALB、INS、EDN1等是与ACE2所在的模块3形成的跨模块关联网络中占据主导作用的靶点,推测它们可能在跨模块关联网络中起到主要影响。
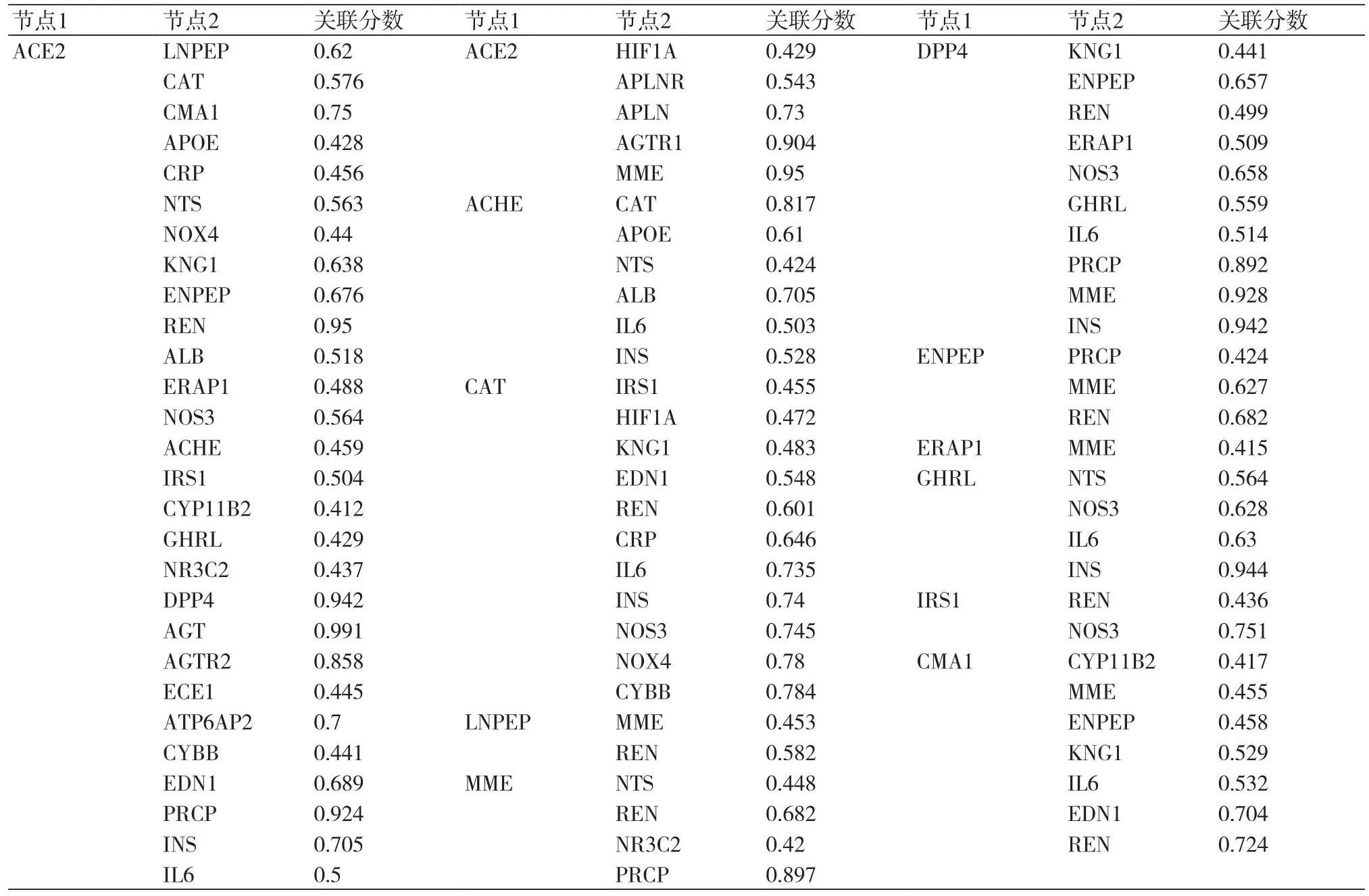
表3 ACE2所在模块3跨膜关联蛋白及关联分数
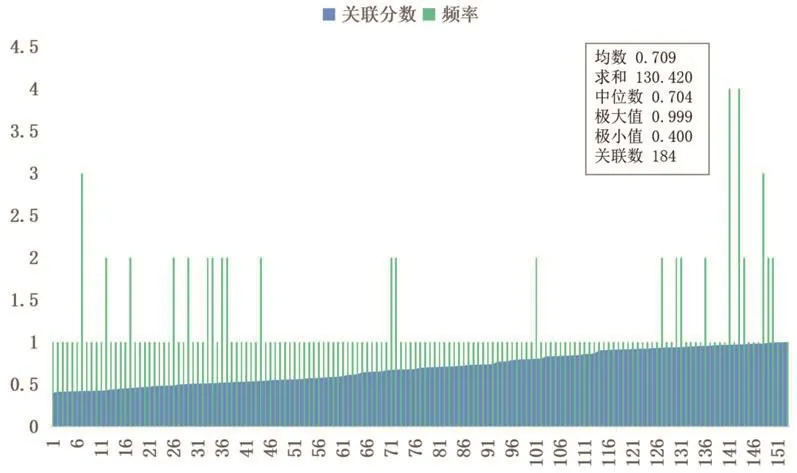
图4 模块3跨模块关联分析统计描述
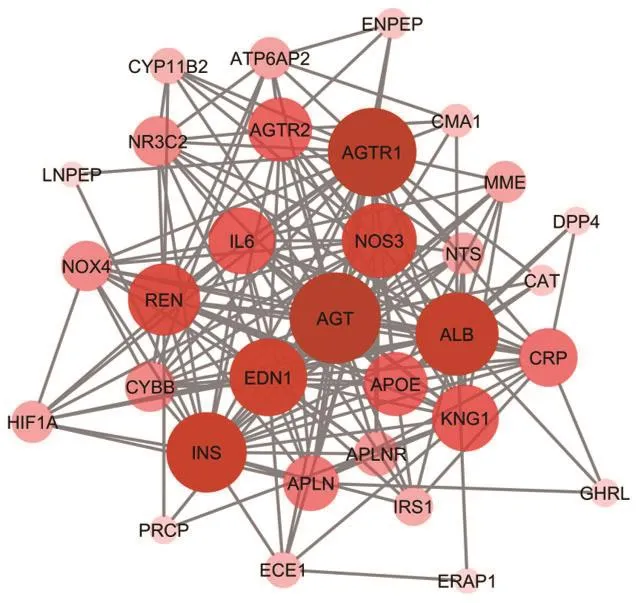
图5 跨模块关联网络中主要重要节点(Degree值排序)
2.6 模块3对整体网络的影响经对ACE2所在模块和模块3跨关联蛋白评分我们发现,ACE2所在的模块3中ACE2、CAT、DPP4、ACHE、CMA1所获得的评分最高;而在跨模块关联分析中则以AGT、AGTR1、EDN1、ALB以及AGTR2评分最高,表4。
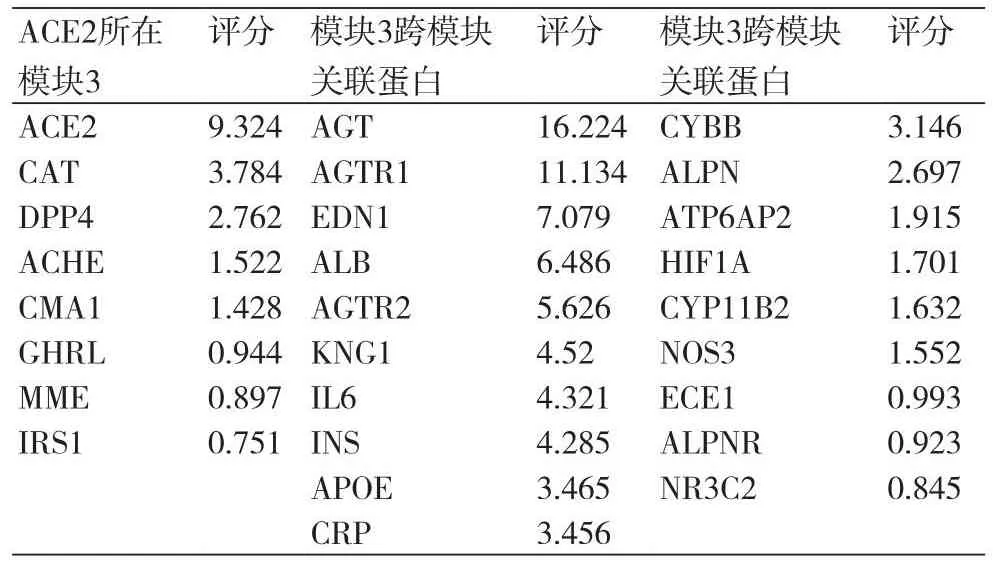
表4 ACE2所在模块3及跨模块蛋白评分
3 讨论
综上,我们发现与ACE2直接相关的33个靶点中,AGT、REN、MME、DPP4、PRCP以及AGTR1的关联分数排名靠前,且分值均高于0.9,说明上述6个蛋白与ACE2的关系最为紧密;其中AGT、REN二者degree值均为27,位列第一,degree值越高,提示其重要性越强,说明AGT、REN相较于其他4个蛋白而言,对于ACE2的影响作用地位更高、程度更深。AGT、REN、AGTR1三者均是RAS系统的重要组成部分。REN可将肝脏的AGT水解生成血管紧张素Ⅰ(AngⅠ),AngⅠ在肺血管紧张素转换酶(ACE)的作用下变成血管紧张素Ⅱ(AngⅡ),后者可与AGTR1结合,促进缩血管、炎症及水钠潴留,升高血压[1];ACE2、PRCP则主要起到降解AngⅡ、生成与之拮抗的Ang1-7的作用,PRCP缺如可引起独立于全身与局部AngⅡ和Ang1-7因素之外的血压升高与左室重构[2,3];而Ang1-7既可以通过结合血管内皮细胞表面的Mas受体激活促进NO介导的血管舒张、减轻氧化应激[4],同时还能非竞争式结合的方式抑制AGTR1的活性[5]。此外,MME是一种中性内肽酶,其抑制可增加利钠肽、缓激肽和P物质的生物利用度,产生利钠、血管扩张和抗增殖的作用[6];研究显示,增加MME活性可能有助于限制RAS中AngⅡ的血管收缩作用[7]。接着通过聚类分析,我们提取得到了3个不同功能但互相关联的核心蛋白模块,模块1主要涉及血管管径和神经活性配体受体相互作用的调节;模块2主要参与激素水平和肾素-血管紧张素系统(RAS)的调控;而ACE2所在的模块3则主要与内分泌和RAS调节有关。SARS-CoV-2是导致新型冠状病毒肺炎(COVID-19)感染的直接病原体;ACE2则是SARS-CoV-2其进入人体的重要门户,同时也是参与血管舒缩和高血压形成的关键调节因子。研究发现,SARS-CoV-2的侵袭可以导致肺组织中ACE2蛋白出现大规模降解与表达降低,继而激活RAS系统,引发细胞因子风暴,促进高血压形成或加重高血压进展[8,9];而常用降压药物ACEI和ARB的应用可增加心、肾组织ACE2的表达[10-12],使SARS-CoV-2更易于进入机体,进而增加感染机会。因此,将SARS-CoV-2受体ACE2作为核心节点探究其在高血压靶点关联网络中的地位和影响,有助于寻找和发现与单纯COVID-19出现潜在血压升高或COVID-19合并高血压紧密联系的核心靶点,同时为ACEI和ARB在上述患者人群中的应用提供部分理论参考和依据。
本研究中选择使用关联分数的均值与中位数联合剔选的方法对ACE2跨模块关联蛋白进行了筛选,并采用关联分数之和作为评价和判断蛋白重要性与影响力的标准,分数越高,关联越密切,对网络影响度越大。结果发现,ACE2所在的模块3中,除ACE2评分高达9.324外,CAT、DPP4、ACHE、CMA1评分较高且均分值均大于1,提示它们对其他蛋白模块的影响更大。首先,ACE2本身的多态性与高血压及SARS-CoV的易感性和产生的后果密切有关[13];其次,CAT启动子区多态性与原发性高血压关系密切[14],且过表达CAT能够有效阻止Akita小鼠模型高血压、肾间质纤维化并促进ACE2的表达正常化[15];而CAT缺乏使得对机体有害的过氧化氢水平升高,致使COVID-19患者固有免疫受到抑制出现细菌-病毒协同感染及肺损伤加重[16]。DPP4是一种丝氨酸蛋白酶,其可溶形式sDPP4对血管直接有毒害作用,可促进血管平滑肌增殖与炎症反应以及内皮功能紊乱[17,18];而DPP4/CD26可能与SARS-CoV-2的S1刺突蛋白结构域发生相互作用的继ACE2外有利于病毒入侵的另一重要门户,其抑制剂可能起到抵抗SARS-CoV-2的作用[19,20]。ACHE是参与乙酰胆碱(Ach)水解的限速酶,后者既参与介导内皮细胞释放NO引起血管舒张,同时也是参与外周交感信号调节的重要的兴奋性神经递质,并且胆碱能激动可能阻止SARS-CoV-2诱导的糖蛋白与ACh受体结合,减轻COVID-19临床症状和表现[21-23]。CMA1则是组织中非ACE转换生成AngⅡ的来源,在心脏和血管中高表达,参与血压升高并能激活转化生长因子β(TGF-β)参与组织炎症及纤维化过程;并且CMA1抑制剂的使用可能是代替RAS抑制剂而起到缓解COVID-19中AngⅡ和TGF-β不良反应的有效策略[24]。上述蛋白均与COVID-19和高血压同时关联,多数还与ACE2存在互相影响,提示对于这些节点的有效调控可能同时阻止SARS-CoV-2的侵袭和危害与血压升高。
而在跨模块关联分析中则以AGT、AGTR1、EDN1、ALB与AGTR2占据较高评分,提示模块3可能是通过上述关联蛋白进行对其他模块进行作用、彼此发生交互影响。AGT、AGTR1、EDN1、ALB与AGTR2可能是ACE2所在的模块3与其他模块产生作用的重要联络点。其中,EDN1在COVID-19患者体内随时间延长而水平升高[25],其在循环中的表达水平是反映高危COVID-19患者严重程度的潜在标志物[26];EDN1还是强大的具有调节血压功能的血管收缩肽,不仅与各种高血压动物模型血压升高紧密相关[27],更对RAS有多方面作用,如剂量性依赖地抑制REN合成、提高AGT表达[28]和下调ACE2[29]等。值得注意的是,AGT和AGTR1二者评分>10,体现它们可能是模块3与模块1和2发生生物学联系和作用的关键效应点,在介导SARS-CoV-2受体ACE2与高血压的发生发展中发挥了重要意义,同时也是连结COVID-19与高血压的关键分子信号桥梁。研究显示,SARS-CoV-2与SARS-CoV具有80%以上相似性。SARS-CoV感染时,肺中的ACE/AngⅡ/AT1R系统优势逐步转向ACE2/Ang1-7/mas受体系统优势,致使非竞争性AngⅡ积累、活化ATGR1而导致急性肺损伤。SARS-CoV-2也有类似作用,其通过刺突蛋白与ACE2结合实现与宿主细胞膜融合并进行胞内复制,致使ACE2表达下降、更多AGT被水解生成AngⅡ并激活ATGR1,引发肺损害[10];而ACE2敲除的实验小鼠其COVID-19发病率则大大降低[30]。此外,包括奥美沙坦、替米沙坦、氯沙坦以及赖诺普利在内的ACEI、ARB类降压药的使用被证实会增加高血压心肌肥厚、心肌梗死等动物模型以及正常大鼠心肌和肾脏血管中ACE2 mRNA或蛋白表达水平[31-34],但ARB和ACEIs对动物模型或人类肺ACE2表达的影响尚无数据[10],即使在动物模型中,ACE2水平的变化(如ARB诱导的上调)是否确实促进SARS-CoV和SARSCoV-2及其他病毒的侵袭仍有待系统验证。综上可知,SARS-CoV-2受体ACE2在高血压靶点中的网络关联影响重大,占据核心地位,其可通过作用于CAT、DPP4、ACHE、CMA1、EDN1等影响COVID-19和高血压进程。但其是否真正有利于SARS-CoV-2入侵,合并高血压的COVID-19人群使用ACEI和ARB又会否加重COVID-19病情尚需更多的大型临床试验加以验证。
本研究基于PPI网络滤选得到了与SARSCoV-2受体ACE2关系密切的高血压靶点及主要涉及功能模块,并探究了ACE2所在模块对整体蛋白网络的地位与影响,提出RAS失衡是引起单纯COVID-19患者发生血压升高或COVID-19合并高血压出现高致死率的关键所在,其通过与ACE2、CAT、ACHE、CMA1、EDN1等蛋白发生交互作用,参与加剧血管炎症与内皮损伤,升高血压,同时与COVID-19发病息息相关。但ACE2上调是否有助于COVID-19发病以及RAS抑制剂如ACEI、ARB类在合并高血压的COVID-19患者中是否适用或禁忌仍有待深入实验研究和阐明。
