α- 酮戊二酸对猪精子获能及抗氧化能力的影响
2023-05-17黄明光张钰欣李芳芳胡传活
黄 芳,黄明光,黄 涵,张钰欣,李芳芳,胡传活*
1.广西大学动物科技学院,南宁 530004;2.广西畜禽繁育与疾病防控重点实验室,南宁 530004;3.广西畜牧站,南宁 530022;4.广西大学生命科学与技术学院,南宁 530004;5.广西壮族自治区畜禽品种改良站,南宁 530001
精子进入雌性输卵管获得能够使卵子受精的能力的过程称为精子获能[1]。精子除了可以在体内获能外,在体外获能培养基中培养适当时间后也会发生获能反应。获能培养基中含有电解质和能量代谢产物(如葡萄糖、丙酮酸和乳酸),这些物质能够保证精子在运动过程中所需的高ATP 消耗[2]。正常生理过程中,低水平的活性氧(ROS)能介导与精子获能相关的信号转导过程,如精子过度激活、获能、顶体反应以及精子-卵母细胞结合等基本生理过程,而过量的ROS 会导致精子产生氧化应激,减少受精潜力以及配子正常胚胎发育的能力,甚至引起精子凋亡[3-4]。因此,缓解精子获能过程中的氧化应激损伤对维持体外获能的精子质量十分重要。
α-酮戊二酸(AKG)是三羧酸(TCA)循环中琥珀酰辅酶A 和异柠檬酸盐之间的重要中间体,且AKG 具有良好的溶解性,不表现出毒性,其水溶液具有很高的稳定性[5]。AKG 作为无氧反应的关键点,可转化为丙酮酸和乳酸,也可逆转TCA 循环产生柠檬酸,能调节ATP 的产生,在细胞能量代谢中起着至关重要的作用。除了已知的代谢作用外,AKG也是一种潜在的抗氧化剂,在促进ATP 产生的同时减少TCA 循环中的等效(NAD+/NADH)生成,从而降低ROS 的产生,维持免疫系统的稳态[6-7]。因此,本试验研究添加AKG 对猪获能精子糖代谢及抗氧化能力的影响,为体外获能试验模型提供理论和科学依据。
1 材料与方法
1.1 试验材料
从广西贵港秀博基因科技股份有限公司购买12 份性成熟长白猪精液样品,精子浓度为4.5×107个/mL,计算机辅助精子分析系统(CASA)检测活力不低于70%方可用于后续试验。精子获能培养液(BWW)购自上海吉美生物医药科技有限公司,精子活体染色试剂盒(伊红-苯胺黑法)购自北京Solarbio 有限公司,CASA 系统购自法国卡苏公司。ATP 含量、乳酸含量、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)测定试剂盒购自南京建成生物工程研究所。
1.2 精子获能处理
按照文献[8]所述,先将猪精液1 500 r/min 离心15 min 后弃去上清,用PBS 洗涤3 次。用BWW 获能液重悬精子,并调整精子浓度为5×106~10×106个/mL。取1 mL 处理好的精液加入10 μL 不同浓度的AKG(5、15、30、45、60 mmol/L)混匀(获能对照组添加相同体积的PBS)后置于5% CO2、95%空气的培养箱中37 ℃孵育2 h。
1.3 精子活率检测
按照说明书的操作步骤,取洁净小试管,滴加孵育完成的精子样本10 μL 和等量伊红染色液,混匀放置15 s,滴加苯胺黑染色液20 μL,混匀静置30 s。取精液-伊红-苯胺黑染色液10 μL 于载玻片上,制成涂片。晾干、镜检,活精子为白色,死精子呈红色,400 倍光学显微镜下观察,计算白色精子的百分比,每个样本至少计数200 条精子,试验重复3 次。
1.4 精子质膜完整性检测
根据谢运法等[9]的方法将孵育完成后的精子1 000 r/min 离心5 min,弃一部分上清,取100 μL精液置于37 ℃预热的低渗溶液中调整精子浓度为1×106个/mL,37 ℃孵育30 min。取20 μL 悬液于载玻片上,盖上盖玻片,400 倍光学显微镜下观察,计算尾巴卷曲的精子百分比。每个样本至少计数200,计算条精子,试验重复3 次。
1.5 顶体完整率检测试剂
按照文献[9]取100 μL 孵育完成后的精子于1 mL 3.7%多聚甲醛溶液中室温固定30 min,PBS洗涤1 次,加入500 μL 的PBS 制成悬液,取10 μL涂片,室温环境下自然干燥。将风干后的载玻片置于装有考马斯亮蓝的染色缸中染色5 min。用超纯水缓慢冲洗载玻片上的染色液,自然晾干后,用中性树胶封片。400 倍光学显微镜下观察精子顶体完整性(顶体呈均匀蓝色,且表面光滑,轮廓清晰的精子为顶体完整的精子),至少计数200 个精子,试验重复3 次。
1.6 精子动力学参数分析
根据文献[10]所述方法,提前将CASA 系统的载物台预热至37 ℃,取2 μL 的精液缓慢滴入一次性精子计数池中,通过调节不同的视野区域观察精子,记录精子活力及相应运动速率,至少采集500个精子用作分析,试验重复3 次。
研究评估的CASA 动力学参数包括:活力、曲线速度(VCL)、平均路径速度(VAP)、直线速度(VSL)、头部摆动幅度(ALH)、交叉运动频率(BCF)、摆动比例(WOB)、线性运动比例(LIN)、直线运动比例(STR)。
1.7 精子ATP 含量、乳酸含量、T-AOC、SOD、CAT 活力及MDA 含量的检测
各组精子用PBS 洗涤3 次后收集精子沉淀,按照试剂盒操作说明加入提取液,超声破碎精子后分别加入相应的检测液,用酶标仪和分光光度计测定精子的ATP 含量、乳酸含量、T-AOC、SOD、CAT 活力及MDA 含量。
1.8 统计分析
试验数据采用SPSS 23.0 统计学软件进行单因素方差分析(One-way ANOVA),以“平均值±标准差”表示,P<0.05 表示差异显著,P>0.05 表示差异不显著。用GraphPad Prism 8.0 软件绘图。
2 结果与分析
2.1 AKG 对获能猪精子活率、顶体完整率、质膜完整性的影响
由表1 可知,与新鲜精子相比,当精子获能后,精子的活率和质膜完整性显著下降。与获能对照组相比,添加不同浓度的AKG 获能组未对精子的活率和质膜完整性产生显著影响。新鲜精子组、获能对照组和添加AKG 获能组的顶体完整率之间无显著差异。
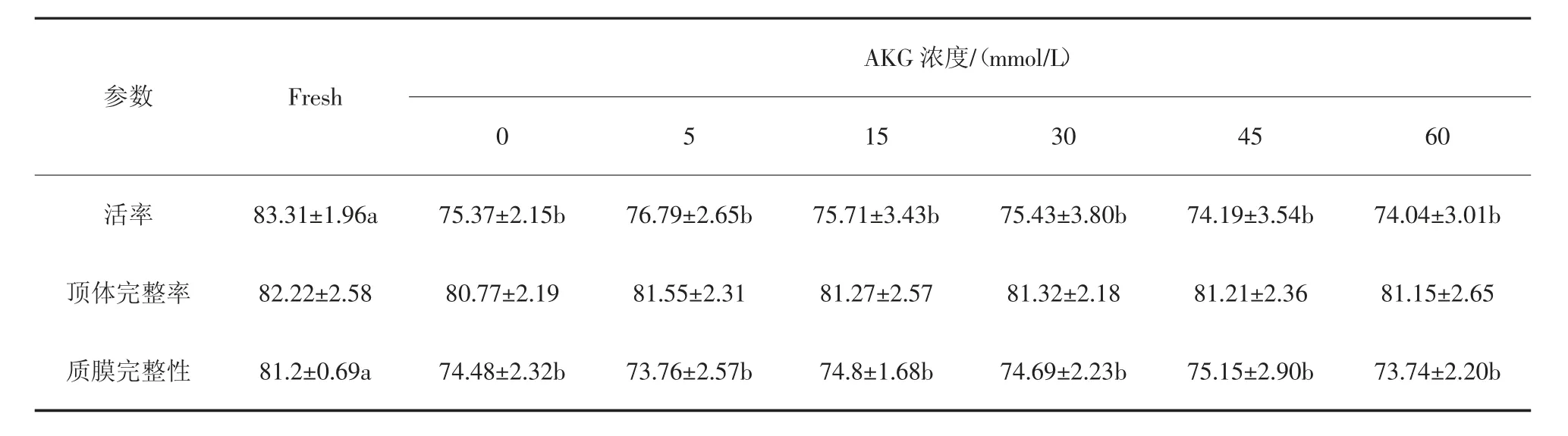
表1 AKG 对获能猪精子活率、顶体完整率、质膜完整性的影响(n=5) %
2.2 AKG 对获能猪精子动力学参数的影响
如表2 所示,与新鲜精子相比,获能后各组猪精子活力未发生显著变化。与新鲜组相比,获能后各组,除ALH 外,其余各项动力学参数均显著升高。其中,BCF、LIN、STR 在获能对照组中最高。AKG 浓度为5 mmol/L 时,WOB 最高;AKG 浓度为15 mmol/L时,VCL、VAP、VSL、ALH 最高。
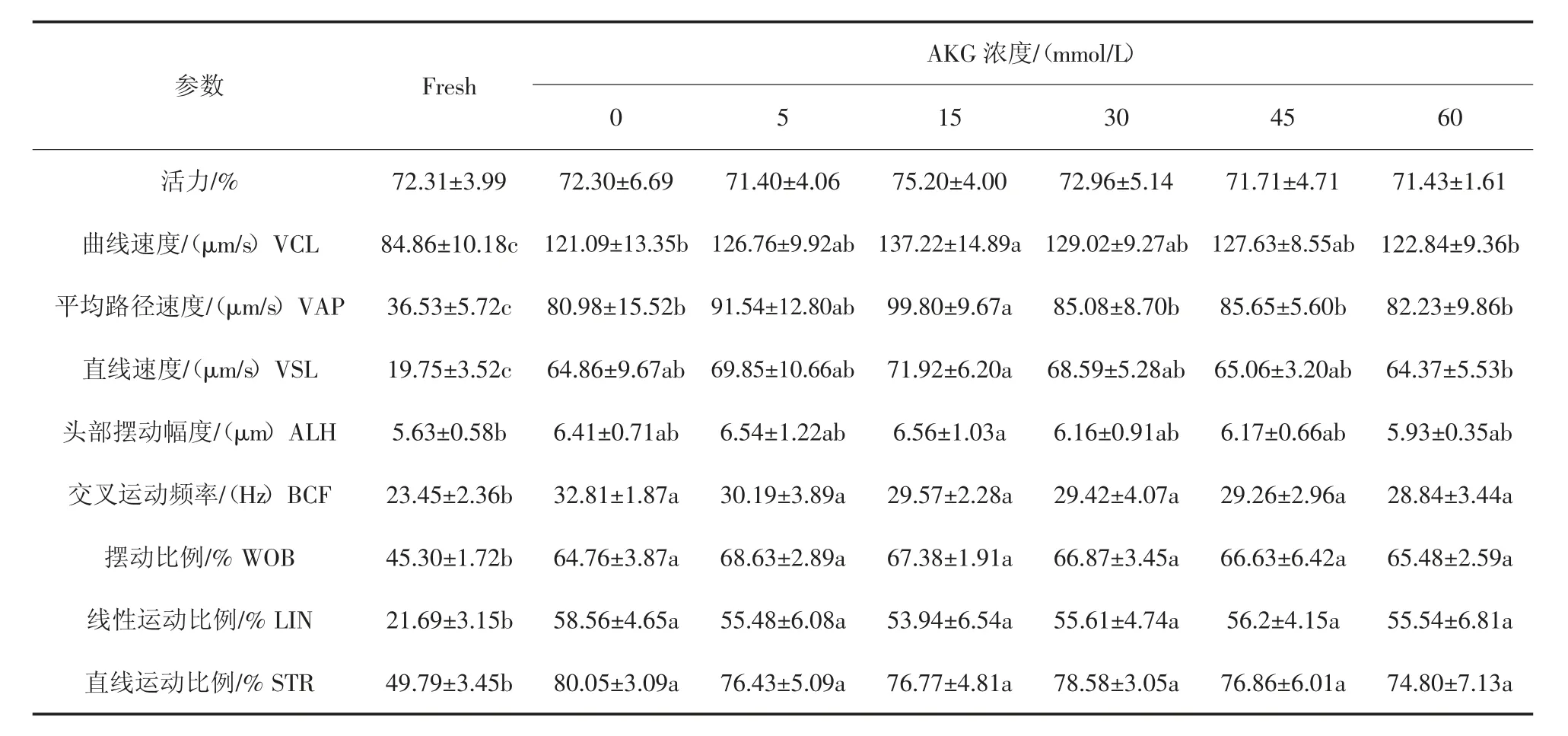
表2 AKG 对获能猪精子运动学参数的影响(n=5)
2.3 AKG 对获能猪精子能量代谢的影响
如图1 所示,与新鲜精子相比,获能后各组精子的ATP 和乳酸含量显著增加。与获能对照组相比,AKG 浓度超过5 mmol/L 时,ATP 含量显著增加,且AKG 浓度为15 mmol/L 时含量最高。获能AKG 处理组的乳酸含量均显著高于获能对照组,且AKG 浓度为15 mmol/L 时乳酸含量最高。

图1 AKG 对获能猪精子能量代谢的影响
2.4 AKG 对获能猪精子抗氧化能力的影响
本试验最适AKG 浓度为15 mmol/L,进一步测定最适浓度处理后抗氧化指标的变化(图2)。与新鲜精子相比,获能对照组精子的T-AOC 和SOD 活力未出现显著变化,CAT 活力显著降低,而MDA 含量显著升高。与获能对照组相比,15 mmol/L AKG获能组的T-AOC、SOD 活力和CAT 活力显著增加,同时MDA 含量显著降低。
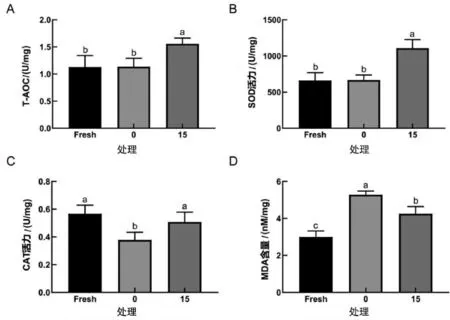
图2 AKG 对获能猪精子抗氧化能力的影响
3 讨 论
3.1 AKG 对获能猪精子的运动速率和能量代谢的影响
精子在获能和顶体反应的过程中会发生一系列变化,如膜的流动性增加和过度激活[11]。过度激活是精子运动的一种特殊状态,其特征是高振幅、鞭毛运动的增加及不对称、精子头部侧向移位增加以及非线性运动,是获能精子成功穿透透明带和受精所必需的[12]。过度激活的猪精子的运动速率依赖于氧化磷酸化,即需要线粒体产生大量的ATP。研究可见,AKG 通过促进能量代谢增加获能精子的运动速率,维持精子的过度激活状态。
3.2 AKG 对获能猪精子的表观指标和抗氧化能力的影响
精子在氧化磷酸化产生ATP 的过程中,通过位于质膜上的NADPH 氧化酶系统/线粒体NADH 依赖性氧化还原酶复合物产生ROS[13]。细胞内ROS 的浓度取决于ROS 的产生速率与各种抗氧化防御机制清除速率之间的平衡。当总抗氧化能力低于精子产生ROS 的能力时,就会出现氧化应激状态[14]。MDA 可以用作分析和监测影响精子的脂质过氧化损伤水平的重要生化标志物。精子质膜中多不饱和脂肪酸含量高,特别容易受到氧化产物的影响,导致膜通透性破坏[15]。研究结果表明,获能诱导产生的氧化物导致精子的活率及质膜完整性显著下降。
AKG 在清除生物体中的ROS 方面起着至关重要的作用。Velvizhi 等[16]研究表明,AKG 可以通过增加SOD、GSH-Px 和CAT 活性来防止脂质过氧化,以促进脂肪代谢,从而减轻乙醇诱导的肝毒性和醋酸铵诱导的大鼠高氨血症。研究发现,在AKG 的存在下,获能精子的T-AOC、SOD 和CAT 活力显著升高,MDA 显著下降,这与Velvizhi 等[16]研究结果一致。AKG 在促进获能精子产生大量的ATP 及乳酸的同时,并未导致活率及质膜完整性的进一步下降,说明AKG 导致过量生成的氧化代谢物被清除,使精子维持正常的获能生理状态。
在精子获能液中添加15 mmol/L AKG 可以显著提高精子的获能状态,并显著提高获能过程中的糖代谢及抗氧化能力。
