区分T1-2与T3-4期胃癌CT影像组学模型的建立与验证
2023-05-17王芷旋王霄霄卢超陆思远丁奕张久楼蒋鹏程单秀红
王芷旋, 王霄霄, 卢超, 陆思远, 丁奕, 张久楼, 蒋鹏程, 单秀红
(1. 江苏大学附属人民医院影像科,江苏 镇江 212002; 2. 南京医科大学影像学院人工智能影像实验室,江苏 南京 210029; 3. 江苏大学附属人民医院普外科,江苏 镇江 212002)
胃癌是常见的恶性消化道肿瘤,发病率占所有恶性肿瘤的第4位,是癌症所致死亡的第2大原因[1]。手术是目前治疗胃癌最有效的方法,晚期胃癌在术前采取新辅助化疗有助于提高手术切除率、改善预后[2-3]。中国临床肿瘤学会推荐T3-4期胃癌患者接受新辅助化疗[4]。术前准确识别胃癌患者的T分期,可筛选出适宜进行新辅助化疗的患者,提高治愈率。传统的影像学检查进行胃癌T分期不能满足临床精准诊疗的要求,一项Meta分析结果表明,CT进行准确胃癌T分期的敏感度为41%~61%,特异度为86%~97%[5]。影像组学突破传统影像学仅根据形态学诊断疾病的局限,通过高通量提取图像特征信息,发现肉眼无法识别的图像特征,大大提高了影像的诊断准确性[6]。在过去的研究中,影像组学已经被证明对胃癌的鉴别诊断、分型、淋巴结转移、腹膜转移预后判断等具有重要价值[7-13]。本研究旨在探讨CT影像组学特征对术前鉴别胃癌T1-2与T3-4期的价值,辅助临床精准决策。
1 资料与方法
1.1 病例收集
本研究通过了医院伦理审查委员会批准,收集了2011年12月至2019年12月共465例符合以下标准的病例。纳入标准:① 术前标准的腹部增强CT检查;② 组织病理学检查证实为胃癌且术后病理T分期明确。排除标准:① 术前接受了新辅助化疗;② 图像质量欠佳;③ 病理信息不全。将符合标准的患者采用分层抽样方法按照7 ∶3的比例分为训练集与测试集。
1.2 图像采集
采用西门子公司Siemens Sensation 64层及飞利浦Briliance 256层螺旋CT扫描仪行包括全胃的平扫及增强扫描。患者检查前禁食不少于4 h,检查前30 min肌注盐酸山莨菪碱20 mg,随后饮温开水800~1 200 mL。扫描参数:管电压120 kV,管电流220~250 mA,层厚0.625 mm或0.5 mm。患者取仰卧位,经肘静脉以流率3.0 mL/s、剂量1.5 mL/kg注射碘海醇(300 mg/mL)或碘克沙醇(320 mg/mL),分别于35 s、70 s行动脉期、静脉期扫描。
1.3 影像组学模型建立
1.3.1 感兴趣区(region of interest,ROI)分割 将所有符合要求的CT图像以DICOM格式导出,选择静脉期导入ITK-SNAP 3.6.0软件,由具有5年腹部影像学诊断经验的主治医师对肿瘤的最大层面进行手动分割,然后由主任医师对勾画好的结果进行校对,1个月后,从中随机抽取30例重新进行分割和校对(图1)。
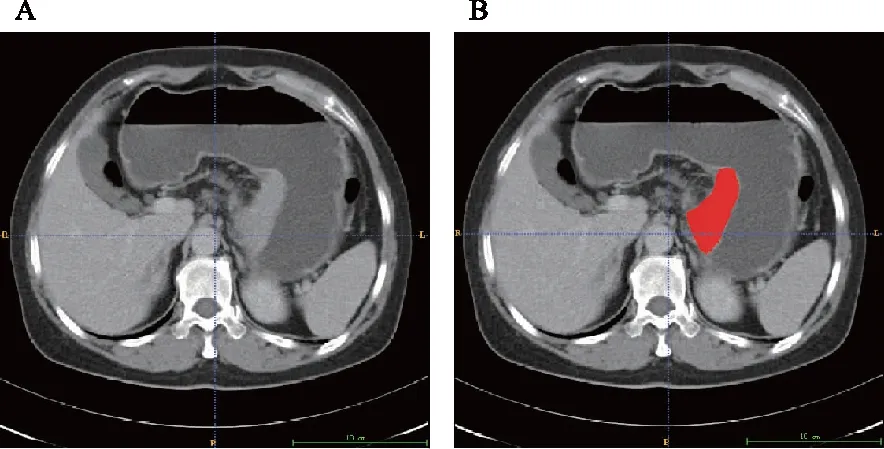
A:原图;B:带有肿瘤的最大层面ROI勾画图
1.3.2 特征提取 用Pyradiomics软件提取每例ROI中960个特征,包括以下类型:基于原图的形状特征14个、一阶特征18个、纹理特征68个,经Log变换后的一阶特征36个、纹理特征136个,以及经小波变换后的小波特征688个。
1.3.3 特征筛选 采用组内相关系数(intraclass correlation coefficient,ICC)对两次勾画的30例肿瘤ROI提取到的影像组学特征进行一致性评价,选择一致性良好(ICC>0.75)的特征。采用Mann-Whitney检验对特征参数进行初步降维。将患者的数据集采用分层抽样按照7 ∶3划分为训练集与测试集,并进行标准化预处理。最后,利用LASSO(least absolute shrinkage and selection operator)回归,以最小标准的10倍交叉验证法选择调整参数λ,筛选出与T分期相关的特征参数。
1.3.4 模型构建 对筛选得到的影像组学特征分别采用逻辑回归、支持向量机及决策树建立影像组学模型,通过对影像组学特征进行回归系数加权生成影像组学标签及可视化的瀑布图(图2)。使用单因素分析筛选出临床相关因素,构建临床特征模型。
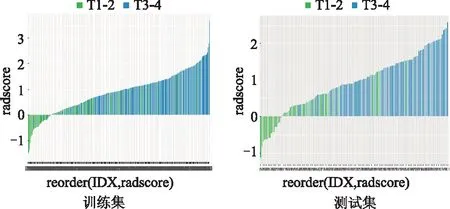
选取合适的截断值,影像组学评分高于截断值的归为T3-4期组(蓝色),影像组学评分低于截断值的归为T1-2期组(绿色),影像组学评分在两组间有明显的分布差异
1.4 联合影像组学标签及临床特征构建诺模图
比较T1-2与T3-4组患者的年龄、性别、肿瘤位置、CT-T分期、CT-N分期及Bormmann分型间的差异,将差异有统计学意义的临床特征与影像组学标签联合构建影像组学诺模图,再基于训练集和测试集中的数据生成校准曲线和决策曲线评估诺模图的预测能力。CT-T分期、CT-N分期根据美国癌症联合委员会和国际抗癌联盟联合更新并出版的第八版肿瘤TNM分期手册进行分期[14],由科室腹部组10年以上临床经验的4位副主任或主任医师集体阅片讨论后审核确认最终的影像分期。
1.5 统计学方法
应用SPSS 26.0软件进行不同T分期间的临床特征分析,其中,连续临床特征变量(年龄)采用t检验,分类变量(性别、肿瘤位置、CT-T分期、CT-N分期及Bormmann分型)采用χ2检验或Fisher精确概率法。R4.1.2软件进行影像组学特征数据的筛选降维,各个模型的效能评估,诺模图、校准曲线及决策曲线的绘制;受试者工作特征(ROC)曲线下面积(area under curve,AUC)用以评估影像组学模型、临床模型及影像组学诺模图的效能,校准曲线评估诺模图预测与实际病理结果的匹配性,决策曲线评价诺模图的临床净收益。P<0.05为差异有统计学意义。
2 结果
2.1 临床特征
收集的临床特征包括年龄、性别、肿瘤位置、CT-T分期、CT-N分期及Bormmann分型,统计结果表明,在训练集中CT-T分期、CT-N分期在T1-2和T3-4期患者中的分布差异有统计学意义,见表1。
2.2 影像组学特征的筛选
从960个特征中根据ICC>0.75选择出334个一致性良好的特征,采用Mann-Whitney检验初步筛选,得到245个特征。利用LASSO回归对这245个特征进行进一步的降维(图3),最终得到5个特征(表2),以此可计算影像组学特征标签radscore评分。
2.3 模型的构建与评估
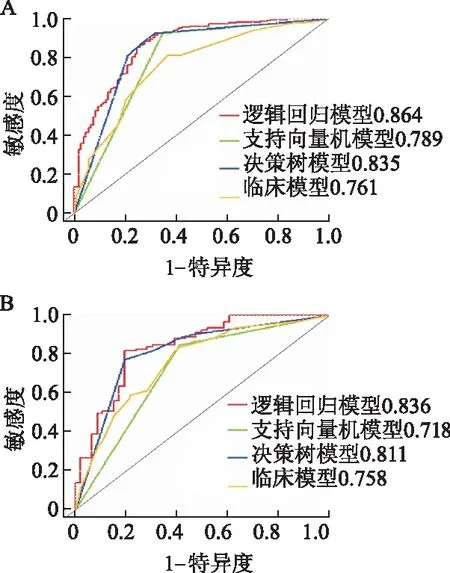
利用逻辑回归、支持向量机及决策树分别对5个影像组学特征建立影像组学模型。用CT-T分期和CT-N分期建立临床模型。通过ROC曲线对这4个模型区分T1-2与T3-4期的效能进行评估,结果显示,逻辑回归、支持向量机及决策树模型在训练集上的AUC值分别为0.864、0.789、0.835,在测试集上的AUC值分别为0.836、0.718、0.811;临床模型在训练集和测试集上的AUC值分别为0.761和0.758。见图4。其中,逻辑回归模型的预测效能最好。
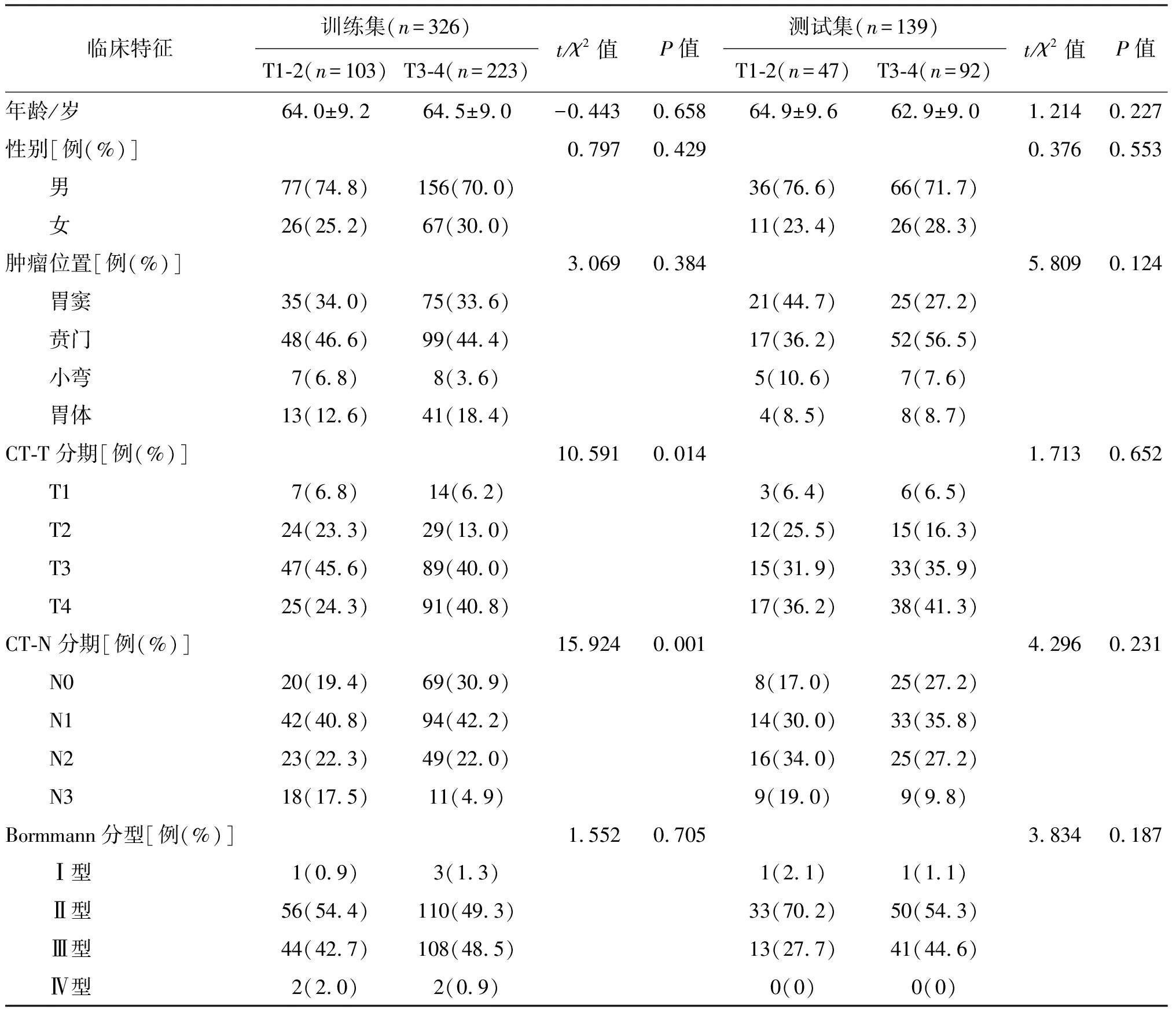
表1 训练集和测试集中T1-2与T3-4期患者临床特征比较
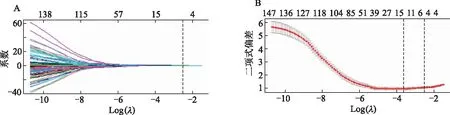
A:以最小标准的10倍交叉验证选择调整参数λ变化图;B:调整参数λ与LASSO筛选特征的变化图

表2 经LASSO回归最终筛选得到的5个影像组学特征
A:训练集;B:测试集
结合影像组学标签与CT-T分期、CT-N分期两个临床特征建立影像组学诺模图(图5),其在训练集与测试集上的AUC值分别为0.876、0.850(图6)。结果优于3种影像组学模型和临床模型,各模型预测性能见表3。
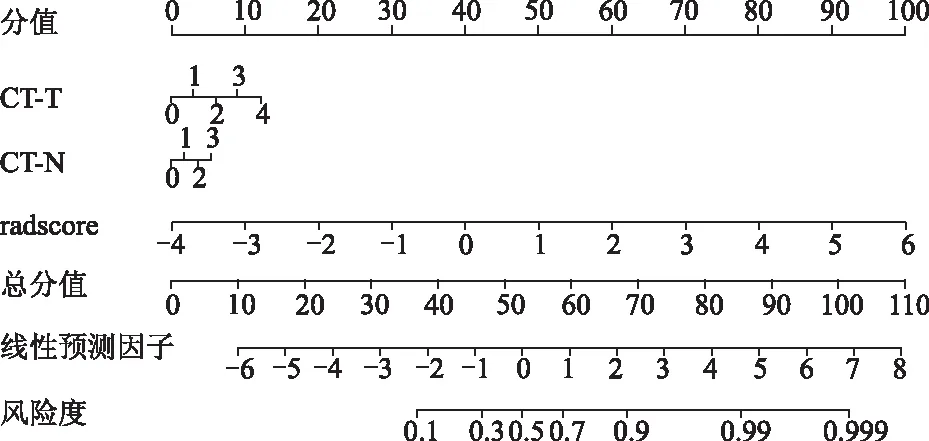
在影像组学标签、CT-T分期、CT-N分期横轴上分别进行定位,向上绘制一条垂直于分数值的垂线得到其分数值,对3个预测变量的分数值进行总和,再定位到总分值轴上,最后利用线性预测值对应到T3-4期风险度轴上,该风险系数反映了患者落在T3-4期的风险性
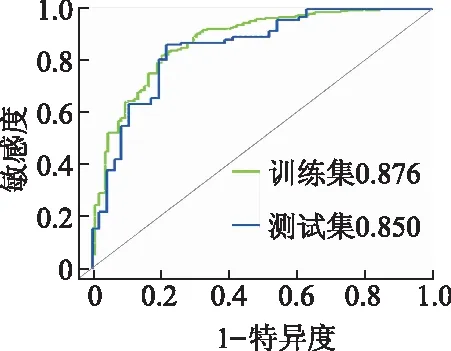
图6 影像组学诺模图区分T1-2和T3-4期的ROC曲线
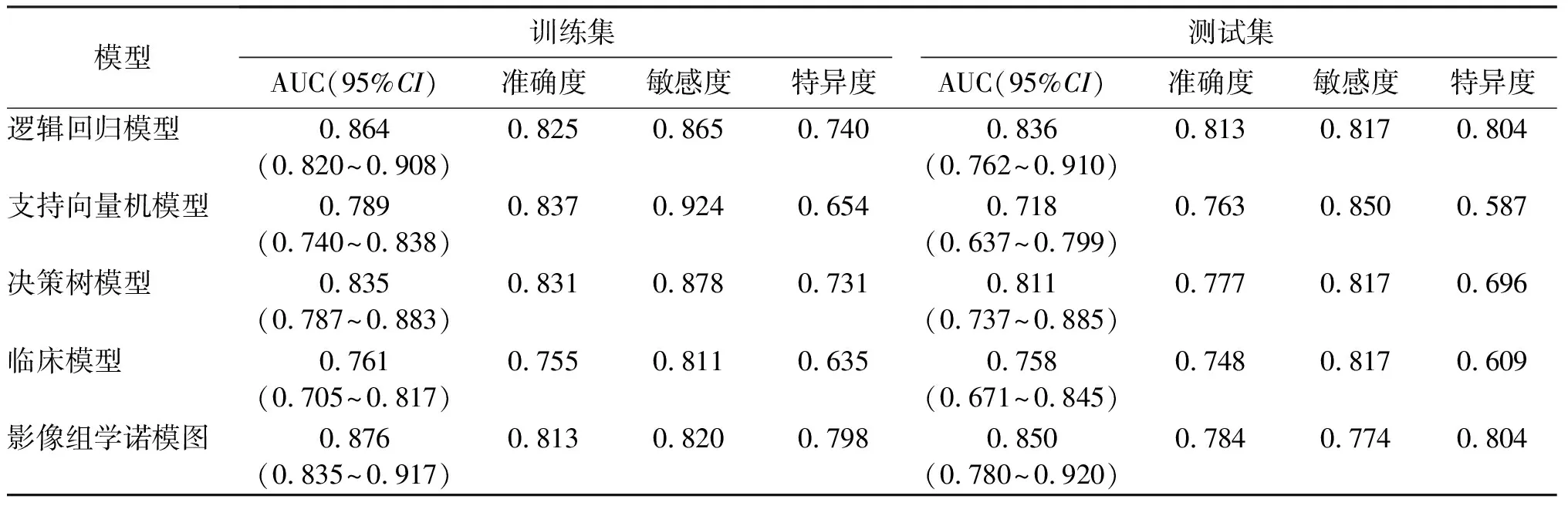
表3 训练集与测试集各模型预测性能比较
Delong检验比较逻辑回归模型与临床模型的预测效能(AUC值),结果显示在训练集中差异有统计学意义(P<0.01),而测试集中差异无统计学意义(P=0.058);诺模图与逻辑回归模型的AUC值比较,在训练集和测试集中差异均无统计学意义(P值分别为0.194、0.199)。
影像组学诺模图在训练集及测试集的校准曲线图显示,校准预测曲线与标准曲线贴合尚可,提示诺模图区分T1-2期和T3-4期胃癌的预测概率与实际概率具有良好的一致性(图7)。
决策曲线(图8)表明在风险阈值0.01~0.73时,采用影像组学诺模图对患者进行术前T分期预测指导治疗的临床净获益率最高。
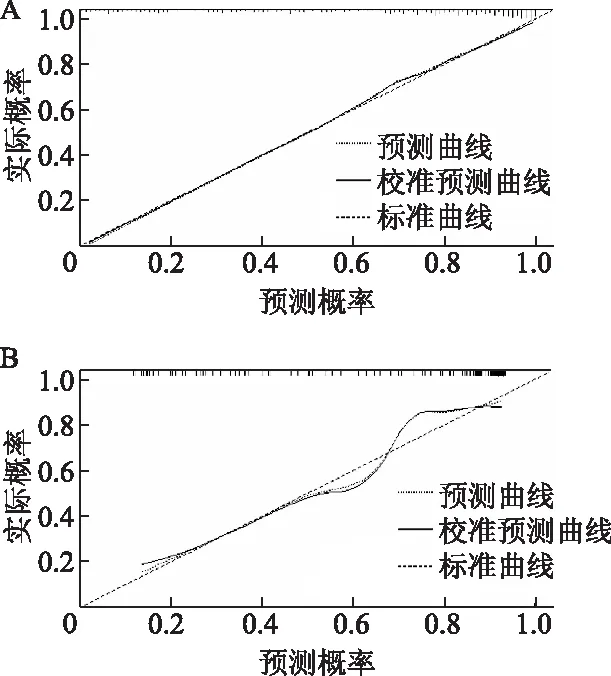
A:训练集;B:测试集
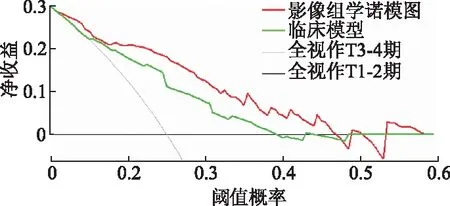
图8 诺模图及临床模型评估T分期的决策曲线
3 讨论
进展期胃癌患者术后总体生存率较低,部分患者可以通过术前新辅助化疗降低手术前的肿瘤分期,提高手术治愈率[15]。考虑到化疗带来的不良反应和经济负担,T1-2期胃癌患者不推荐接受新辅助化疗。临床上常采用CT、超声内镜、磁共振进行胃癌的T分期,超声内镜是局部取材的有创检查,具有一定的局限型;虽有研究表明磁共振用于胃癌T分期具有一定的优势,但考虑到不同型号磁共振成像设备性能差别很大,胃癌患者治疗前的磁共振检查并没有常规开展[16-17]。第八版美国国立综合癌症网络指南提出上腹部增强CT应作为胃癌TNM分期的主要影像学检查方法,规范的腹部增强CT作为胃癌患者治疗前的常规检查,方便易得。影像组学作为一种发掘图像背后隐藏信息的工具,可为临床诊疗提供更多有价值的信息。本研究结果表明利用逻辑回归、支持向量机和决策树三种方法建立的影像组学模型中,逻辑回归模型的预测效能最好,其中,逻辑回归和决策树模型预测胃癌T分期在训练集和测试集上的效能均高于由CT-T分期和CT-N分期建立的临床模型;支持向量机模型的预测效能在训练集上优于临床模型,而在测试集上低于临床模型。经统计分析,胃癌患者的年龄、性别、肿瘤位置及Bormmann分型区分T1-2和T3-4期相关性不高,而CT-T分期、CT-N分期明显相关。因此,最后诺模图融合的信息全来自CT图像,其相较于影像组学模型和临床模型均有所改进。
研究显示,胃癌的生长、侵袭和转移主要依赖于血管生成,动脉期可能主要反映胃癌的血供和功能性毛细血管密度,而静脉期可能反映更多功能失调的新生血管,并代表对比剂在间质空间中的分布[18]。因此,本研究选择对静脉期CT图像进行ROI的勾画和分析。
既往研究中,CT影像组学在预测胃癌T分期中的优势已经显现。Chang等[19]基于200例食管胃交界处腺癌患者的增强CT图像的影像组学标签radscore在T3和T4a期存在显著差异,联合影像组学标签与传统CT特征的诺模图区分二者的表现最好。本研究所纳入病例不仅包含食管胃交界处结合部,还包含胃体、胃窦部的胃癌。Liu等[20]发现CT纹理参数在不同的TNM分期胃癌患者具有显著差异,三个纹理特征区分T1和T2-4期胃癌的AUC值分别为0.810、0.752、0.822。T1期胃癌最深侵犯到黏膜下层,未侵犯肌层,胃壁不出现僵直表现,此外静脉期增强图像可见低强化肌层带与高强化癌肿分界明显,因此T1期与T2期以上相对容易鉴别,根据规范CT增强图像,影像医师并不难区分;本研究要鉴别的T1-2期和T3-4期的分界线是T2期与T3期,胃壁肌层都有侵犯,T3期有癌肿穿透肌层到达很薄的浆膜下结缔组织,在临床影像工作中,区分T2期与T3期比较难,因此本研究是基于中国临床肿瘤学会推荐的T3-4期胃癌患者接受新辅助化疗进行的分类,研究的目的是区分T1-2期和T3-4期胃癌患者以识别出适合接受新辅助化疗的患者。Wang等[21]对244例胃癌病例CT图像基于随机森林建立的影像组学模型有助于T2期和T3-4期胃癌的鉴别。本研究进一步扩大了样本量,采用465例胃癌患者的CT图像,并利用不同建模方法对影像组学特征建立评估胃癌T分期的影像组学模型,从而选择出预测效能更好的方法进行建模。本研究结果表明,结合影像组学标签及临床特征生成的影像组学诺模图预测效能优于3种影像组学模型和临床模型。校准曲线和决策曲线显示影像组学诺模图具有很好的模型适应性和临床实用性。
本研究存在以下不足:① 仅对静脉期CT图像的最大层面进行特征提取,可能没有瘤体全体积勾画涵盖的信息全面;② 仅对病例进行了T1-2和T3-4期分类,未来应进一步细化区分T分期;③ 本研究仅采用单一的机器学习方法,未涉及先进的深度学习算法,有待后续进一步探索。
综上所述,影像组学特征模型较常规临床特征模型用于区分T1-2与T3-4期胃癌以筛选出适合接受新辅助化疗的患者具有潜在优势;结合影像组学特征、CT-T分期、CT-N分期的诺模图可作为术前胃癌T分期的工具辅助临床精准诊疗的决策。
