核因子E2相关因子1过表达抑制宫颈癌细胞增殖及迁移
2023-05-17邹信芳刘琴陆荣柱
邹信芳, 刘琴, 陆荣柱
(1. 江苏大学医学院,江苏 镇江 212013; 2. 江苏大学附属昆山医院妇科,江苏 苏州 215300)
宫颈癌是最常见的妇科肿瘤疾病之一[1],2020年全球约有60.4万例新增病例,新增死亡病例34.2万例[2],随着宫颈癌防治“三阶梯”(宫颈癌筛查、阴道镜检查、组织学诊断)的推行以及手术根治疗法的开展[3],早期宫颈癌患者往往预后良好,但目前的治疗方案无法进一步改善晚期宫颈癌及复发性宫颈癌患者的预后及生存率。分子靶向治疗通过干预特定分子来阻断癌症的生长、发展和转移,已成为宫颈癌治疗的热点[4]。但是,肿瘤分子异质性阻碍了特异性分子靶向药物的疗效。
核因子E2相关因子1(nuclear factor erythroid 2-related factor 1,Nrf1)是CNC-bZIP家族中的成员,其与核因子E2相关因子2(Nrf2)结构相似,都能够与小Maf蛋白结合形成异源二聚体,进而与位于各种抗氧化基因启动子区域的抗氧化反应元件(antioxidant response element,ARE)结合,转录调控抗氧化反应[5]。目前对Nrf2的研究较为成熟,其具有强抗氧化作用,在卵巢癌中具有明显的抑癌作用[6]。另有研究指出,癌细胞在Nrf2持续激活的状态下表现出更强的恶性生长能力,该现象称为“Nrf2成瘾状态”[7]。这种状态的代谢特征是Nrf2促使癌细胞中谷胱甘肽合成增加,导致癌细胞抗氧化活性增强[8]。相较于Nrf2,Nrf1功能更广泛,可参与内质网应激、脂肪代谢和糖代谢等[9]多种生物学过程。此外,Barid等[10]研究发现,与正常小鼠相比,Nrf1特异性敲除的小鼠可诱发肝癌。在胰腺癌细胞中沉默Nrf1可导致癌细胞的增殖能力以及对化疗药物的耐药性增强[11];Weyburne等[12]则发现激活Nrf1可诱导乳腺癌细胞死亡。由此说明,Nrf1在肿瘤中具有一定的抑癌作用。但是,Nrf1在宫颈癌及其他恶性肿瘤中的表达及对癌细胞生物学功能的影响尚不清楚。
本研究通过TCGA数据库检索分析Nrf1在人宫颈癌组织及正常宫颈组织中的表达水平,及其表达水平差异与宫颈癌患者预后的相关性;在此基础上检测人宫颈癌及癌旁组织中Nrf1mRNA的表达水平,进而通过慢病毒转染,构建Nrf1过表达宫颈癌HeLa和SiHa细胞株,进一步验证过表达Nrf1对宫颈癌细胞的增殖及迁移能力的影响,初步探究Nrf1在宫颈癌中的表达及生物学功能。
1 材料与方法
1.1 标本来源、主要试剂及仪器
11对宫颈癌及癌旁组织均来自2019年江苏大学附属昆山医院妇科原发宫颈癌手术患者。癌旁组织系距离癌组织2 cm处的组织,所有组织部位均由专业病理科医师选取。本研究符合江苏大学附属昆山医院的伦理委员会相关规定,所有标本提供者均签署知情同意书。所有入组患者术前均未接受过放疗、新辅助化疗等可能影响癌灶性质的治疗。
宫颈癌HeLa、SiHa细胞株均购自中国科学院上海生命研究所。DMEM、BCA蛋白浓度测定试剂盒购自美国Thermo Fisher公司;胎牛血清购自美国Gibco公司;RNA提取试剂盒购自奕杉生物有限公司;逆转录试剂盒及SYBR Green染料购自康为世纪生物科技有限公司;所用引物均由锐博生物科技有限公司合成。Nrf1过表达慢病毒及空载体均购自上海吉凯基因有限公司。兔抗人Nrf1抗体购自华安生物科技有限公司;兔抗人GAPDH抗体购自美国Abcam公司;HRP标记的羊抗兔IgG购自碧云天生物技术公司;EdU试剂盒购自锐博生物科技有限公司;Transwell小室购自美国Corning公司。
1.2 基于网络数据库分析Nrf1 mRNA在人宫颈癌中的表达水平
在R软件(3.3.3版本)中利用ggplot2软件包整合TCGA数据库(http://gepia.cancer-pku/index.html)和GTEx数据库(https://www.genome.gov/Funded-Programs-Projects/Genotype-Tissue-Expression-Project)样本,分析Nrf1mRNA在人宫颈癌组织及正常宫颈组织中的表达水平。
利用OncoLnc网站(http://www.oncolnc.org/)中的宫颈癌数据集进行在线生存分析,筛选条件设置:“Gene:Nrf1”;“Cancer:CESE”;“Lower Percentile:50,Upper Percentile:50”,分析宫颈癌患者Nrf1mRNA表达水平与患者生存的关系,绘制Kaplan-Meier生存曲线。
1.3 qRT-PCR检测Nrf1 mRNA在人宫颈癌组织及癌旁组织中的表达
根据RNA提取试剂盒说明书提取11对宫颈癌及癌旁组织中的总RNA,用逆转录试剂盒将总RNA逆转录合成cDNA。按照试剂盒说明书配置20 μL qRT-PCR反应体系:8.4 μL DEPC水、10 μL 2×Ultra SYBR Mixture和上、下游引物各0.4 μL、0.8 μL cDNA加入8连管中。以cDNA为模板、GAPDH为内参进行qRT-PCR。qRT-PCR引物序列如下:Nrf1上游引物,5′-AGGAACACGGAGTGACCCAA-3′;Nrf1下游引物,5′-TATGCTCGGTGTAAGTAGCCA-3′;GAPDH上游引物,5′-AGGTCGGTGTGAACGGATT-3′;GAPDH下游引物,5′-GGGGTCGTTGATGGCAACA-3′。
qRT-PCR反应步骤如下:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火/延伸1 min,变性、退火/延伸共计40个循环,后接熔解曲线阶段:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。每孔设3个复孔,完成反应后得到各孔循环阈值(Ct)值,并采用2-ΔΔCt法计算目的基因相对表达。
1.4 细胞实验
1.4.1 细胞转染及分组 所用慢病毒载体原件均带有绿色荧光蛋白(green fluorescent protein,GFP)、嘌呤霉素抗性蛋白及flag标签蛋白。Nrf1过表达慢病毒及空载体的载体元件顺序如下:GV492;Ubi-MCS-3FLAG-CBh-gcGFP-IRES-puromycin。
将处于对数生长期的宫颈癌HeLa和SiHa细胞接种至6孔板内(105个/孔),当细胞融合度达40%~50%时进行慢病毒转染。每种细胞分为Nrf1过表达组和空载体对照组。慢病毒感染72 h后加入2 μg/mL嘌呤霉素筛选3 d。
1.4.2 qRT-PCR检测Nrf1mRNA表达 实验方法步骤同“1.3”,检测宫颈癌HeLa、SiHa细胞中Nrf1过表达组和空载体组Nrf1mRNA表达水平。
1.4.3 蛋白质免疫印迹实验检测Nrf1蛋白表达 将处于对数生长期的宫颈癌HeLa和SiHa细胞接种于6孔板内(105个/孔),于细胞培养箱内培养至细胞融合度达90%以上。PBS清洗细胞2遍;加入裂解液后至冰上反应30 min;收集细胞,4 ℃行12 000 r/min离心15 min;取上清液进行BCA蛋白定量;取蛋白样品100 ℃变性10 min;10% SDS-PAGE 80 V电泳90 min使蛋白按分子大小分离;300 mA转膜90 min将蛋白转至PVDF膜;10%脱脂奶粉封闭1 h;加入一抗(Nrf1 1 ∶1 000稀释,GAPDH 1 ∶5 000稀释)于4 ℃孵育过夜;TBST洗膜3次,每次5 min;二抗(1 ∶2 000稀释)室温孵育1 h;TBST洗膜3次,每次5 min;抗体结合检测采用化学发光(ECL)检测系统,Image J分析蛋白条带灰度值。
1.4.4 EdU实验检测细胞增殖 将对数生长期的宫颈癌HeLa细胞接种至24孔板内(3×104个/孔),72 h后用EdU培养基(50 μmol/L)孵育细胞2 h;4%多聚甲醛固定细胞20 min;0.5% Triton X-100孵育10 min(增强细胞膜稳定性);1×Apollo染色反应液避光摇床孵育30 min;1×Hoechst33342避光孵育30 min;倒置荧光显微镜下拍摄图片并计数荧光显像细胞。细胞增殖率(%)=EdU标记细胞数/Hoechst标记细胞数×100%。
1.4.5 细胞克隆形成实验检测细胞增殖 将对数生长期的宫颈癌HeLa和SiHa细胞接种于6孔板(103个/孔),37 ℃ 5%CO2培养箱内培养14 d;4%多聚甲醛固定20 min;PBS清洗2遍;2.5%结晶紫染液避光染色30 min;PBS充分清洗并晾干孔板;相位对比显微镜(日本Olympus公司)下随机选取>50个细胞的克隆细胞团并用Image J软件计数细胞。
1.4.6 Transwell细胞迁移实验检测细胞迁移 取24孔板,每孔加入含20%胎牛血清的培养基600 μL。放置Transwell小室于实验孔内,将处于对数生长期的宫颈癌HeLa和SiHa细胞用空培养基重悬,加入上层Transwell小室内(3×104个/孔),体积200 μL;37 ℃ 5%CO2细胞培养箱内培养细胞24 h;取出24孔板,PBS清洗小室2遍;4%多聚甲醛固定20 min;2.5%结晶紫染液避光染色20 min;PBS充分清洗并晾干小室,镜下观察小室并拍照,采用Image J软件分析细胞穿透小室的数目。
1.4.7 细胞划痕实验检测细胞迁移 将处于对数生长期的宫颈癌HeLa和SiHa细胞接种于6孔板内(105个/孔),当细胞融汇度达90%以上时,用10 μL移液枪枪头在孔内中央划直线;PBS清洗2遍洗去漂浮细胞;加入无血清空培养基,镜下观察划痕大小并拍照(0 h);37 ℃ 5%CO2培养细胞24 h后再次镜下拍照。采用Image J软件分析划痕后0 h及24 h的划痕愈合情况。划痕愈合率(%)=(0 h宽度-24 h宽度)/0 h宽度×100%。
1.5 统计学分析

2 结果
2.1 基于TCGA数据库分析Nrf1 mRNA在宫颈癌中的表达
基于数据库TCGA_GTEx-STAD的样本数据分析显示,宫颈癌组织中Nrf1mRNA相对表达水平明显低于正常宫颈组织(Z=3.86,P<0.01)。见图1。
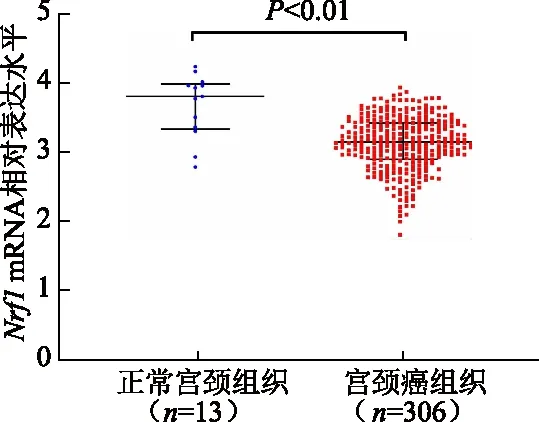
图1 正常宫颈组织和宫颈癌组织中Nrf1 mRNA相对表达水平比较
2.2 通过OncoLnc网站分析Nrf1 mRNA与宫颈癌患者预后的相关性
将OncoLnc网站数据中所有宫颈癌组织样本中Nrf1mRNA表达量较高的50%设为Nrf1高表达组(n=132),表达量较低的50%为Nrf1低表达组(n=132),绘制Kaplan-Meier曲线计算累积生存率。结果表明,随着时间推移,Nrf1高表达组生存率明显高于Nrf1低表达组(P<0.05),至随访结束时Nrf1低表达组累计生存率为28.6%,Nrf1高表达组累计生存率为59.6%。见图2。

图2 Nrf1 mRNA表达与宫颈癌患者预后的关系
2.3 人宫颈癌组织中Nrf1 mRNA表达水平
与癌旁组织相比,Nrf1mRNA在人宫颈癌组织中的表达水平显著降低(t=2.92,P<0.05),与TCGA数据库中分析的Nrf1mRNA在宫颈癌组织中的表达结果相一致(图3)。
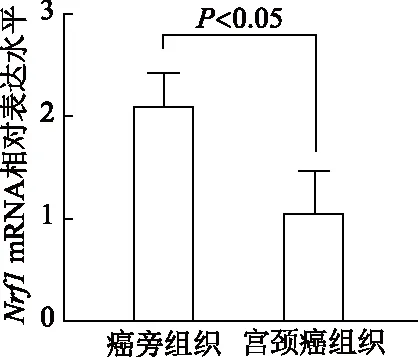
图3 Nrf1 mRNA在宫颈癌及癌旁组织中的相对表达水平比较
2.4 外源性过表达Nrf1
2.4.1 qRT-PCR验证转染效率 结果显示,在宫颈癌HeLa和SiHa细胞中,与空载体对照组相比,Nrf1过表达组Nrf1mRNA相对表达水平明显升高(t分别为2.88,2.73,P均<0.05)。见图4。
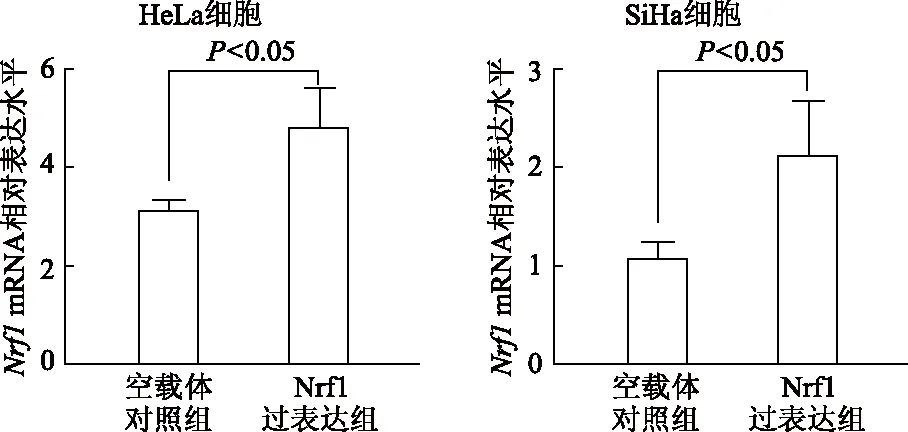
图4 qRT-PCR检测各组宫颈癌HeLa和SiHa细胞中Nrf1 mRNA表达水平
2.4.2 蛋白质免疫印迹实验验证转染效率 结果显示,在宫颈癌HeLa和SiHa细胞中,与空载体对照组相比,Nrf1过表达组Nrf1蛋白表达水平明显升高(t=2.81,P<0.05;t=4.58,P<0.01)。见图5。
2.5 外源性过表达Nrf1抑制宫颈癌细胞的增殖能力
2.5.1 EdU细胞增殖实验 与空载体对照组相比,宫颈癌HeLa细胞中Nrf1过表达组细胞增殖能力明显降低(t=4.43,P<0.01)。见图6。
2.5.2 细胞克隆形成实验 在宫颈癌HeLa和SiHa细胞中,与空载体对照组相比,Nrf1过表达组克隆细胞团个数明显减少(t分别为4.92,5.70,P均<0.01)。见图7。
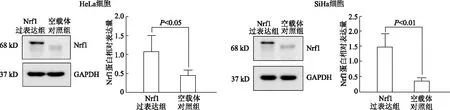
图5 蛋白质免疫印迹检测各组宫颈癌HeLa和SiHa细胞中Nrf1蛋白相对表达
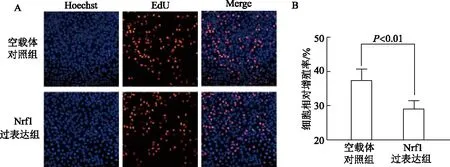
A:HeLa细胞中Hoechst及EdU的标记情况,比例尺=100 μm;B:EdU细胞增殖实验检测细胞增殖率
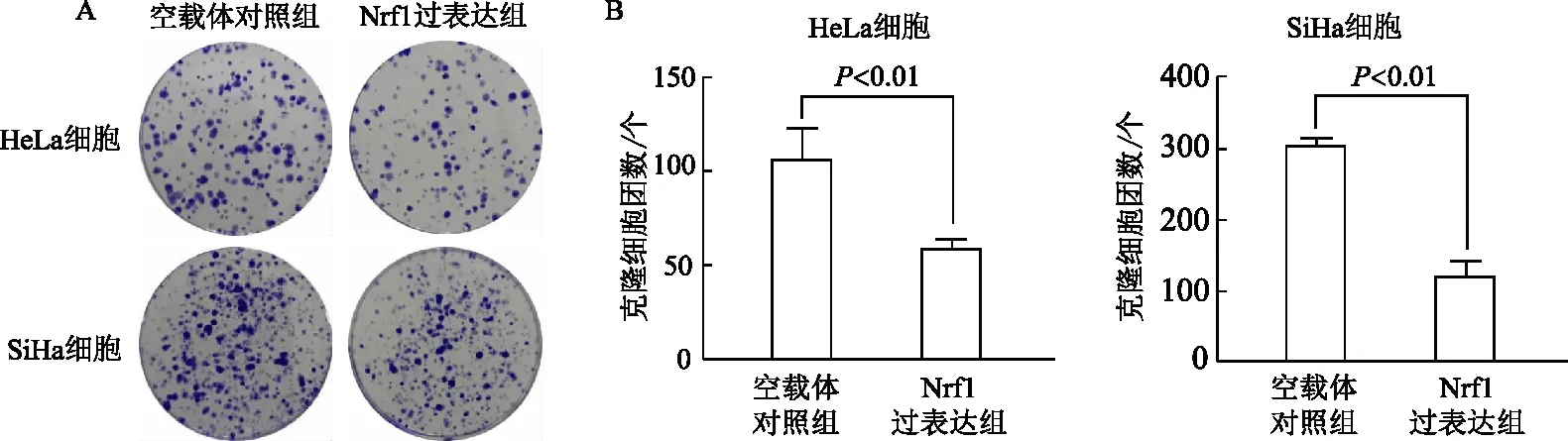
A:宫颈癌HeLa及SiHa细胞中克隆细胞团形成情况;B:克隆细胞团个数
2.6 外源性过表达Nrf1显著抑制宫颈癌HeLa和SiHa细胞的迁移能力
2.6.1 Transwell细胞迁移实验 在宫颈癌HeLa和SiHa细胞中,与空载体对照组相比,Nrf1过表达组细胞迁移数明显减少(t分别为2.82,3.54,P均<0.05)。见图8。
2.6.2 细胞划痕愈合实验 在宫颈癌HeLa和SiHa细胞中,与空载体对照组相比,Nrf1过表达组细胞划痕愈合率明显降低(t分别为8.52,6.52,P均<0.05)。见图9。
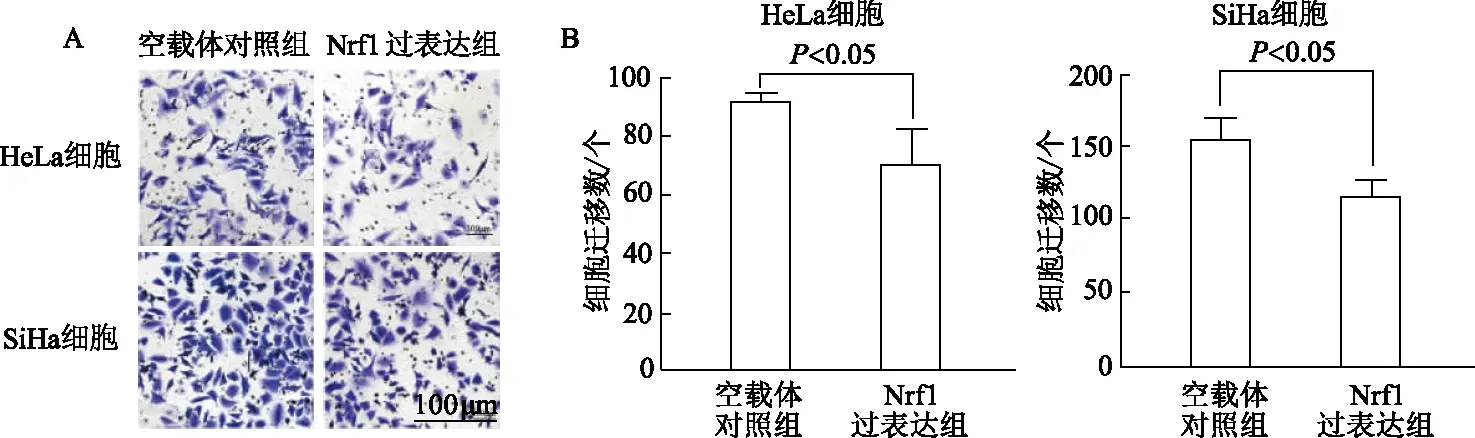
A:宫颈癌HeLa及SiHa细胞迁移情况,比例尺=100 μm;B:细胞迁移数
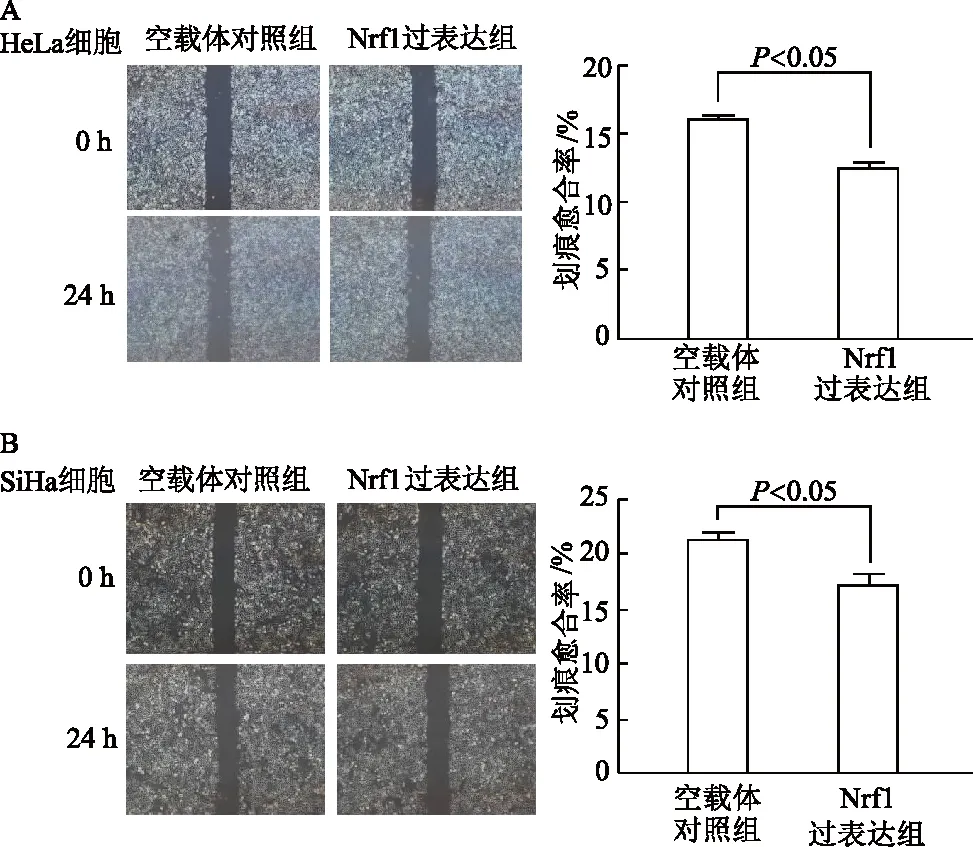
A:宫颈癌HeLa细胞划痕实验;B:宫颈癌SiHa细胞划痕实验;比例尺=200 μm
3 讨论
以往研究发现,Nrf1在肝癌组织中的表达显著低于正常肝组织,并且Nrf1表达水平与肝癌的恶性程度呈负相关[13]。本研究经TCGA数据库分析显示,宫颈癌组织中Nrf1mRNA相对表达水平明显低于正常宫颈组织;此外,宫颈癌组织中Nrf1mRNA表达水平显著低于癌旁组织,由此表明Nrf1在宫颈癌组织中呈低表达,其在宫颈癌发生发展过程中具有抑癌潜能。
既往有临床研究指出,Nrf1可作为黑色素瘤[14]及弥漫性大B细胞淋巴瘤[15]患者的预后指标。本研究基于OncoLnc网站数据,构建Kaplan-Meier生存曲线,发现Nrf1高表达组患者生存率明显高于Nrf1低表达组,表明Nrf1表达水平与宫颈癌患者预后呈正相关,由此提示Nrf1具有作为宫颈癌患者预后指标的可能。当然,这一结论仍然需要更多的临床样本数据来支持。Ren等[13]研究发现,在肝癌HepG2细胞中特异性敲除Nrf1α(Nrf1的一种亚基)后,肝癌细胞增殖和迁移能力明显增强,这可能与其能够通过Wnt/β-catenin通路介导肿瘤细胞的上皮间质转化行为有关[16]。本研究采用宫颈腺癌HeLa细胞及宫颈鳞癌SiHa细胞进行细胞实验,以研究过表达Nrf1对不同病理类型宫颈癌细胞的生物学功能的影响,结果显示过表达Nrf1可抑制宫颈癌HeLa及SiHa细胞的增殖和迁移,进一步证实了Nrf1的抑癌作用。
以往的研究多集中于Nrf1作为转录因子和药物作用靶点,缺乏关于Nrf1在疾病模型(包括肿瘤)中独立生物学作用的研究。本研究探讨了Nrf1在宫颈癌中的表达和对宫颈癌细胞的生物学作用。但是,本研究也存在不足之处,仅采用一种基因干预方式,即外源性过表达Nrf1,没有进一步通过shRNA敲低、CRISPR-CAS 9敲除等方式反向验证结果。并且在进行EdU实验时,因SiHa细胞染料附着能力欠佳,经多次调整实验操作仍未得到理想染色状态,故仅采用了HeLa细胞,后续可采用其他多种宫颈癌细胞完善实验。此外,有待利用转录本测序、蛋白基因组学分析进一步探讨Nrf1在人宫颈癌细胞中的作用及分子机制,并在此基础上结合体内(动物实验)及体外(细胞系以及宫颈癌原代细胞株)系统探究Nrf1在人宫颈癌中的生物学功能。
综上所述,本研究发现Nrf1在人宫颈癌组织中呈低表达,外源性过表达Nrf1可抑制宫颈癌细胞的增殖及迁移能力。
