2010—2018年北京市人体中六溴环十二烷的残留特征与风险评估
2023-05-16李玉芳佟玲徐进力白金峰宋淑玲
李玉芳, 佟玲, 徐进力, 白金峰, 宋淑玲
(1.中国地质科学院地球物理地球化学勘查研究所, 河北 廊坊 065000;2.国家地质实验测试中心, 北京 100037;3.中国地质调查局自然资源综合调查指挥中心, 北京 100055)
六溴环十二烷(HBCDs),分子式为C12H18Br6,是一种典型的溴系阻燃剂(BFRs),被广泛应用于聚苯乙烯泡沫塑料、保温建筑材料、室内装潢纺织品及电子产品中[1-2]。市售商品中的HBCDs主要包括3种非对映异构体,分别是α-HBCD (10%~13%)、β-HBCD(1%~12%)、γ-HBCD (75%~89%)[3]。由于HBCDs是一种添加型BFRs,极易从产品释放到环境中,目前在全球的各类环境及生物样品中,如水体、土壤、灰尘、沉积物、鱼体和其他哺乳动物样品中均被检出。HBCDs在2013年被列为持久性有机污染物(POPs)[4],具有持久性、长距离迁移性、生物累积性及多种生物毒性,包括细胞毒性[1,5]、神经毒性[6]、肝脏毒性[7]、内分泌毒性[8-9]以及生殖发育毒性[10]等,且研究表明不同异构体对生物体的毒性也存在差异[11]。随着人们对HBCDs环境行为以及毒性研究的深入,HBCDs也被认定为新一代的不安全因素[12],因此,开展人体中HBCDs的残留水平及健康风险研究极为必要。
人体主要通过饮食、灰尘、空气等途径摄入或吸入HBCDs[12],对于婴幼儿来说,母乳可能是其暴露于HBCDs的主要途径。自20世纪90年代起,国内外开始对人体中HBCDs暴露水平开展研究,在人体血清、母乳、头发、脂肪组织中均检测到HBCDs,其中母乳作为一种非侵入性的生物样品,是一种评估人体内HBCDs暴露的良好介质[13],被广泛用于各国人群特别是婴幼儿的HBCDs暴露水平研究。但中国对于人体中HBCDs暴露水平的研究较少,各地区的调查数据不足。现有的研究表明,中国2011年全国性母乳中HBCDs调查的浓度中值为6.83ng/g lw,显著高于2007年的全国性调查数据(0.94ng/g lw)[14-15];同时北京市2014年母乳中HBCDs的浓度(5.67ng/g lw)也高于2011年的水平(2.4ng/g lw)[13,16]。有调查发现,中国自2016年HBCDs限用、限产以来,北京市HBCDs的生产和使用量仍然有上涨趋势,2019年HBCDs的使用总量比2018年增加60.8%[17],因此北京市在近几年,尤其在HBCDs限用限产前后,母乳中HBCDs的残留特征和变化趋势备受关注。
因此,本文连续采集了北京市2010—2018年233份母乳样品,采用高效液相色谱-质谱联用仪(LC-MS/MS)对其中HBCDs残留水平进行分析,初步探索北京市母乳中HBCDs残留特征与变化趋势,同时计算和评估婴幼儿通过母乳喂养摄入HBCDs是否存在健康风险,从而为HBCDs科学使用、管理、控制和人体暴露风险评价提供基础数据支持。
1 实验方法
1.1 样品采集
为了研究2016年中国限用、限产HBCDs前后,北京地区母乳中HBCDs残留特征,项目组自2010—2018年,分别在北京的海淀区、朝阳区、丰台区、东城区、西城区、石景山区和昌平区等共12个辖区招募85名志愿者,共采集233份母乳样品(同一个志愿者的多个样品按独立样品处理)。每份样品量大约30mL,经志愿者手动采集到30mL洁净、具有聚四氟乙烯内衬螺纹盖的玻璃瓶中,然后转移至实验室冰箱-20℃低温冷冻保存。采样前每位志愿者被告知研究目的和样品用途,并签写知情同意书和调查问卷。所有的志愿者均常年居住北京5年以上,身体健康,且不抽烟,不直接从事与HBCDs生产、加工等相关职业。
志愿者的详细信息见表1。

表1 志愿者与母乳样品数量信息
1.2 主要材料和试剂
HBCDs标准溶液:α-HBCD、β-HBCD、γ-HBCD单体,纯度均>99%,100μg/mL,溶于甲苯中(购自AccuStandard,USA);稳定碳同位素标记的HBCDs标准溶液作回收率指示物:13C-α、β、γ-HBCD单体,纯度均>99%,100μg/mL,溶于甲苯中(购自Cambridge Isotope Laboratories,USA);稳定氘同位素标记的HBCDs标准溶液作内标:D18-α、β、γ-HBCD单体,纯度均>99%,100μg/mL,溶于甲苯中(购自Wellington Laboratories,Canada)。
正己烷、乙醇、丙酮和甲醇(农残级,4L),购自北京J&K百灵威科技;乙醚(HPLC级,4L),购自Honeywell,USA;浓硫酸(优级纯,500mL),购自北京化工厂;氨水,购自ThermoFisher公司,USA;无水硫酸钠(分析纯),购自国药集团化学试剂公司,使用前在马弗炉中450℃灼烧6h;硅胶固相萃取柱:1g,6mL(Agilent,USA);离心管15mL(安谱,中国上海);离心管1.5mL(AXYGEN,美国);空白及空白加标的基质样品:中国伊利纯牛奶(购自超市),脂肪含量38g/L。
1.3 样品提取与净化
采用液液萃取法(LLE)提取样品中的HBCDs,浓硫酸磺化和固相萃取法(SPE)结合完成样品中基质共提物的净化[14,16,18-19],具体方法如下。
准确量取10mL母乳于125mL玻璃分液漏斗中,加入10ng回收率指示物(13C-α、β、γ-HBCD混合标准溶液)。依次加入氨水5mL、乙醇10mL使得样品中的蛋白质变性、沉淀,随后加入乙醚15mL和正己烷25mL,充分振摇提取,静置分层后收集上层有机相。下层水相按照上述步骤重复提取一次,合并两次提取液经无水硫酸钠除水后,氮吹浓缩至近干。然后转移至称量瓶中恒重,称量脂肪质量。
恒重后的脂肪用正己烷复溶,并准确定容至4mL棕色具盖玻璃瓶中。准确移取2mL转移至15mL离心管,缓慢滴加入浓硫酸、小心振荡、注意散热和排气,直至上层溶液澄清透明(约6mL),涡旋离心,取出上层有机相。硫酸相中加入2mL正己烷洗涤,重复涡旋和离心,将两次净化后的上层溶液合并,经无水硫酸钠除水后,氮吹浓缩至1mL。
经浓硫酸磺化后的有机相溶液采用SPE法净化,方法如下:6mL正己烷活化SPE柱后,将上述样品溶液无损上柱,依次加入12mL正己烷淋洗,6mL丙酮洗脱并接收至玻璃离心管中,氮吹至干。加入200μL甲醇复溶和定容(甲醇内含有25μg/L的D18-α、β、γ-HBCD混合标准溶液),静置、超声、涡旋2min后转移至1.5mL离心管,以12000r/min离心8min,取上层溶液转移至棕色样品瓶中(含内衬管)保存。
1.4 仪器条件
液相色谱-质谱联用仪(LC-MS)目前是分析HBCDs的主要仪器。本研究使用Waters UPLC CLASS超高效液相串联API 4000三重四极杆质谱对HBCDs的3种非对映异构体进行定性和定量分析,具体的色谱条件及质谱条件如下[18,20]。
色谱条件:液相色谱柱为Agilent Poroshell 120 EC-C18(3mm×100mm,2.7μm),柱温40℃,进样体积10μL,流速500μL/min,流动相A相为甲醇,B相为超纯水,梯度洗脱程序见表2。
质谱条件:采用电喷雾离子源(ESI),负离子电离模式,多反应监测采集模式(MRM)进行检测;HBCDs的监测离子,m/z640.7→78.9和m/z640.7→80.9;13C-HBCD的监测离子,m/z652.6→78.9和m/z652.6→80.9;D18-HBCD的监测离子,m/z657.7→78.9和m/z657.7→80.9;其他质谱参数参照表3。采用Analyst1.6.3软件采集和分析数据。
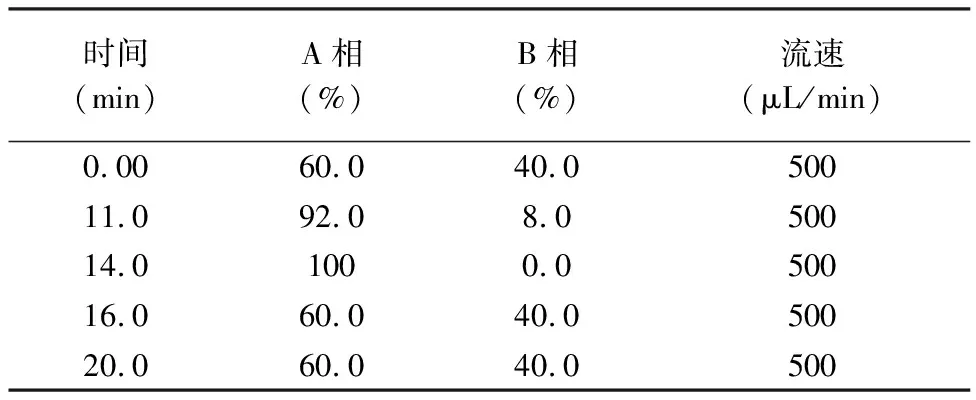
表2 液相色谱梯度洗脱程序
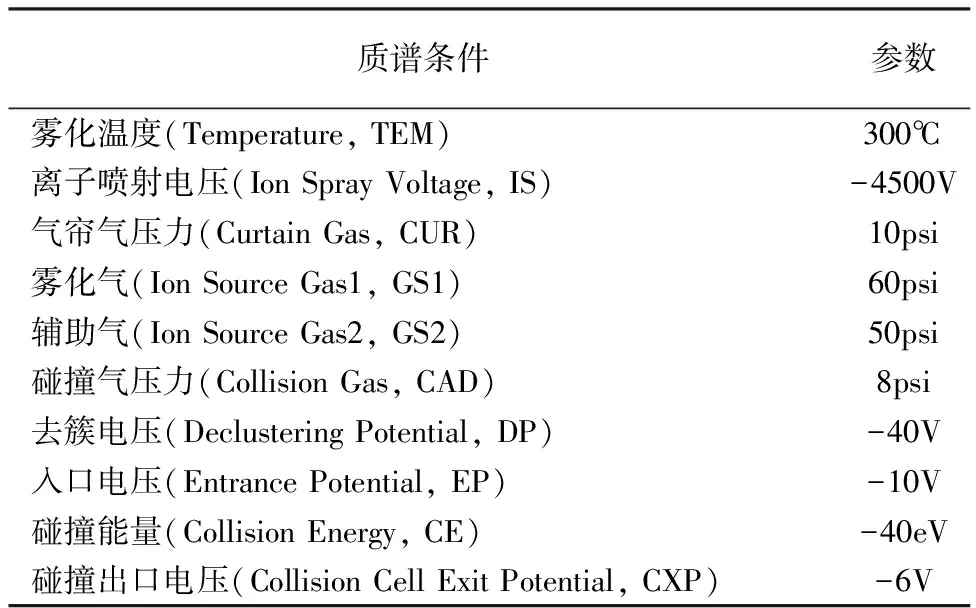
表3 质谱条件与参数
标准溶液中内标D18-HBCD(25μg/L)、回收率指示物13C-HBCDs(25μg/L)、HBCDs(20μg/L)及实际母乳样品中HBCDs(β-HBCD未检出)3种异构体提取离子流色谱图如图1所示。

图1 标准溶液中(a)D18-HBCD、(b)13C-HBCDs、(c)HBCDs及实际母乳样品中(d)HBCDs三种异构体提取离子流图Fig.1 Extracted ion chromatograms of (a) D18-HBCD, (b) 13C-HBCDs, (c) HBCDs in standard solution and (d)HBCDs in actual sample.
1.5 质量控制与质量保证
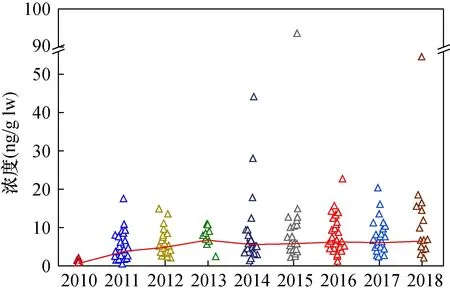
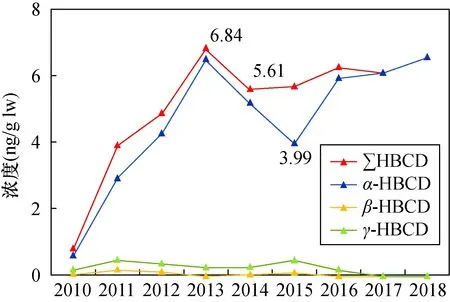
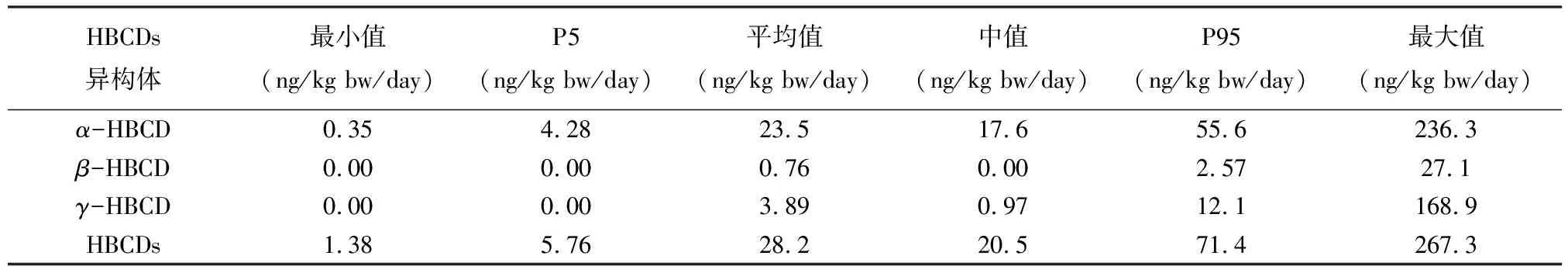
采集的母乳样品分批进行检测,每20个样品为一批,每批样品中增加平行样品、基质空白、基质加标(加标浓度10μg/L)和流程空白样品检测。基质空白和基质加标均采用超市购买的中国伊利纯牛奶,基质空白中检测到 HBCDs 浓度范围在 采用同位素内标法定量。3种HBCDs非对映异构体在1~100μg/L线性范围内的线性良好,相关系数(r)均大于0.995。通过基质加标回收率和相对标准偏差来评价方法的准确度与精密度,以纯牛奶为基质配制了0.2μg/L、0.5μg/L和2.0μg/L三种浓度水平的基质加标样品,每种浓度5个平行处理,各异构体的回收率为70.1%~126.1%,相对标准偏差为3.6%~18.1%。以基质空白的3倍噪声峰高所对应的浓度计算α、β、γ-HBCD检出限,分别为19.9pg/g lw、18.0pg/g lw、11.3pg/g lw。 表4为所有样品中HBCDs的检出率及浓度值。由表可知,HBCDs在233份母乳样品中的检出率为100%,表示HBCDs在人体中已普遍存在,浓度范围为0.46~93.5ng/g lw,均值和中值分别为7.27ng/g lw和5.77ng/g lw,高端暴露量第95百分位值为15.6ng/g lw。图2为所有母乳样品中HBCDs浓度散点图(红色趋势线为中值)。从图中可以看出,母乳样品中HBCDs水平基本处于20ng/g lw以下,但存在个体差异。 图2 2010—2018年母乳中HBCDs浓度分布散点图和中值线Fig.2 Scatter diagram and median values of HBCDs concentration distribution in breast milk from 2010 to 2018. 同时将研究结果与北京及其他地区研究值进行比较。与北京地区以往的研究数据相比,本文测定的2010—2018年北京市母乳样品中的HBCDs浓度与相同年份其他研究的测定结果基本一致。Shi等[16]测定的2011年北京市母乳中HBCDs浓度中值为2.4ng/g lw,Huang等[13]测定的2014年北京市母乳中HBCDs浓度中值为5.67ng/g lw,Zhao等[21] 表4 北京市2010—2018母乳中HBCDs及其非对映异构体浓度 测定的2018年北京市母乳中HBCDs浓度中值为7.64ng/g lw。与中国其他地区母乳中HBCDs研究数据相比,本文测定的2010—2018年北京市母乳样品中的HBCDs浓度中值略低于Shi等[15]2011年采集于全国16个省份母乳样品中的浓度(中值为6.83ng/g lw),但是高于2006—2007年在上海[22]和2011—2013年深圳[23]地区采集的母乳样品中HBCDs浓度;与国外其他国家研究数据相比,本文测定的2010—2018年北京母乳中HBCDs浓度低于2006—2007年西班牙[24]母乳中HBCDs水平(中值27ng/g lw),但要高于日本[25-26]、英国[27-29]、美国[30-31]、加拿大[30]、印度[32]、菲律宾[33]以及非洲[34-36]一些国家近期的研究结果。综合来看,北京市母乳中HBCDs浓度与国内外其他地区相比处于较高水平,这主要可能与中国对HBCDs的持续性使用以及使用量较大有关。 由表4可知,母乳样品中HBCDs的3种非对映异构体的检出率顺序为:α-HBCD>γ-HBCD>β-HBCD;3种异构体的总量占比顺序为:α-HBCD>γ-HBCD>β-HBCD。本次研究的母乳样品中主要以α-HBCD形式存在,含量占比为80.1%,这一结果与其他地区母乳中HBCDs的研究结果基本一致。例如,2006年Ryan等[37]首次报道了母乳中HBCDs的3种异构体的组成,结果显示美国和加拿大母乳中均以α-HBCD为主;2011年英国[27]的一项研究显示,母乳中α-HBCD占HBCDs总量比例达到79%;北京多项研究也表明,母乳中α-HBCD为主要异构体[13,21]。这可能是由于在生物体内α-HBCD相对于β-和γ-HBCD的半衰期更长,在脂肪中更容易富集且不易被代谢所导致的[38-40]。 但是,本研究也发现少量(约6%)母乳样品中γ-HBCD为主要异构体,含量占比为52.2%~83.5%,这些母乳样品并不都是采集于同一年份,而且即便是同一位志愿者在不同月份采集的样品,也存在主要异构体不同的情况。这表明生物体内HBCDs异构体的差异可能不仅来自生物体自身的吸收、代谢和排泄机制差异,同时会受到外部环境的影响。除本文的研究外,Eljarrat等[24]在2009年西班牙母乳样品中也发现了以γ-HBCD为主要异构体的分布特征,而且在人体内其他生物基质,例如血清[41]、头发[42]、脂肪组织[43]中也发现了以γ-HBCD为主的异构体分布特征。 总体上,多项研究表明母乳及人体中HBCDs的主要异构体为α-HBCD,部分样品中HBCDs的主要异构体为γ-HBCD。本文综合分析当前的研究结果,认为造成这种异构体分布特征差异的原因可能是:①生物个体间吸收、代谢和排泄机制存在差异,同时生物体内发生HBCDs不同异构体间的转化。程鑫[40]通过给鱼喂养特定的3种HBCDs异构体后发现,鱼体内的β-HBCD和γ-HBCD存在向α-HBCD转化的现象;但Huang等[1]在人体肝癌细胞中却发现α-HBCD和β-HBCD向γ-HBCD转化的现象,认为是肠道菌群参与的作用。②主要暴露途径的差异。比利时开展的一项研究发现,肉类食品中的HBCDs异构体以α-HBCD为主,其他食品中以γ-HBCD为主,经常食用肉类食品的人群体内α-HBCD含量更高[39]。另有研究者通过对人体脂肪组织中HBCDs的研究发现,当室内粉尘为主要暴露途径时,人体中主要异构体为γ-HBCD[43];当食用鱼类为主要暴露途径时,人体中主要异构体为α-HBCD,含量达到99%以上[44]。由于人体HBCDs的暴露途径复杂多样,又受到多种生物机制的影响,目前对人体中HBCDs的异构体分布差异进行准确的原因分析仍存在困难。 图3为本研究调查时间内,北京市母乳中的∑HBCDs以及3种非对映异构体浓度中值随时间的变化趋势。从图中可以看出,在2010—2018年期间,北京母乳中HBCDs总量表现出先上升,随后小幅度下降,并趋于平缓的趋势。即2010—2013年,HBCDs总量持续上升,2013年达到峰值后小幅度下降并趋于平缓。将各异构体与总量变化趋势进行比较发现,α-HBCD与HBCDs总量的变化趋势存在高度相似性,β-HBCD和γ-HBCD整体浓度均较低,基本小于1ng/glw,且近9年没有明显的变化趋势。 Zhao等[21]连续监测了北京市2011年、2014年及2018年母乳中HBCDs的暴露水平,发现母乳中HBCDs浓度呈现上升趋势,认为是HBCDs的持续性使用以及HBCDs在人体内的半衰期长、积累程度较高导致的。除此之外,本文认为目前这种时间趋势可能与HBCDs的生产、使用及禁用有关。HBCDs作为全球第三大溴代阻燃剂,从2001年到2010年世界市场需求量持续上升[45],增加了人体对HBCDs的暴露风险。自2013年HBCDs被列入斯德哥尔摩公约禁用化学制品黑名单后,全球HBCDs的生产量和使用量开始降低;Li等[46]统计和估算了中国历史和未来HBCDs的年产量,结果表明中国HBCDs的年生产量从2000年到2013年持续上升,2013—2015年开始下降。北京市母乳中HBCDs浓度从2014—2018年变化趋势平缓,但在2016年中国初步禁用HBCDs后,并未出现明显的下降趋势,可能是由于HBCDs主要用于建筑保温材料中,在初步禁用后市场上仍有大量的HBCDs被投入生产和使用,人体通过灰尘、饮食等途径摄入HBCDs的量没有下降。目前现有的研究中还未找到有关北京市环境中HBCDs浓度在时间变化趋势上的数据来支持这一研究结果。 图3 母乳中∑HBCDs及三种异构体浓度中值随时间变化趋势 母乳往往是1~6月婴幼儿的主要,甚至唯一食物来源。已有研究表明母亲体内与婴幼儿体内的HBCDs浓度存在显著相关性[41],而且婴幼儿通过母乳喂养每日摄入HBCDs的量远远超过成年人通过食物摄入HBCDs的量[13],所以应当加强对婴幼儿摄入HBCDs的健康风险评估。本文通过公式(1)估算研究期间内婴幼儿对HBCDs的每日估计摄入量(EDI),假设哺乳期婴儿平均体重为5kg,一天摄入700g的母乳[36,47]。 式中:EDI为污染物的每日估计摄入量(ng/kg bw/day,bw为体重);C为测定的母乳中HBCDs的浓度(ng/g lw);F为母乳样品中的脂肪含量。 婴幼儿对HBCDs的每日估计摄入量EDI值见表5。HBCDs的EDI值范围为1.38~267.3ng/kg bw/day,中值为20.5ng/kg bw/day,高端摄入量第95百分位值为71.4ng/kg bw/day。与其他国家的研究结果相比,本文测定的2010—2018年婴幼儿对HBCDs的EDI中值与Abdallah等[27]报道英国的研究结果(中值22ng/kg bw/day)较接近,但高于日本[26]、加纳[35]等国家;同时,也高于中国的上海[22]、深圳[23]等城市。例如Fujii等[26]测定的2008—2010年日本婴幼儿对HBCDs的EDI中值为13.8ng/kg bw/day,Lu等[23]测定的2011—2013年深圳市婴幼儿对HBCDs的EDI中值为8.4ng/kg bw/day。本文测定的2014年与2018年婴幼儿对HBCDs的EDI中值分别为25.7ng/kg bw/day与40.3ng/kg bw/day,与北京市以往的研究相比结果接近。例如,Huang等[13]报道的2014年北京市婴幼儿通过母乳喂养摄入HBCDs的EDI下限的中值为26.4ng/kg bw/day;Zhao等[21]报道的2018年北京市婴幼儿通过母乳喂养摄入HBCDs的EDI中值为30.6ng/kg bw/day。 通过计算婴幼儿每日HBCDs的估计摄入量EDI值,可以计算HBCDs的非致癌风险危害系数(Hazard Quotient,HQ),来评估婴幼儿通过母乳喂养暴露于HBCDs的健康风险。HQ计算方式如公式(2),其中RfD为美国环境保护署(USEPA)制定的口服参考剂量,HBCDs的RfD值为0.2μg/kg bw/day[48]。若HQ<1,则认为人体接触HBCDs不会产生健康风险;若HQ>1,则认为人体接触HBCDs可能会产生健康风险。 表5 婴幼儿对HBCDs每日估计摄入量 根据公式(2)计算结果表明,样品中HQ均值为0.14,中值为0.10,第95百分位值为0.36。其中99%的样品HQ计算结果小于1,表明婴幼儿通过母乳摄入HBCDs不会产生显著健康风险;1%母乳样品(n=2的HQ值大于1,表明极少数的母亲在哺乳期内通过母乳喂养可能会给婴幼儿带来健康风险。 本文以母乳为介质,持续监测与评估了北京市2010—2018年母乳中HBCDs的残留水平与健康风险,结果显示北京市母乳中HBCDs浓度与国内外其他地区相比水平较高,且在2016年中国初步禁用HBCDs后,北京市母乳中HBCDs含量并没有下降,可能意味着环境中HBCDs的浓度依旧没有降低,市场上仍有大量的HBCDs在投入使用。另外值得关注的是,调查范围内个别婴幼儿(约1%)非致癌风险系数HQ值大于1,可能存在高暴露健康风险。 本研究中部分年份样品的数量较少,数据代表性可能不足,今后可以加大样本量,继续开展区域人体中HBCDs残留水平的持续性监测,尤其需要调查自中国2021年12月全面禁用HBCDs后,人体中HBCDs残留水平的变化趋势,同时持续监测环境中HBCDs的浓度及时间变化趋势,寻找并确定人体的主要暴露源。2 结果与讨论
2.1 北京市母乳中HBCDs的残留水平

2.2 母乳中HBCDs非对映异构体的组成特征
2.3 北京市2010—2018年母乳中HBCDs浓度的变化趋势
2.4 婴幼儿每日HBCDs摄入量与风险评估
3 结论
