神经导航辅助小骨瓣开颅内镜下治疗高血压性基底节区脑出血的效果
2023-05-16陈轩李齐印李冰
陈轩,李齐印,李冰
(商丘市第一人民医院 神经外科,河南 商丘 476100)
高血压性脑出血为脑出血常见类型,随着生活方式改变,发病率逐年增长且趋于年轻化[1]。60%~70%的患者常发生基底节区出血,该疾病起病急、进展快、致残和致死率高,危及患者生命安全[2]。显微镜手术是常用治疗手段,于直视下清除血肿,且术后去除骨瓣具有减压作用,但切口较大,解剖过程能造成脑组织损伤,术后恢复较慢[3]。小骨瓣开颅内镜术以创伤轻、术后恢复迅速的优势逐渐应用于脑血管疾病治疗。但在实际临床中,由于颅脑解剖结构复杂,操作精度要求较高,内镜手术实施存在一定局限性[4]。神经导航系统根据影像数据能设计手术路径,使手术更精细、微创化,能为外科手术安全实施创造条件[5]。本研究选取78例高血压性基底节区脑出血(hypertensive basal ganglia hemorrhage,HBGH)患者,旨在探究神经导航辅助小骨瓣开颅内镜术的应用价值。
1 对象与方法
1.1 研究对象本研究为回顾性分析。选取2020年1月至2021年8月商丘市第一人民医院收治的78例HBGH患者作为研究对象,按照随机数字表法分为常规组和导航组,各39例。常规组男19例,女20例;年龄42~65岁,平均(57.66±3.42)岁;病程0.6~11 h,平均(5.76±1.53)h;体重指数18.9~25.8 kg·m-2,平均(22.57±1.44) kg·m-2;出血位置左侧21例,右侧18例;血肿量29~65 mL,平均(46.73±8.11)mL。导航组男17例,女22例;年龄44~68岁,平均(58.14±4.22)岁;病程0.7~12 h,平均(6.12±2.03)h;体重指数19.2~26.3 kg·m-2,平均(22.83±1.56) kg·m-2;出血位置左侧24例,右侧15例;血肿量31~68 mL,平均(48.25±7.92)mL。两组一般资料比较,差异无统计学意义(P>0.05)。本研究经商丘市第一人民医院医学伦理委员会审核批准。
1.2 选取标准(1)纳入标准:参照《高血压性脑出血中国多学科诊治指南》[6]中相关诊断,且经颅脑CT检测确诊出发病位置为基底节区;首次发病且有高血压病史;符合手术指征;患者临床资料完整。(2)排除标准:合并感染、血液系统等疾病;有麻醉禁忌证;重要器官功能严重障碍;其他原因引起的脑出血;近期服用过抗凝药物。
1.3 治疗方法(1)患者术前均完成相关检测,并接受维持电解质平衡、营养支持、控制颅内压等对症治疗。(2)常规组接受显微镜开颅术,具体操作:患者全麻取平卧位,消毒铺无菌巾;根据CT情况避开神经及大血管于颞部做弧形切口,逐层分离头皮、皮下组织至颅骨,依据脑组织水肿程度及血肿量确定骨瓣大小,十字剪开硬脑膜,引流脑脊液进行颅内降压;沿脑回方向切开血管处,造瘘直至血肿腔;显微镜下清除血肿,电凝止血,确认无活动出血,置引流管,根据颅内压情况确认骨瓣是否复位。(3)导航组接受神经导航辅助小骨瓣开颅内镜术,具体操作:术前将颅脑三维CT录入神经导航系统快速确定穿刺点及穿刺路径;患者剃发全麻取仰卧,头偏健侧,头部固定并进行导航注册;根据标记位置做纵行切口(3 cm),铣除直径为2.0 cm骨片,切开硬脑膜,以穿刺套管穿刺至血肿腔,退出针芯,依次置入神经内镜及吸引器,内镜下清除血肿,避免过度吸除周围血肿壁及周围责任血管,及时调整工作鞘深度及角度;活动出血点电凝止血,明胶海绵覆盖,确认无活动出血后用温盐水冲洗术区,置入引流管,缝合硬脑膜,回填骨瓣,缝合皮瓣。术后给予颅内压控制、氧气供给、预防感染、常规补液、营养脑细胞等干预;术后24 h检测颅内压;2~3 d拔除引流管。
1.4 观察指标
1.4.1手术指标 手术时间、术中出血量、住院时间、血肿清除效果。
1.4.2神经功能指标 采集术前及术后7 d肘静脉血3 mL,室温静置30 min,离心分离血清,冷藏待测。以ELISA测定血清巨噬细胞炎性蛋白(macrophage inflammatory protein,MIP-1α)、S100钙结合蛋白(S100 calcium binding protein,S100β),以放射免疫法测定神经元特异性烯醇化酶(neuron-specific enolase,NSE)。
1.4.3血流动力学 以德力凯公司生产的血流分析仪(EMS-9WA型)测定术前及术后7 d搏动指数(pulse index,PI)、平均流速(Vmean,Vm)、收缩期峰值流速(peak systolic velocity,PSV),连测3次求均值。
1.4.4神经缺损程度、昏迷情况、日常生存能力 分别以美国国立卫生研究院卒中量表(National Institute of health stroke scale,NIHSS)[7]、格拉斯哥昏迷评分(Glasgow coma scale,GCS)[8]、日常生活活动能力量表(activities of daily living,ADL)[9]进行评估,评分范围分别为:0~42分、3~15分、14~56分。得分越高则神经缺损程度越严重,昏迷风险越低,日常生活能力越差。
1.4.5并发症情况 包括颅内感染、再出血、脑水肿、下肢血栓。
2 结果
2.1 手术指标导航组血肿清除率高于常规组,手术时间、住院时间短于常规组,术中出血量少于常规组(P<0.05)。见表1。
2.2 神经功能指标水平术前两组血清NSE、MIP-1α、S100β水平比较,差异无统计学意义(P>0.05);术后7 d两组血清NSE、MIP-1α、S100β水平降低,导航组水平低于常规组(P<0.05)。见表2。
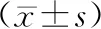
表1 两组手术指标比较
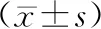
表2 两组神经功能损伤指标水平比较
2.3 血流动力学指标术前两组PSV、Vm、PI比较,差异无统计学意义(P>0.05);术后7 d两组PSV、Vm、PI升高,导航组高于常规组(P<0.05)。见表3。
2.4 NIHSS、GCS、ADL评分术前两组NIHSS、GCS、ADL评分比较,差异无统计学意义(P>0.05);术后3个月两组NIHSS、ADL评分降低,GCS评分升高,导航组NIHSS、ADL评分低于常规组,GCS评分高于常规组(P<0.05)。见表4。
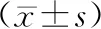
表3 两组血流动力学指标比较
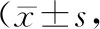
表4 两组NIHSS评分、GCS评分、ADL评分比较分)
2.5 并发症情况两组并发症总发生率比较,差异无统计学意义(P>0.05)。见表5。

表5 两组并发症总发生率比较(n,%)
3 讨论
HBGH为常见脑血管疾病,可使颅内压升高,引起继发性血肿病变,导致患侧肢体出现功能障碍,甚至死亡,在减轻脑组织损伤前提下,最大限度清除血肿是改善预后的最佳手段[10]。显微镜术采用大骨瓣开颅法,术区暴露范围广阔,操作难度较低,但切口较大,并发症风险较高,且对脑组织牵拉严重,易引起神经功能损伤[11]。
近年来外科手术趋于微创、精准化,神经内镜以微创、可视性强及组织牵拉小等优势,逐渐被应用于脑出血的临床治疗。而神经导航系统通过处理影像CT或MRI数据,对头颅进行三维定位,确定病变位置及范围,有助于设计手术方案,且比经验定位更为精确[12]。赖挺等[13]研究显示,神经导航系统能减轻神经损伤,降低瘫痪程度。呼虹宇等[14]研究指出,神经导航系统联合内镜可提高手术精准度和安全性,增加病灶清除效果,术后并发症风险低。本研究显示,相较于常规组,导航组手术时间、住院时间较短,血肿清除率及术后3个月GCS评分较高,术后3个月NIHSS评分、ADL评分较低,提示神经导航系统辅助小骨瓣开颅内镜术能减轻HBGH患者神经损伤,降低昏迷风险,增强生活能力,且能优化手术路径,促进术后恢复。其原因可能在于神经导航系统对头颅进行三维定位,预先设计手术路径,避免术中经验性操作造成血管及重要神经损伤,进而提高生活能力。而两组并发症差异无统计学意义,可能与本研究纳入样本容量较小有关。
HBGH患者脑组织受血肿占位效应、脑水肿等因素影响,导致颅内压升高,脑血管自控功能损伤,进而引起血液循环障碍,是造成预后效果不佳的重要机制[15]。PSV、Vm、PI为主要脑部血流动力学指标,他们用于诊断脑血管病变的临床价值已被证实[16]。此外大脑血液循环障碍,引起局部组织缺血缺氧,造成脑神经细胞损伤,而具有活性的神经细胞贯穿脑组织神经修复始终,在维持脑神经正常发挥重要作用,其活性与脑神经恢复程度密切相关[17]。NSE是高特异性的酶,由脑神经细胞及神经细胞分泌,与脑组织神经元损伤程度呈正相关。S100β多分布于中枢神经细胞,当血脑屏障功能异常,血清S100β水平迅速上升,可作为反映中枢神经损伤程度及预后发展的敏感性指标。MIP-1α是由小胶质细胞分泌,可促进白细胞迁徙。研究显示,给予MIP-1α拮抗剂后,脑组织损伤面积减小,说明MIP-1α在脑组织损伤中具有重要作用,是脑组织损伤程度的主要指标[18]。本研究显示,术后7 d导航组血流动力学指标(PSV、Vm、PI)、神经功能指标(NSE、MIP-1α、S100β)优于常规组。分析原因,神经导航系统辅助小骨瓣开颅内镜术血肿清除率较高,能减轻血管压迫,有助于恢复血供,为损伤神经恢复提供有利条件,同时也是导航组神经功能恢复较快的主要原因。
综上所述,神经导航系统辅助小骨瓣开颅内镜手术是一种安全有效的治疗手段,能改善HBGH患者血流动力学,为神经功能恢复提供便利,进而降低昏迷风险,增强患者生活能力。
