尿酸、超氧化物歧化酶及甲状腺激素与帕金森病的相关性
2023-05-16崔晨瑜朱红灿宗会琴马锦秀
崔晨瑜,朱红灿,宗会琴,马锦秀
(郑州大学第一附属医院 神经内科,河南 郑州 450000)
帕金森病(Parkinson’s disease,PD)是常见的慢性进行性神经退行性疾病,数据显示截至2020年底,中国PD患者数量达到362万人[1]。随着人口老龄化和生活环境的变化,2030年中国PD患者数量预计将达到494万[2],加重了家庭和社会的心理及经济负担。目前PD病因及发病机制尚不明确,临床诊断主要依靠临床表现和体格检查,易受主观因素的影响。因此,寻找方便、可靠的生物标志物对PD的早期诊断及干预十分重要。氧化应激在PD发病机制中发挥重要作用[3]。尿酸(uric acid,UA)和超氧化物歧化酶(superoxide dismutase,SOD)是人体内重要的抗氧化剂,在保护神经元细胞免受氧化应激方面起着重要作用[4]。此外,甲状腺激素在氧化应激及抗氧化调节中发挥重要作用[5],通过诱导多巴胺能神经元分化保护多巴能神经元[6]。本研究旨在分析PD患者UA、SOD及甲状腺激素水平,并探讨其在PD不同亚型之间的差异,为临床识别及诊治PD提供参考。
1 对象与方法
1.1 研究对象选取2020年10月至 2021年12月郑州大学第一附属医院收治的110例原发性PD患者纳入PD组。其中男59例,女51例;年龄42~86岁,平均(60.74±0.94)岁。另选取同时期年龄性别相匹配的94例健康体检者作为对照组,其中男47例,女47例;年龄40~83岁,平均(58.66±1.02)岁。两组性别、年龄比较,差异无统计学意义(P>0.05)。本研究通过郑州大学第一附属医院医学伦理委员会审核批准。
1.2 选取标准(1)纳入标准。PD组研究对象符合中国帕金森病诊断标准(2016版)[7]:①运动迟缓、出现静止性震颤、肌强直中的任1项;②不存在绝对排除标准如小脑功能障碍、眼球下视障碍、大剂量左旋多巴治疗无效等;③至少存在以下2项支持标准如对多巴胺能药物治疗有效、出现左旋多巴诱导的异动症、单个肢体静止性震颤、辅助检查提示嗅觉减退或丧失、黑质异常高回声、心脏交感神经受累;④没有警示征象。(2)排除标准 :①脑炎、脑血管病等引起的继发性PD综合征及痴呆等其他神经退行性疾病;②合并恶性肿瘤、血液系统疾病、痛风、甲状腺疾病;③心、肝、肾功能不全;④服用影响UA、SOD及甲状腺激素水平的药物。
1.3 研究方法
1.3.1资料收集 收集所有患者病历资料,记录性别、年龄及UA、SOD、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)、促甲状腺素(thyroid stimulating hormone,TSH)水平。记录PD患者发病年龄、起病形式、临床症状,并采用统一帕金森病评分量表(the unified Parkinson’s disease rating scale,UPDRS)的第Ⅲ部分(UPDRSⅢ)评估运动功能,包括言语、面部表情、静止性震颤、手部动作性或姿势性震颤、强直、手指拍打试验、手运动、轮替动作、腿部灵活性、起立、姿势、步态、姿势的稳定性、躯体少动14个项目,每个项目根据严重程度计0~4分,分值越高表明运动功能障碍越重[8]。采用改良版Hoehn-Yahr分期(H-Y分期)对PD患者进行评估[9]。改良版H-Y分期:0期为无症状;1期为单侧受累;1.5期为单侧及躯干受累;2期为双侧受累,无平衡障碍;2.5期为后拉试验可恢复;3期为轻中度双侧受累,某种姿势不稳;4期为严重残疾,仍可独自行走或站立;5期为无帮助时只能坐轮椅或卧床。
1.3.2PD组的分组方法 (1)根据UPDRS量表中的震颤得分均值和姿势不稳步态障碍(postural instability and gait disorder,PIGD)得分均值的比值对PD患者进行运动分型。震颤得分均值等于UPDRS第16项(震颤)、第20项(静止性震颤,包括5个条目)和第21项(动作性或姿势性震颤,包括2个条目)总分之和除以8。PIGD得分均值等于UPDRS第13项(摔倒)、第14项(冻结步态)、第15项(行走困难)、第29项(步态)和第30项(姿势不稳)总分之和除以5。震颤得分均值和PIGD得分均值的比值≤1判定为PIGD型,比值≥1.5判定为震颤型,1<比值<1.5则为不确定型[10]。本研究将震颤型和不确定型归入非PIGD组。最终PIGD组64例,非PIGD组46例。(2)根据患者发病年龄将PD患者分为2个亚组:早发型PD组39例(发病年龄≤50岁)和晚发型PD组71例(发病年龄>50岁)[11-12]。(3)根据改良版H-Y分期量表将PD患者分成3个亚组:早期组32例(H-Y 1~2期)、中期组 49例(H-Y 2.5~3期)和晚期组 29例(H-Y 4~5期)。
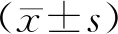
2 结果
2.1 PD组与对照组UA、SOD、FT3、FT4、TSH水平PD组患者UA、SOD水平低于对照组(P<0.05);两组FT3、FT4、TSH比较,差异无统计学意义(P>0.05)。见表1。
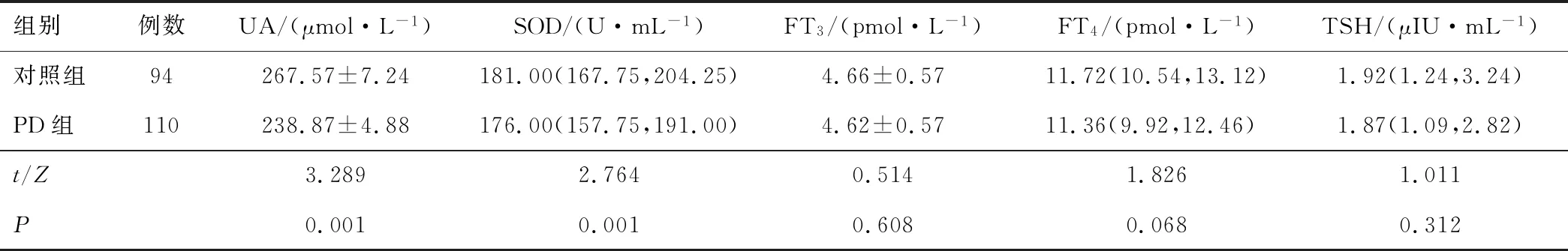
表1 对照组与PD组UA、SOD、FT3、FT4、TSH水平比较
2.2 PD发病的多因素分析以有无PD为因变量(无=0,有=1),以表1中差异有统计学意义的UA、SOD水平为自变量,纳入多因素logistic回归分析,结果提示UA、SOD是PD发病的影响因素,且低水平UA和低水平SOD是PD发病的危险因素(P<0.05)。见表2。
2.3 PD组不同运动亚型患者的一般资料PD组不同运动亚型间年龄、性别、H-Y分期、UA、SOD、FT3、FT4、TSH水平比较,差异无统计学意义(P>0.05),PIGD组患者的UPDRSⅢ评分高于非PIGD组(P<0.05)。见表3。

表2 PD发病的多因素logistic回归分析

表3 PD组不同运动亚型间一般资料比较
2.4 PD组不同发病年龄亚型患者的一般资料PD组不同发病年龄亚型间性别、H-Y分期、UA、SOD、FT3、FT4水平比较,差异无统计学意义(P>0.05),早发型PD组H-Y分期及UPDRSⅢ评分均高于晚发型PD组,TSH水平低于晚发型PD组 (P<0.05)。见表4。
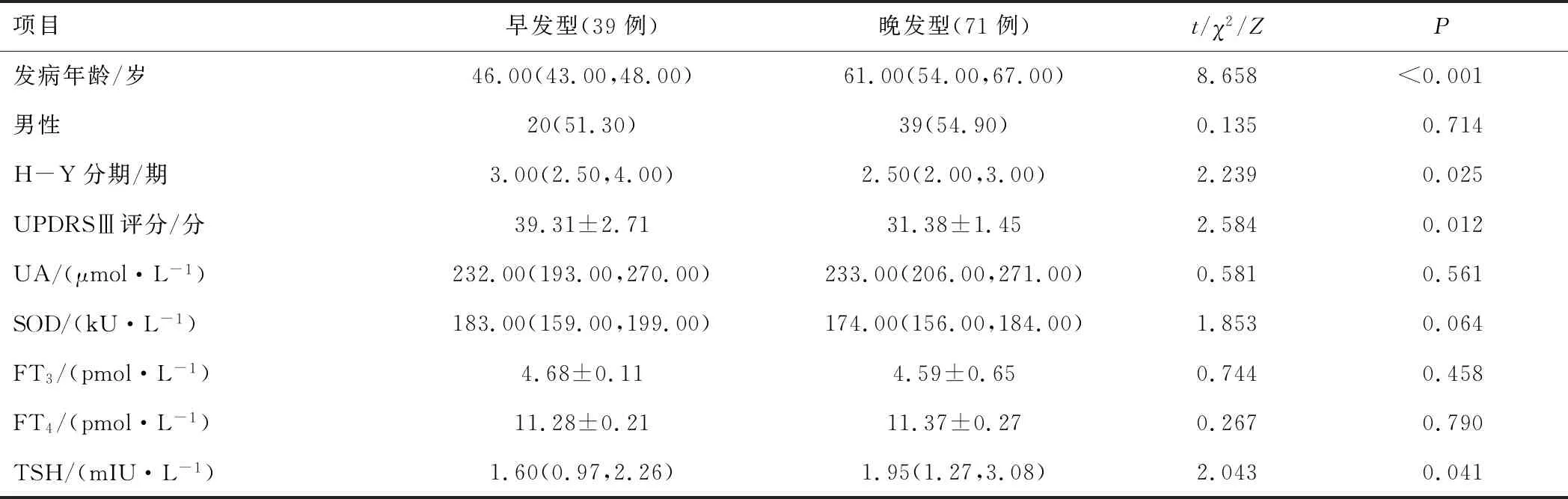
表4 PD组不同发病年龄亚型间患者一般资料比较
2.5 PD组不同H-Y分期患者UA、SOD、甲状腺激素水平PD组不同H-Y分期患者UA、FT3、TSH水平比较,差异无统计学意义(P>0.05);PD中、晚期患者SOD、FT4水平低于早期患者(P<0.05);PD晚期患者SOD、FT4水平低于中期患者(P<0.05)。见表5。

表5 PD组不同H-Y分期患者UA、SOD、甲状腺激素水平比较
3 讨论
PD是一种慢性进行性神经系统退行性疾病,其病理特征是中脑黑质多巴胺能神经元的变性死亡。氧化应激是PD发病的重要机制之一,反映了活性氧自由基(reaction oxygen species,ROS)产生和机体抗氧化的失衡,ROS蓄积造成细胞损伤[13]。中脑黑质因抗氧化剂较其他脑区少及铁螯合作用等因素更易受到ROS的攻击。一项针对早期PD患者临床数据表明,在大量多巴胺能神经元丢失前,机体的氧化应激水平已显著增高,说明ROS生成过多是多巴胺能神经元变性死亡的潜在诱因[14]。
在本研究中,相比对照组,PD患者UA、SOD水平下降,且多因素回归分析提示低水平UA及SOD是PD发病的危险因素,这表明UA、SOD与PD发病有关。UA 是体内主要的非酶类抗氧化剂,其抗氧化能力占血清的50%以上,可通过清除过氧亚硝基阴离子、结合铁抑制铁诱导ROS生成及抑制SOD降解提高机体抗氧化能力,保护神经系统免受氧化应激损害[15]。SOD是人体内抗氧化系统的第一道防御屏障,通过清除超氧自由基抑制ROS对细胞造成损害[16]。当UA、SOD水平降低时,机体清除ROS能力下降,ROS蓄积导致黑质多巴胺能神经元受损进而促使PD发病,这支持氧化应激可能是PD的发病机制。
甲状腺激素在中枢神经系统的正常发育、代谢和生长中起着重要作用。大型队列研究表明,甲亢和甲减患者患PD的风险显著增高[17-18],相关机制考虑如下:甲亢患者基础代谢及耗氧量增加,促进ROS产生进而引起氧化应激。甲减患者抗氧化能力下降,不能有效清除ROS且动物模型中发现甲减和多巴胺能神经元数量减少有关[5,19]。因此,甲状腺激素在氧化应激和抗氧化中发挥重要作用。但本研究结果显示相比对照组,PD患者FT3、FT4、TSH降低但差异无统计学意义,这与Tan等[20]的结果一致。因此,甲状腺激素与PD的具体相关机制有待进一步研究。
PD不同临床亚型通常预示着不同的临床表现、潜在的病理机制和预后。因此,寻找合适的生物标志物鉴别PD临床亚型,有助于PD的个体化治疗。PIGD型患者黑质多巴胺能神经元损失更重,疾病进展速度更快,非运动症状发生率较高,生活质量更差。既往研究表明相比非PIGD组,PIGD组患者UA水平较低,TSH水平稍高[21-22]。但本研究结果显示PD不同运动亚型间UA、SOD及甲状腺激素水平差异无统计学意义,这可能与纳入标准及量表评估的主观性有关。年龄是PD最重要的危险因素之一,PD根据发病年龄可分为早发型和晚发型。与晚发型PD相比,早发型PD患者多与遗传相关且具有病程长、对左旋多巴反应好、更早出现运动并发症、预后较好。随着年龄增长,黑质内氧化应激水平增高,多巴胺能神经元逐渐减少,这可能是PD的发病基础[13]。但本研究中早发型和晚发型PD患者间UA、SOD水平差异无统计学意义,这可能受到患者的疾病阶段或抗PD药物治疗的影响。本研究中晚发型PD组TSH水平高于早发型PD组。一方面由于TSH水平随着年龄增长而升高[23],另一方面,晚发型PD患者多巴胺能神经元丢失更严重[24],对TSH的抑制作用减弱。因此,临床中TSH可作为区别PD不同发病年龄亚型的生物标志物。
H-Y分期常被用来评估PD病情进展,有研究表明UA水平随着PD进展而逐渐降低[25]。而最近的研究得出UA与PD患者H-Y分期不相关[26-27]。在本研究中UA在不同PD病情分期间的差异无统计学意义。因此,UA在PD进展过程中的作用还有待进一步研究。本研究显示随着PD病情进展,SOD水平逐渐下降,与Cokal等[28]结果一致。由于PD的不断进展,氧化应激水平不断增高,SOD消耗增多,黑质受到氧化应激损伤逐步加重。此外随着PD的病情进展,FT4水平也逐渐下降。这种变化可能是机体在病情严重阶段的自我保护,通过减少基本代谢减少ROS的产生,但其潜在机制尚不清楚。因此,临床可将SOD、FT4水平作为评估PD进展的血清学指标。
综上所述,低水平UA和低水平SOD是PD发病的危险因素,UA、SOD及甲状腺激素水平在PD不同临床分型中具有一定差异。本研究存在一定的局限性,如样本量较小,未能收集脑脊液及影像学相关指标、量表主观性强等,未来需要大样本及纳入更多指标来寻找PD的生物标志物。
