新冠疫苗接种后结节性类天疱疮一例
2023-05-15周芯宇周兴丽
周芯宇 李 凡 周兴丽 李 薇 蒋 献
1四川大学华西医院皮肤科,成都,610041;2四川大学华西医院皮肤病学研究室,成都,610041
大疱性类天疱疮(bullous pemphigoid,BP)是常见的自身免疫性大疱性疾病(autoimmune bullous diseases,AIBD)之一,多见于中老年人群[1]。约20%的BP患者首发表现不典型,可呈湿疹样、荨麻疹样及结节性损害伴明显瘙痒[2]。结节性类天疱疮(pemphigoid nodularis,PN)是BP 的一种罕见亚型,偶见与疫苗接种相关[3]。 我科诊治1例在接种新型冠状病毒(以下简称新冠)疫苗后出现的PN患者,现报道如下。
临床资料患者,男,68岁。因“躯干及四肢丘疹、结节伴瘙痒8个月”来诊。8个月前患者出现躯干及四肢皮肤瘙痒剧烈,搔抓后逐渐出现红色丘疹,未予治疗。7个月前上述皮疹逐渐增大增多,并出现丘疱疹及大量结节。5个月前患者左下肢因搔抓破溃后形成溃疡。多次于当地医院予口服抗组胺药、抗生素及外用多种药物,具体不详,瘙痒缓解,但皮疹无明显好转,遂于我院就诊。追问病史,患者发病前3天曾注射新冠疫苗第一剂,注射第二剂后上述症状逐渐加重。患者发病以来无发热,既往无特殊病史,否认传染病史、过敏史、冶游史、家族类似病史,发病前无其他可疑用药史。
体格检查:系统检查未见异常。皮肤科查体:躯干及四肢散在分布暗红色丘疹、结节(图1a、1b),以双下肢为甚,部分丘疹、结节中央有凹陷性坏死、痂壳形成(图1c、1d),部分丘疹、结节表面可见水疱形成,尼氏征阴性(图1d、1e)。左踝关节外侧见一约3 cm×5 cm大溃疡,表面少许渗液,周围皮肤色素沉着(图1f),口腔及外生殖器正常。
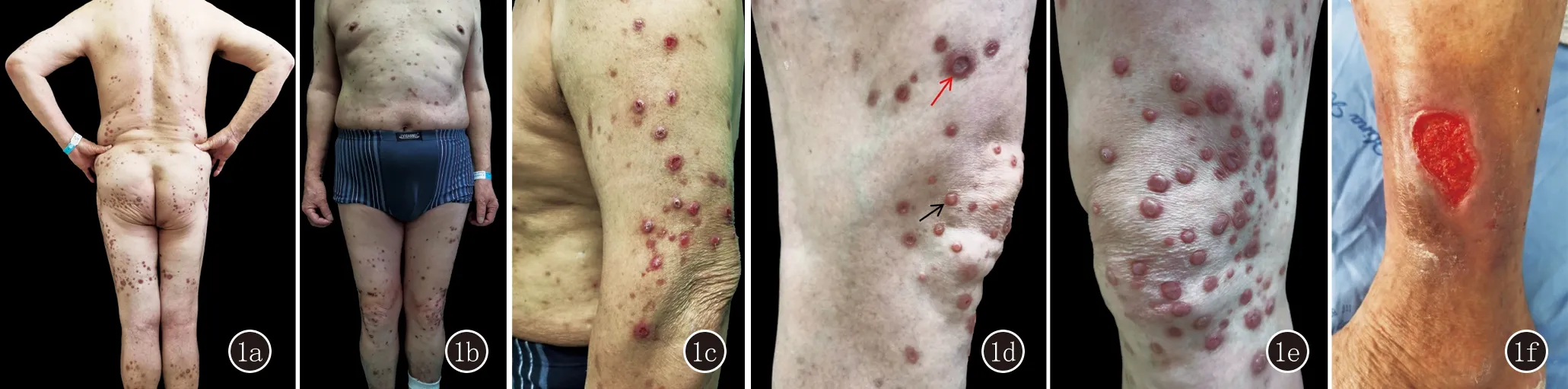
图1 1a、1b:躯干及四肢散在分布暗红色丘疹、结节,以双下肢为甚; 1c、1d:部分丘疹、结节中央有凹陷性坏死、痂壳形成(黑色箭头:组织病理和免疫荧光部位;红色箭头:送检细菌、真菌、分枝杆菌培养);1d、1e:下肢部分丘疹、结节表面可见水疱形成,尼氏征阴性;1f:左踝关节外侧见一溃疡,表面少许渗液,周围皮肤色素沉着
实验室及辅助检查:尿常规:尿葡萄糖14 mmol/L(2+);生化:血糖 11.89 mmol/L(3.9~5.9 mmol/L),甘油三酯 4.45 mmol/L(0.29~1.83 mmol/L),胆固醇6.29 mmol/L(2.8~5.7 mmol/L);糖化血红蛋白 8.5%(4.5%~6.1%);梅毒螺旋体抗体:阳性;梅毒颗粒凝集试验(TPPA):阳性,甲苯胺红不加热血清试验(TRUST)滴度1∶1阳性;血常规、IgE、体液免疫、分泌物涂片+培养均未见异常,肿瘤筛查结果为阴性。ELISA结果:血清抗Dsg1和抗Dsg3抗体、血清抗BP180抗体、血清抗BP230抗体均阴性;皮损组织病理示:(右膝关节丘疱疹)表皮角化过度,棘层轻度增生,表皮下大疱形成,疱底真皮浅层小血管周围大量淋巴细胞、少量嗜酸粒细胞浸润(图2)。直接免疫荧光(DIF):基底膜带线状IgG(+),IgA、IgM、C3均(-)(图3a)。右膝关节结节部位病理组织送检细菌、真菌、分枝杆菌培养均为阴性;盐裂试验:人工水疱真皮侧、表皮侧IgG均(+)(图3b)。
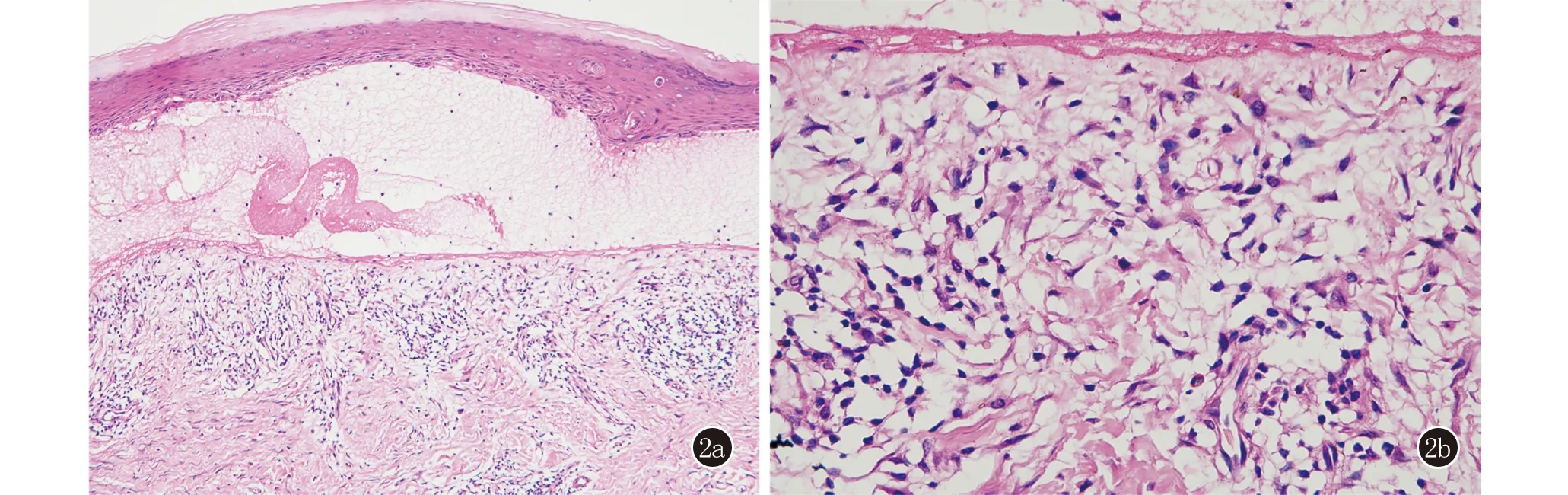
图2 表皮角化过度,棘层轻度增生,表皮下大疱,疱底真皮浅层小血管周围大量淋巴细胞,少量嗜酸粒细胞浸润(2a:HE,×100;2b:HE,×400)
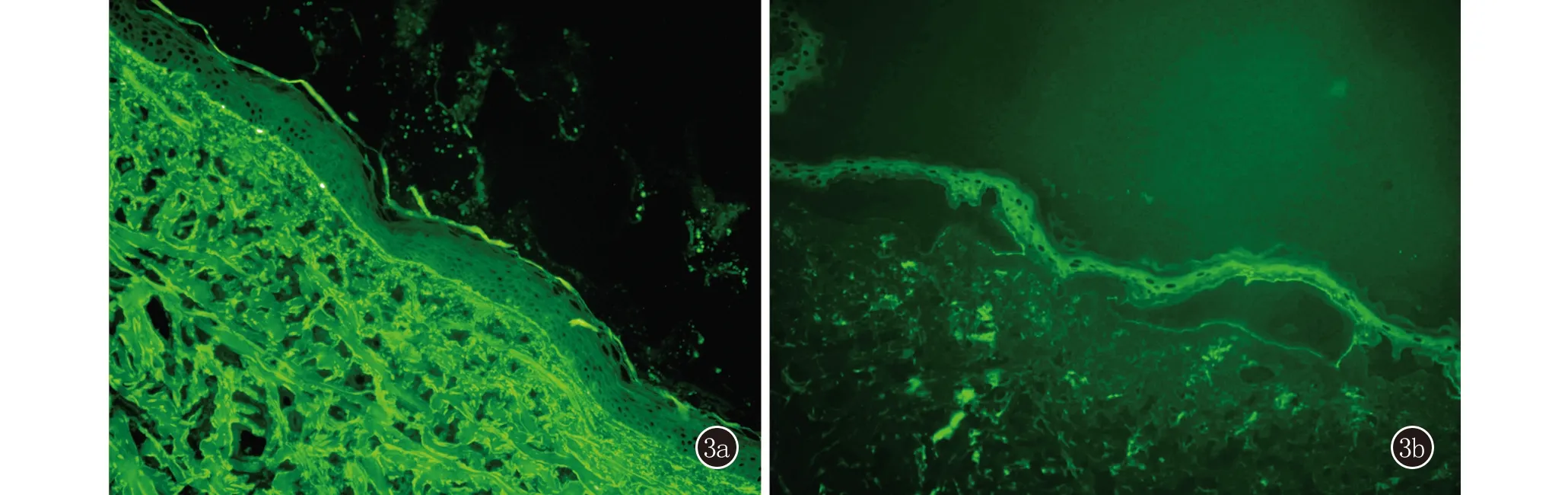
图3 3a:直接免疫荧光:皮肤基底膜带线状IgG(+)(×200);3b:盐裂皮肤试验:人工水疱真皮侧、表皮侧IgG(+)(×200)
诊断:结节性类天疱疮、隐性梅毒、糖尿病。系统予胰岛素、苄星青霉素(240万U/周×3周)肌肉注射;雷公藤多苷片20 mg每日3次;盐酸米诺环素胶囊100 mg每日2次;外用卤米松/三氯生乳膏及新型银离子敷料换药溃疡面治疗4周后,患者瘙痒缓解,原有丘疹、结节部分好转,溃疡面基本愈合,继续上述治疗4周后有少许新发皮疹,加用硫唑嘌呤50 mg每日1次,治疗4周后,患者无新发皮疹,仅外用丙酸氟替卡松乳膏维持治疗,仍在随访中。
讨论结节性类天疱疮是大疱性类天疱疮的一种罕见亚型[3],结合了结节性痒疹的临床表现和BP的免疫学特征,伴或不伴水疱形成[4]。 BP是常见的AIBD之一,大多数会产生针对基底膜带区(basement membrane zone,BMZ)的180-kDa BP抗原(BP180)或/和230-kDa BP抗原(BP230)的抗体[1]。目前病因尚不明确,可能与遗传和药物、外伤和感染等有关[5]。近年来,许多疫苗也被陆续报道可能诱发BP,如流感、带状疱疹、肺炎球菌等疫苗[6]。自2019年新冠疫情爆发以来,接种疫苗是控制疫情最经济和有效的方式[7]。目前全球新冠疫苗主要有信使核糖核酸(mRNA)疫苗、腺病毒载体疫苗、灭活病毒疫苗[8]。随着接种人群的增多,疫苗相关的不良反应也受到越来越多的关注[9]。部分人群对疫苗接种犹豫不决,担心可能疫苗诱发的自身免疫性疾病[10]。2022年一项回顾研究总结了35例接种新冠疫苗后新发AIBD病例的临床和免疫学特点,认为新冠疫苗可能会增强或激发免疫反应,与AIBD之间存在潜在关联[11]。
目前国内外均无新冠疫苗引起的结节性类天疱疮的病例报道。作者于 Pubmed 数据库以“Covid-19 vaccine”或“SARS-SoV-2 vaccine”及“Pemphigoid”“Autoimmune bullous diseases”为关键词进行文献检索,只纳入新冠疫苗接种后出现新发BP的报道,收集了有完整临床资料的报道67例(表1)。以男性多发(M/F=1.48),老年人最为常见。24例患者既往无任何疾病和用药史,9例患者在发病前因心血管疾病长期口服阿司匹林、呋塞米、赖诺普利、佐芬普利、雷米普利或培哚普利等药物,1例患者因糖尿病口服维格列汀(一种DPP-4抑制剂)10年,上述的药物均可能在BP发病中发挥作用[12],有研究发现使用DPP-4抑制剂导致BP出现的潜伏期为20~128个月[13]。因此无法明确是药物还是疫苗的因素。分析已报道的病例,大部分患者(52/67,77.6%)接种的是mRNA疫苗,而我们报道的患者接种的是全灭活疫苗,这可能与国外接种mRNA疫苗的人群较多有关,这也是人类首次使用基因疫苗,是否与疫苗性质有关仍需进一步研究。大部分患者(35/67,52.2%)在接种第二剂疫苗后发病,潜伏期1~54天。此外,BP黏膜不易受累,但分析的病例中约10.4%出现口腔等黏膜损害。
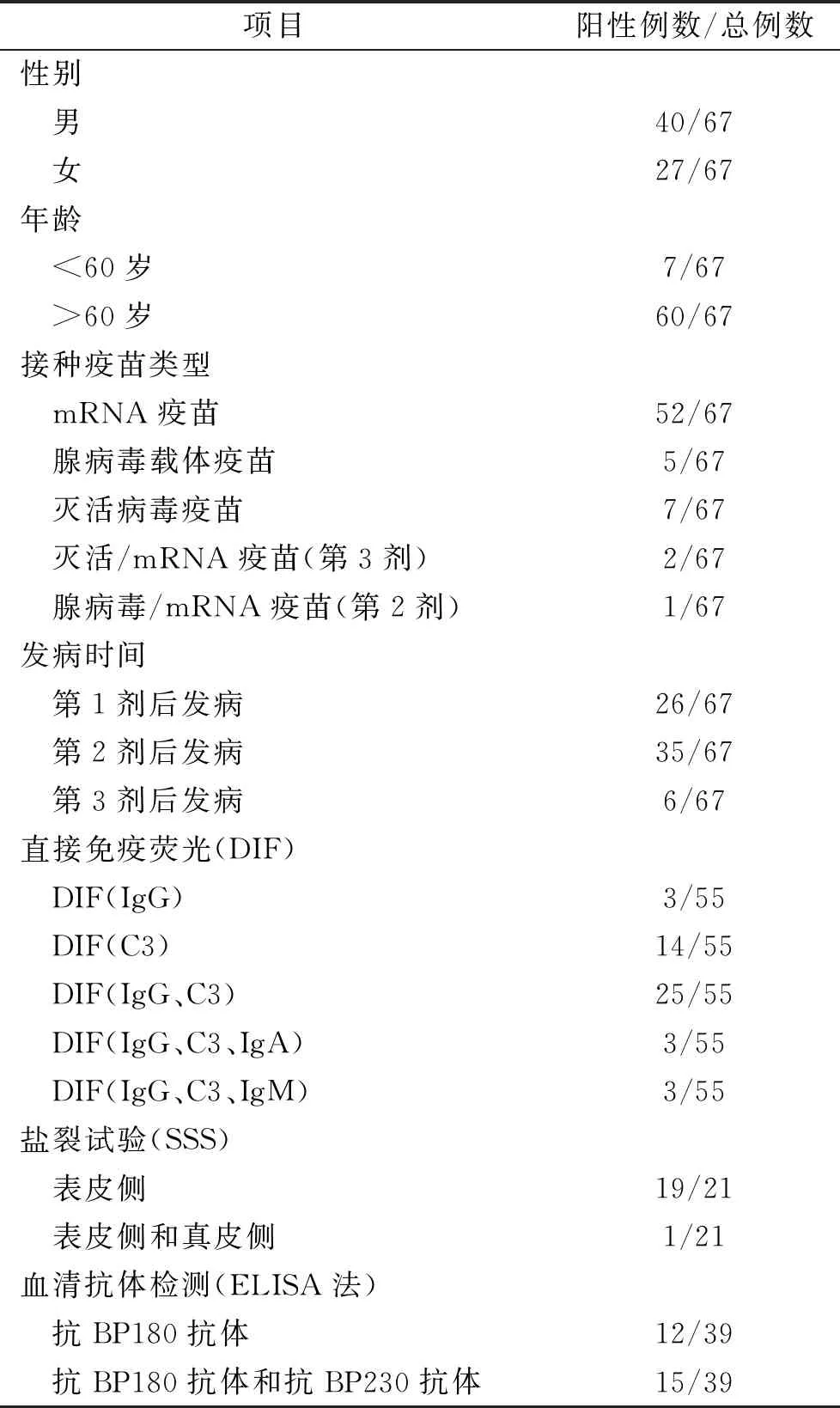
表1 接种新冠疫苗后出现BP患者的临床特征总结
BP典型病理表现为表皮下大疱或裂隙形成,真皮层有嗜酸粒细胞、淋巴细胞和中性粒细胞浸润。PN的典型病理是在BP的基础上出现表皮角化过度、角化不全,棘层增厚。DIF示基底膜带线状C3和/或IgG沉积[14]。盐裂试验显示IgG抗体沉积在表皮侧。在总结的病例中,大部分BP患者DIF均出现C3和/或IgG在基底膜带线状沉积。在20例行盐裂试验的病例中只有1例患者IgG抗体同时沉积在人工水疱的真、表皮两侧,与我们这例相似,其余均沉积在表皮侧。ELISA 可以进一步辅助诊断BP,在39例行ELISA检查的患者中:12例出现抗BP180 抗体阳性,15例出现抗BP180抗体阳性和抗BP230抗体阳性,12例(30.7%)二者均阴性。我们报道的患者也比较有趣,多次检测抗BP180抗体和抗BP230抗体均为阴性,盐裂试验中显示人工水疱真皮侧、表皮侧IgG均阳性。在文献报道中,也有一些PN病例使用了多种技术均未检测到任何目标抗原,推测可能与非典型的BP中低滴度循环抗体有关,特别是针对180 kDa BP抗原的NC16a结构域[15]。有报道PN 患者可能还具有针对BMZ的其他抗原的循环抗体,如层黏连蛋白g1。2021年Maki等[16]发现在接种肺炎球菌疫苗(PPSV2)后患者血清中出现具有BP180 C末端结构域和层黏连蛋白-c1(p200)的IgG抗体,盐裂试验显示IgG与人工水疱的真皮侧、表皮侧相结合。在盐裂试验中,抗BP180抗体、抗BP230抗体和抗α6β4整合素抗体是结合在人工水疱的表皮侧,而抗层黏连蛋白332抗体、抗层黏连蛋白γ1/p200抗体和抗VIII型胶原抗体结合在人工水疱的真皮侧[17]。目前市面上检测BP抗体的ELISA试剂盒,主要针对血清样本中的BP180的NC16A结构域和BP230的N-末端结构域、中央杆状结构域和C-末端结构域的融合抗原靶点的循环抗体,其灵敏度分别是84.4%[18]和72.4%[19]。因此推测我们的患者可能出现了抗p200或BP180的非胶原结构域附近的其他远端表位,也可能是ELISA试剂盒未能识别的抗原表位抗体,如BP180的97-kDa和120-kDa新表位[20]等。因此我们还将继续深入研究,希望找到该患者的致病抗体。
我们分析的病例均接受局部和/或系统性糖皮质激素治疗,加用或不加用免疫抑制药物如:硫唑嘌呤、环磷酰胺、甲氨蝶呤、吗替麦考酚酯等,大部分具有良好的临床反应。其中1例死于肺栓塞,另1例在接受治疗时感染新冠肺炎。目前BP的治疗主要是系统应用糖皮质激素[21],但有对照研究发现局部外用强效糖皮质激素与口服糖皮质激素的疗效相当,全身不良反应更少[22]。在大疱期的患者使用四环素类药物的疗效不低于口服糖皮质激素,长期使用更安全[23]。对于一些难治性的BP,可联用免疫抑制剂比如硫唑嘌呤、环磷酰胺、甲氨蝶呤等[24],当存在糖皮质激素禁忌症时,也可以使用免疫球蛋白、血浆置换或抗CD20免疫治疗(利妥昔单抗)[25]。我们报道的病例因血糖偏高且有腿部溃疡,考虑到糖皮质激素对血糖的影响较大,故选择了系统使用雷公藤多苷、米诺环素联合局部外用强效糖皮质激素,后因效果欠佳加用了硫唑嘌呤,无新发皮疹后予外用强效糖皮质激素维持治疗。
结合文献报道及上述分析,我们推测接种新冠疫苗后出现BP的可能机制有:1、潜在遗传易感性:研究表明,BP与组织相容性复合体(MHC)II类等位基因相关,在亚洲人群中,已确定与HLA-DRβ1*04、HLA-DRβ1*1101和HLA-BDB1*0302基因有显著关联[26],发现BP180特异性的Th1和Th2细胞仅限于HLADQB1*0301等位基因[27]。在我们分析的病例中,发病年龄最小23岁,1例患者HLA等位基因是-DRβ1*01*11单倍型。推测疫苗可能激活B细胞和T细胞免疫,引发遗传易感个体的自身免疫反应[28]。2、衰老机制:我们分析的病例平均年龄为75.9岁,推测随着年龄增长出现胸腺萎缩导致免疫衰老,疫苗通过破坏原有免疫耐受导致免疫反应增强,使BMZ抗原发生改变,诱导形成新的抗BMZ抗体[16]。3、相关免疫倾向或亚临床BP:疫苗可能激活机体出现短暂的免疫旁路,刺激抗原递呈细胞和休眠的自身反应性T细胞,导致隐藏的抗原暴露从而产生针对抗原的自身抗体[29]。4、分子模拟机制:有研究发现在5例SARS-CoV-2 IgG和IgM抗体阳性的血清样本中,有3例ANA、ENA、肌动蛋白和线粒体抗体水平显著升高,认为SARS-CoV-2刺突糖蛋白或核衣壳蛋白与人体内结构相似的肽蛋白序列之间有分子模拟,会产生交叉免疫反应[30]。但另一项研究收集了24例抗SARS-CoV-2 IgG阳性的血清样本对AIBD自身抗原(Dsg1、Dsg3、包膜蛋白、BP180、BP230和VII型胶原蛋白)的抗体进行检测,结果未发现任何自身抗原抗体反应[31]。但上述研究的样本量偏小,没有长期随访,具有一定局限性。2022年一项回顾性队列研究,纳入了15万余名至少接种了1剂mRNA新冠疫苗的人群,统计显示在24周内BP的发病率约为0.004%,与未接种新冠疫苗人群的BP发病率相比无统计学差异[32]。
接种新冠疫苗后不久发生BP可能是偶然的,但疾病发作时间表明这两个事件之间可能存在关系。由于疫苗接种的益处大于其风险,临床医生应鼓励全面接种疫苗。PN和BP在临床工作中很容易被误诊,尤其是缺乏典型水疱表现的病例,我们需密切结合患者的病史、组织病理、直接及间接免疫荧光(包括盐裂试验)、自身免疫性抗体检测等以明确诊断。
