溶剂萃取对螺旋藻水热液化生物原油储存稳定性的影响
2023-05-15王影娴曹茂炅张源辉刘志丹兰维娟尹冬雪
王影娴,曹茂炅,张源辉,刘志丹,兰维娟,尹冬雪
溶剂萃取对螺旋藻水热液化生物原油储存稳定性的影响
王影娴1,曹茂炅2,张源辉3,刘志丹2※,兰维娟1,尹冬雪1
(1. 河南科技大学农业装备工程学院,洛阳 471000;2. 中国农业大学水利与土木工程学院,北京 100083; 3. 美国伊利诺伊大学香槟校区农业与生物工程系,伊利诺伊 IL61801)
为了研究生物原油所含不同组分对其储存稳定性的影响,该研究提出利用溶剂分步萃取法分离生物原油。采用螺旋藻为原料进行水热液化,利用极性不同的四氢呋喃、乙酸乙酯、丙酮和正己烷为萃取溶剂分离生物原油,以黏度和热值作为稳定性评价指标,利用热重分析仪、气相色谱质谱联用仪和傅立叶红外光谱仪分析生物原油的老化机理。结果表明:乙酸乙酯萃取得到的生物原油的黏度最低(316 mPa·s),流动性最好,且在储存过程中黏度变化率最小(78.6%),稳定性最好;利用溶剂可以分离生物原油中的重、轻组分和极性、非极性组分,生物原油的老化与极性大分子之间发生的酯化反应、聚合反应密切相关,而小分子非极性化合物的存在可显著降低生物原油的黏度,提高其流动性和稳定性;经储存后生物原油的热值降低了0.4%~6.2%,生物原油的极性组分、重组分和氮元素含量越多,黏度和热值的变化率越大。该研究可为生物质水热液化产物的定向调控及生物原油储存稳定性的提高提供参考。
稳定性;黏度;水热液化;生物原油;溶剂萃取
0 引 言
随着世界经济和社会的发展,全球化石能源消费持续增长,原油的价格居高不下,给农业的机械化发展带来了负担。与此同时,煤炭和石油能源产品燃烧带来的环境问题日益突出,温室气体的过度排放造成全球气候变暖,导致地球的气候不稳定,容易发生极端天气。中国在2020年联合国大会上提出二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和的目标,推进中国能源向绿色低碳转型发展。“十四五”期间,“清洁、低碳、安全、高效”的能源发展与转型主题更加鲜明。要实现碳达峰和碳中和,需要逐步降低化石能源的消费,同时开发清洁可再生能源,特别是生物质能,提升生物质能的消费占比,用生物质能替代化石能源,在能源的起始端实现少排,甚至不排,实现社会和农业的可持续发展[1]。
微藻作为一种水生生物质,因其光合效率高、土地利用非耕地、生长速度快、有机质丰富、具有捕获CO2的能力而受到越来越多的关注[2-3]。水热液化是一种利用高温高压将湿生物质转化为生物原油的热化学转化技术。在水热液化反应过程中,生物质的大分子首先通过解聚、断键、脱羧等作用转化为小分子,然后这些小分子再聚合为液态产物,即生物原油[4]。生物原油具有较高的热值(30.7~41.3 MJ/kg),可直接燃烧或提质后用作交通燃油,具有较大的发展潜力[5-6]。与传统化石燃料不同,生物原油含有较多的杂原子化合物,例如氧化物、氮化物等,会造成生物原油在经长期储存时会发生变质[7]。生物原油的储存稳定性是指其在不同的储存环境中保持原有物理化学性质不变的能力[8]。在实际应用过程中,为保证液体燃料的持续供应,炼油厂、加油站、发电站等都会有一定余量的燃料储存,因此液体燃料在使用之前一般会储存一段时间,或从一个地区运输到另一个地区。然而,如果这些燃料的性能在储存过程中发生了变化,将会带来不可预测的损失,如黏度增加造成的管道堵塞、酸值增加腐蚀容器、损害发动机等[9-12]。
在水热液化反应完成后一般会得到4种产物,分别是生物原油、水相产物、固体残渣和气体,其中气体可直接用气袋收集,水相产物可通过重力分离及过滤进行收集,而生物原油和固体残渣则需要通过有机溶剂通过萃取进行分离,研究表明溶剂萃取是一种高效的生物原油分离方法[13-16]。生物原油是一种复杂的混合物,包括极性化合物和非极性化合物,用于生物原油的萃取溶剂包括丙酮、乙醇、甲醇、甲基叔丁基醚、二氯甲烷、二氯乙烷、正己烷、乙醚、乙酸乙酯、苯、二硫化碳、甲苯、十六烷、氯仿、癸烷、甲氧基环戊烷、异丙醇等各种溶剂[17-21]。不同溶剂表现出不同的特征,研究发现微藻在不同萃取溶剂下的产油率为:四氢呋喃(45%)>甲苯(38%)>乙酸乙酯(31%)>丙酮(30%)>乙醚(28%)>二氯甲烷(26%)>甲醇(24%)>石油醚(13%)>正己烷(8%),其中,四氢呋喃和乙酸乙酯的极性相近,分别是4.3和4.2,但产油率差异较大,表明生物原油萃取率不仅与溶剂的极性有关,还与其化学结构、氢键、偶极-偶极相互作用等有关,并且影响生物原油化学组成的分布[13,18]。
为研究萃取溶剂的极性及种类对生物原油的理化特性及储存稳定性影响,本文以螺旋藻为原料,选取极性相近但产油率存在较大差异的四氢呋喃和乙酸乙酯、极性及产油率差异较大的丙酮和正己烷作为萃取溶剂。采用两种分步萃取过程,利用黏度、热值、沸点、气相色谱质谱(gas chromatography-mass spectrometry, GC-MS)和傅立叶红外光谱(Fourier transform infrared spectroscopy, FT-IR)对生物原油的理化特性进行表征,研究不同溶剂萃取对生物原油的储存稳定性及其老化特性影响,为制备优质生物原油及推测其老化机制提供借鉴和指导。
1 材料和方法
1.1 试验材料
试验螺旋藻藻粉购自福建福清新大泽生物技术有限公司,常温储存。螺旋藻的蛋白质、脂肪和总碳水化合物质量分数分别为70.9%±0.8%、2.5%±0.5%和20.2%±0.2%。四氢呋喃、乙酸乙酯、丙酮和正己烷均使用分析纯,购自北京蓝弋化工产品有限责任公司,4种溶剂的特性如表1所示。
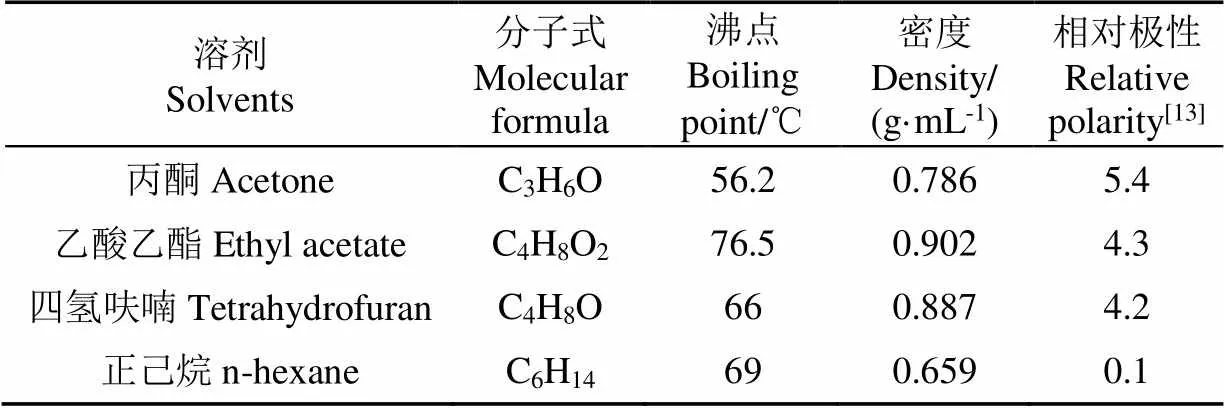
表1 萃取溶剂特性
1.2 试验流程
当螺旋藻的含水率为80%,水热反应温度为260 ℃,保留时间为60 min时,螺旋藻水热液化的产油率最高[22]。因此,本文选择此条件在1.8 L的Parr反应釜内进行螺旋藻水热液化产油试验。在进行水热液化试验时,将220 g螺旋藻与838 mL去离子水加入反应釜中,密封反应釜。向反应釜内反复充入、排放氮气至少3次以排除釜内空气,然后保持初压1 MPa进行密封性测试。确定密封性良好后加热至目标温度260 ℃,保留60 min后利用冷水循环系统进行降温,冷却至室温后,收集釜内气体并使釜内压强降为零,然后打开反应釜,收集釜内混合物,利用重力分离法分离水相和粗油[13]。为检验不同萃取溶剂对生物原油所含组分的分离效果,分别采用三步萃取法和两步萃取法对生物原油进行分离。三步萃取中以萃油率较高的四氢呋喃为第一溶剂,极性与四氢呋喃相当但萃油率低的乙酸乙酯为第二溶剂,极性较小的正己烷为第三溶剂,研究溶剂结构及极性对生物原油组分的影响。两步萃取中以高极性的丙酮为第一次溶剂,低极性的正己烷为第二溶剂,研究溶剂极性对生物原油组分的影响,并对比先前的研究,揭示生物原油的老化机理。如图1a所示,三步萃取过程首先采用四氢呋喃对粗油进行萃取,经滤纸过滤得到少量的残渣(R1),滤液为四氢呋喃相,利用自制的旋转蒸发仪将四氢呋喃相在负压条件下进行蒸馏去除四氢呋喃,然后放入真空干燥箱中,在65 ℃条件下干燥10 h,去除残余的溶剂和水分,得到的生物原油用BC11表示;然后取适量BC11,加入乙酸乙酯,混合后超声30 min,用滤纸进行过滤,滤纸上得到重油(H1),滤液为乙酸乙酯相,利用同样的蒸馏干燥方法,得到的生物原油用BC12表示;最后取适量BC12,加入正己烷,混合后超声30 min,用滤纸进行过滤,滤纸上得到的产物定义为中油(M1),滤液为正己烷相,利用同样的蒸馏干燥方法得到轻油(L1)。如图1b所示,利用同样的萃取、蒸馏和干燥方法,在两步萃取过程中得到残渣(R2)、生物原油(BC2)、中油(M2)和轻油(L2)。两种溶剂萃取过程中,所得生物原油中几乎不含残留溶剂,溶剂成分对生物原油在储存过程中的影响可以忽略。
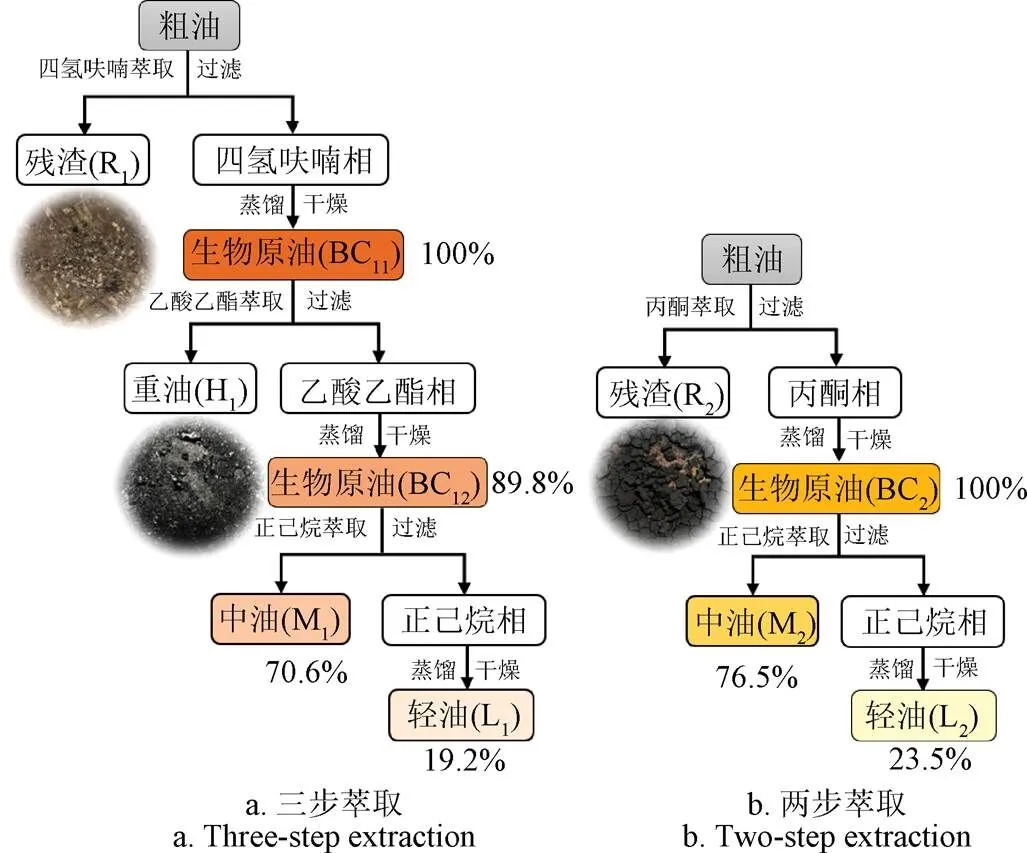
图1 生物原油的萃取过程
1.3 生物原油的储存稳定性试验
芬兰技术研究中心(Technical Research Centre of Finland, VTT)在研究热解生物油的过程中发现80 ℃条件下储存24h的黏度变化相当于室温环境下储存一年的变化,经过15 a的试验研究,两种储存条件下的黏度变化误差小于5%[23]。VTT使用的这种存储稳定性研究方法属于加速老化方法,可在短时间内获得生物油的储存稳定性,因此,本研究参考该方法,将生物原油储存在恒温80 ℃的环境下,研究不同萃取溶剂得到的生物原油的储存稳定性能。将所得生物原油储存在玻璃样品瓶内,样品瓶的顶空部分利用氮气吹扫5 min,以除去瓶内空气,避免空气与生物原油发生反应;将样品瓶用锡纸包裹避免光的照射,然后放入80 ℃的恒温箱里,通过对比生物原油在储存过程中的物理化学特性变化(外观形态、黏度、热值、沸点、化合物)来确定其稳定性。其中,黏度参数在试验的第0、3、5和7天进行测量,有机元素在第0和第7天进行测量,其余参数在第0、第5和第7天进行测量。每次取样测量前先充分搅拌样品,使其混合均匀;每个参数测量2~3次,取平均值。
1.4 生物原油特性分析方法
利用元素分析仪(Ario MICRO Cube, Element analysis system, Germany)对原料和生物原油的碳、氢、氮元素进行测量,氧元素采用差值法计算,热值利用Duolong-Berthelo公式进行计算[24]。
利用观察法在室温环境下观测生物原油的形态变化。利用NDJ-8S旋转黏度计(上海昌吉地质仪器有限公司)对生物原油的黏度进行测定,因不同温度下测量的黏度不具有比较性,因此在生物原油处于40 ℃的恒温环境下进行黏度测量。
使用气相色谱质谱联用仪(GC-MS QP2010,岛津,日本)对生物原油的化合物组成进行分析。选取DB-5气相色谱柱,以高纯氦气为载气,流速1.78 mL/min;接口温度、进样口温度及离子源温度分别为280、250及230 ℃;采用分流方法进样,分流比为20∶1。柱箱初始温度为40 ℃,保留2 min后以10 ℃/min的速率升至200 ℃后保留3 min,然后以4 ℃/min升至300 ℃,并保留6 min;采用EI源,电子能量70 eV,分子量扫描范围为50~550。
利用热重(thermogravimetry, 简称TG)分析仪(梅特勒-托利多TGA/DSC 3+)对生物原油的沸点进行测定,TG以氮气为载气,流速为25 mL/min,从室温以10 ℃/min的升温速率升至600 ℃。利用傅立叶红外光谱仪(Thermo Fisher Nicolet ls 10)对生物原油的有机官能团进行检测,光谱范围为4 000~450 cm-1,分辨率为4 cm-1,每个样本扫描次数为32次。
2 结果与分析
2.1 萃取率分析
两种分步萃取过程如图1所示。不同溶剂对生物原油的萃取率不同,在三步萃取过程中,四氢呋喃的溶解性较强,除了灰分,几乎可以溶解粗油中的所以组分。以四氢呋喃萃取得到的BC11为最高油产率100%计算,得到乙酸乙酯从BC11中萃取的BC12产率为89.8%,在滤渣中得到10.2%的重油,比较黏稠,类似煤焦油;正己烷萃取的L1产率为19.2%,在滤渣中得到M1,产率为70.6%。在两步萃取过程中,丙酮萃取的滤渣与四氢呋喃、乙酸乙酯均不同,类似焦炭,归因于丙酮极性较强,可以溶解粗油中的胶质组分[25]。以丙酮萃取得到的BC2为最高产油率100%计算,得到正己烷从BC2中萃取的L2产率为23.5%,剩余为丙酮可溶但正己烷不溶部分M2,产率为76.5%。生物原油组分复杂,含有极性和非极性化合物,两种分步萃取方法的产油率分布结果表明利用溶剂的极性和结构特点可实现生物原油的分离。由于试验中可收集的轻油质量较少,不能满足所有参数测量所需的量,并且相关研究表明轻油的储存稳定性能较好[26]。因此,本文以下分析主要以生物原油和中油为研究对象,并利用生物原油和中油的参数评估轻油的性能。
2.2 形态及黏度分析
生物原油的形态变化是评价其老化程度最直观的方法,如图2所示,在室温条件下,利用注射器针头插入生物原油液面1 cm以下,然后抬起停留2 s,观察其流动性。在储存前,不同萃取溶剂分离得到的生物原油在室温下均有较好的流动性,但随着储存时间的延长,生物原油的流动性逐渐降低。BC11和BC12经7d储存之后在室温下依然保持着流动性,但BC12的流动性明显优于BC11。相比BC11和BC12,M1表现出较差的流动性,储存2 d后几乎失去了流动性,类似松脂状态,4 d后呈沥青状态,7 d后完全固化,如同焦炭。BC2经7 d储存之后保持着一定的流动性,M2在7 d后虽然没有发生固化,但其流动性非常差,针头插入后会粘结在一起,流动不畅。

图2 生物原油在储存过程中的形态
黏度是评定生物原油储存稳定性的重要指标,黏度增加会造成流动性变差,不仅影响油品的运输性能,而且会直接影响到燃油的雾化性能。生物原油的黏度变化如图3所示,利用四氢呋喃制备的BC11的黏度最大,为1 220.7 mPa·s,因为四氢呋喃的溶解性较强,可溶解一些大分子物质,造成生物原油重油组分增多、分子量增高、黏度增加[25,27-28]。因此,利用乙酸乙酯对BC11进行萃取过滤掉重油,得到BC12的黏度相比BC11降低了74.1%,为316 mPa·s。利用正己烷对BC12进行萃取后得到的M1黏度大于BC12,小于BC11。利用正己烷对BC2进行萃取过滤掉轻油,得到M2的黏度相比BC2升高了65.8%。正己烷是一种非极性溶剂,可以萃取生物原油中的小分子、非极性化合物,小分子非极性化合物的黏度较低,对生物原油具有稀释作用,可以减少大分子之间的作用力,降低黏度[13]。M1和M2因为去除了小分子非极性化合物,所以造成其黏度高于BC12和BC2。
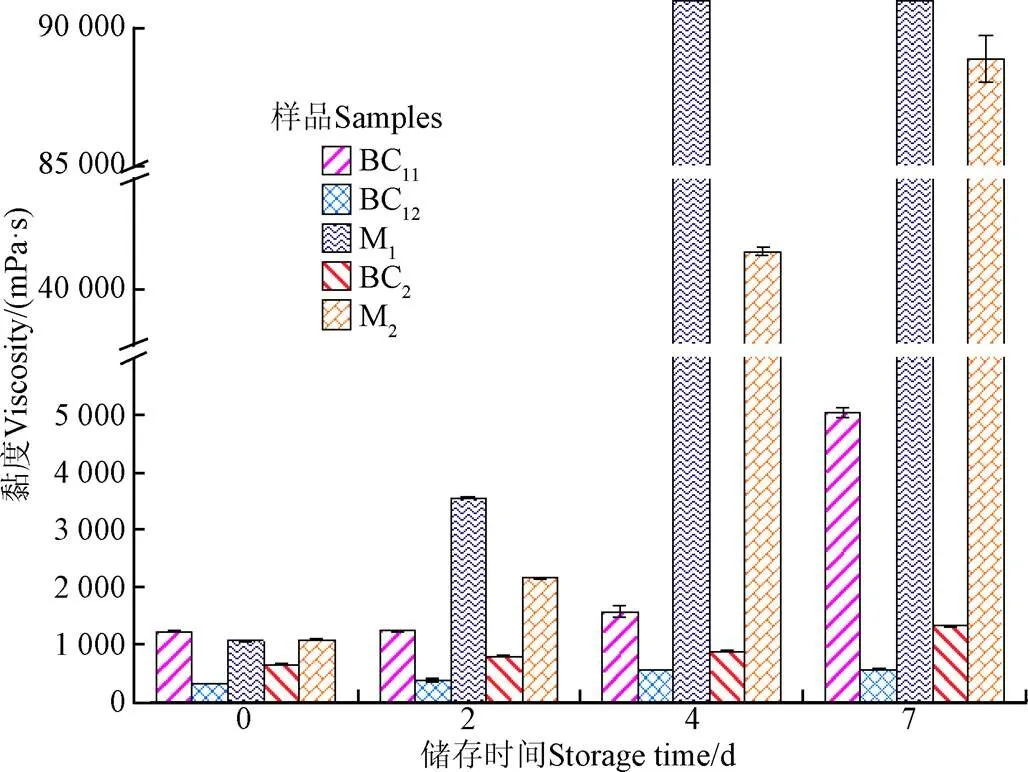
注:M1在第4天和第7天的黏度值超过黏度计最大量程,无法测量。
5种生物原油的黏度在储存过程中发生了不同程度的变化。BC11的黏度在储存前4 d变化较小,在2 d后升高了1.5%,4 d后升高了28.6%,但7 d后升高了312.8%,相比第5天升高了221.0%,表明生物原油在第5天至第7天的过程中老化反应较为剧烈。BC12的黏度最低,同时在储存过程中的变化也较小,7 d后升高了78.6%,为564.4 mPa·s,比BC11的初始黏度还低,流动性最好,表明BC12的储存稳定性较好。与形态变化相对应,M1的黏度在储存过程中发生了较大的变化,2 d后升高了236.0%,之后由于固化无法进行黏度的测量。M2的黏度变化比BC2高很多,M2的黏度在2 d后升高了100.4%,而BC2在7 d后才升高了104.4%,储存后期M2的黏度增长速度更快,7 d后增长了8 165.9%。
研究表明生物原油的黏度与分子量、链长、支链数、环结构、极性基团以及同分异构等密切相关。溶剂萃取结果表明,非极性化合物在生物原油中可以降低生物原油的黏度,同时提高其储存稳定性。生物原油缺少非极性化合物,在储存过程中易发生各种缩合、聚合反应,形成固体残渣,并且这些固体残渣或生物炭可以作为催化剂继续促进缩合、聚合反应,进而形成更多的固体残渣或生物炭[25-26, 28]。生物原油中固体残渣或生物炭的形成会堵塞下游炼制反应系统的管道,若作为农机燃油使用,可能会引起发动机的碳垢积累,给生物原油的提质和应用带来较大困难。
2.3 元素与热值分析
5种生物原油的元素分布及热值如表2所示,在萃取过程靠前阶段得到的生物原油H含量和热值较高,如BC11和BC2,萃取过程靠后阶段得到的生物原油C、O含量较高,H、N含量降低,热值有所下降,如M1和M2。相比BC11的N含量,BC12的N含量减少了0.4%,归因于重油带走了部分含氮化合物。与此同时,BC12的黏度及其变化率相比BC11降低,表明降低生物原油的N含量可以提高生物原油的流动性及其储存稳定性。相比BC12的氢含量,M1的H含量减少了1.1%,根据相似相溶原理,表明正己烷萃取BC12时可能带走了部分烃类化合物,导致其H含量降低。相比BC2,M2的H含量减少了0.9%,最终导致热值的降低。该结果表明轻组分的能量密度高于重组分,轻组分在提高生物原油的能量密度方面起着重要作用。
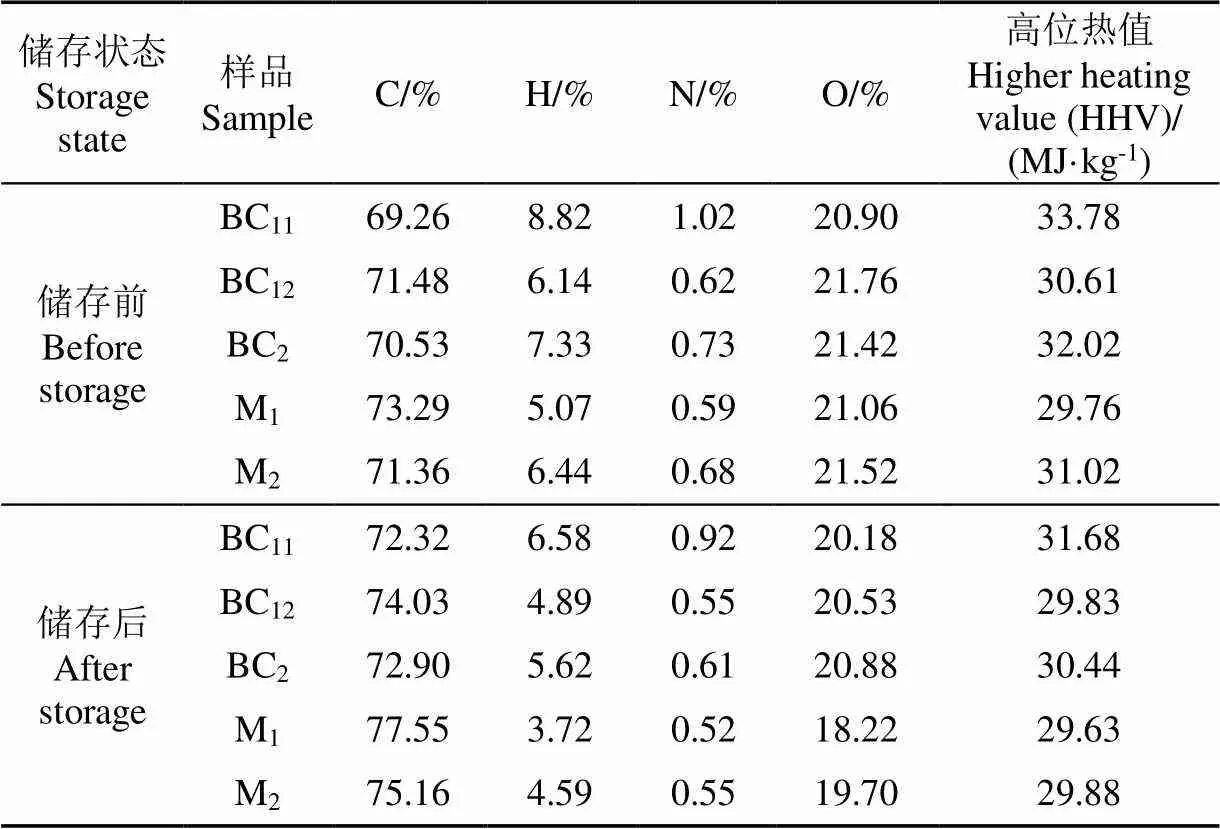
表2 不同萃取溶剂分离得到的生物原油的元素含量及热值
注:O含量为差量法计算。
Note: The content of O was calculation by difference method.
经7 d的储存之后,所有生物原油的C含量均发生了不同程度的升高(2.4%~4.3%),而H、N、O分别降低了1.3%~2.2%、0.1%~0.2%、0.5%~2.8%,表明生物原油在储存过程中由于受热发生了分子分解,而分解的小分子、低沸点化合物在样品瓶内会发生挥发和蒸发作用,使小分子化合物残留在瓶盖或在取样时运动到空气中[25]。因此,生物原油整体质量降低,而挥发的小分子化合物为碳数少、氢数多结构,并且O和N的摩尔质量较高,通过计算生物原油质量和元素摩尔质量,得出生物原油的H、N、O含量下降,C相对含量升高。由Duolong-Berthelot公式得到热值与H含量的相关性比C大,由于H含量在储存过程中的降低程度较大,所以热值在储存之后也下降(0.4%~6.2%)了。利用乙酸乙酸对BC11萃取过滤掉重油,热值变化率降低了3.7%。元素分析表明,所有生物原油在储存过程中均经历了较小程度的分子分解、挥发和蒸发作用,造成热值的降低,但热值降低幅度较小,不影响生物原油能量的保存。
2.4 沸点分布分析
利用热重(TG)对生物原油的沸点进行分析,将生物原油分成石脑油馏分(≤193 ℃)、煤油馏分(193~271 ℃)、柴油馏分(271~343 ℃)、减压柴油馏分(343~538 ℃)和残渣馏分段(>538 ℃),如图4所示。不同生物原油的沸点分布表现出较大的差异,但减压柴油馏分含量在所有生物原油中均最高。BC11的石脑油含量最高,虽然生物原油含有高分子化合物,因所含轻组分也较多,所以残渣占比并不太高。相比BC12,M1的石脑油馏分含量减少了6.2%,减压柴油含量增加了11.7%,验证了正己烷萃取BC12时带走了部分小分子非极性化合物。沸点分析也证明了利用溶剂对螺旋藻生物原油进行分步萃取分离是一种简单有效的原油分离方法,未来可根据产品用途及需求选择适当的溶剂对生物原油进行萃取分离。
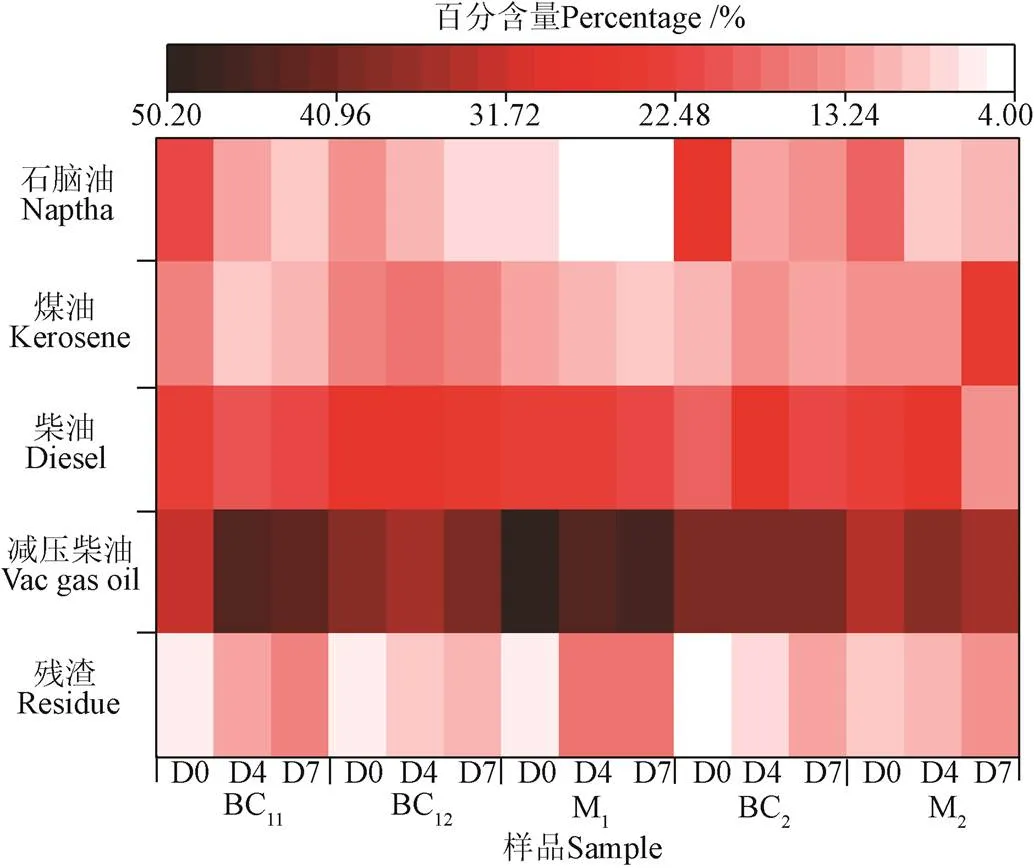
注:D0、D4、D7分别表示储存0、4、7 d。下同。
在储存过程中,所有生物原油的残渣馏分含量均随着储存时间逐渐升高,表明所有生物原油在储存过程中都会发生聚合反应,使储存之后的分子量变大,进而提高生物原油的黏度[29-31]。在三步萃取制备的样品中,M1的残渣馏分含量变化最大,在储存4 d后从5.9%升至17.3%,增加了11.4%,这与其4 d后变成固体相对应。在储存7 d后,M1的残渣馏分含量变化较小,表明M1在第5天至第7天的过程中虽然固化的更严重了,但发生分子聚合的反应微小,出现了物理凝聚或环化作用。BC11的石脑油和减压柴油馏分含量变化最大,7 d后分别降低了13.3%和11.4%,残渣馏分含量升高了9.0%。相比M1和BC11,BC12的残渣馏分含量变化最小,7 d后升高了5.3%,且减压柴油馏分含量仅升高了2.1%,表明乙酸乙酯萃取得到的BC12相对稳定,残渣对生物原油的稳定性不利,轻组分的存在有益于提高生物原油的稳定性。在两步萃取制备的样品中,BC2和M2的石脑油馏分含量先降低后升高,表明生物原油在储存过程中会经历一些分解反应。经7 d的储存之后,BC2的残渣馏分含量变化(7.4%)比M2(5.0%)大,但BC2的残渣馏分含量(11.9%)相对M2(14%)较小,表明M2在储存中不仅发生了聚合反应,同时发生了物理凝聚和环化等反应,造成其形态及黏度发生较大的变化[31-33]。生物原油所含重组分和残渣含量的增加是导致其黏度增加和固化的原因之一,在实际工程应用中,可通过实沸点蒸馏技术分离出生物原油重组分和残渣,提高生物原油的流动性和储存稳定性。
2.5 GC-MS分析
生物原油在储存前后的化合物分布如图5所示,根据沸点分析可以推测生物原油约30%~50%的化合物可被检测到。各生物原油的含氮化合物均较高,与原料螺旋藻所含高蛋白质含量有关,其次是烃类化合物,BC11和BC12的烃类化合物含量比BC2高13%以上,因此,如需提高生物原油的烃类化合物含量,可优先选择四氢呋喃和乙酸乙酯作为萃取溶剂。相比BC11,BC12的含氮化合物含量升高,醇类、酮类和酸类化合物含量减少,表明在萃取过程中乙酸乙酯可能与生物原油发生了化学反应,导致醇类、酮类或酸类化合物转化为含氮化合物。两种萃取过程中,中油的烃类含量均降低了,表明正己烷萃取时带走了部分极性较低的烃类化合物,进而导致中油的黏度高于生物原油的黏度。

图5 生物原油在储存过程中的化合物分布
在储存过程中,不同溶剂萃取得到的生物原油的化合物在储存过程中表现出不同的变化规律。BC11经储存4d后酚类化合物增加了5.2%,而沸点分布分析中发现生物原油的沸点、残渣含量及分子量在储存过程中会增高,表明酚类化合物发生了聚合反应[25,31-34]。在至第7天的过程中降低了1.3%,可能是由于酚类化合物聚合反应产生分子量较高的酚类,无法利用GC-MS检测[31]。酯类化合物的变化趋势与酚类相反,先降低后升高。在储存过程中,醇类化合物首先被氧化为中间体酸类化合物,然后通过酰化作用转化为大分子的含氮化合物,进而导致醇类化合物的降低[35-36]。BC12经储存4 d后烃类化合物降低了7.5%,含氮化合物升高了6.7%,表明烃类化合物和含氮化合物发生了烃化作用生成新的含氮化合物。酯类化合物升高了1.3%,可能发生了酯化反应。M1在储存后烃类化合物降低,酚类和含氮化合物逐渐升高。前人的研究表明生物原油所含的酚类化合物、含氮化合物不稳定,在储存过程中易形成沉淀,因此M1中酚类和含氮化合物逐渐升高是造成其固化的主要原因[25]。同时M1中酸类和醇类化合物因为发生酯化反应造成其含量减少,而生成的酯类化合物会互相发生酯缩合反应生成更高分子量的酯类化合物。两步萃取中,经储存后,BC2的酮类化合物含量减少,酯类化合物增多,可能是因为酮类化合物在储存过程中发生分子重排,合成酯类化合物。M2经储存4 d后烃类、酮类和酯类化合物迅速增加,而7 d后又降低了。M2的酸类化合物可通过自由基反应转化为烃类化合物,而烃类化合物为不饱和烃,易发生断键重排反应,可与含氮化合物反应生成新的含氮化合物。根据醇类和酸类化合物的降低,酯类化合物的升高可归因于酯化反应,含氮化合物发生脱酰胺转化为酮类。
生物原油中含有较多的不饱和杂原子化合物,这些杂原子均不稳定,为提高生物原油的稳定性,可通过催化加氢、乳化、添加抗老化剂、表面活性剂等方式提高生物原油的饱和度,制备烃类化合物含量高、性能稳定的生物原油[32-34]。
2.6 FT-IR分析
生物原油组分复杂,GC-MS分析结果不能表征生物原油的全部特征。与GC-MS分析相比,FT-IR分析可以比较全面地检测生物原油的“整体”特征。对5种生物原油及其在萃取过程中产生的重油残渣进行FT-IR分析,每个样品的峰值波数及对应的化合物如表3所示。

表3 生物原油的傅里叶红外曲线对应的峰值波数、官能团和化合物
所有样品在3 600~3 000 cm-1(O-H)和3 000~2 800 cm-1(C-H)均有出峰,表明所有样品均含有醇类、酚类、酸类和脂肪族化合物。H1在1 555 cm-1处的峰来自N-H伸缩,表明其含有含氮化合物,验证了乙酸乙酯在萃取BC11时过滤的重油带走了部分含氮化合物。R2在1 660和1 453 cm-1的C=C伸缩分别来自烯类和芳香环化合物,表明利用丙酮萃取时带走了部分不饱和化合物。如表3所示,两组生物原油在用正己烷萃取后得到的M1和M2在680~610 cm-1之间的峰消失了,该处的峰来自炔烃的C-H振动,表明在用正己烷萃取时可带走生物原油的炔烃类化合物。BC11在967 cm-1(C-O)的峰来自酚类化合物,在898 cm-1(C-O-O-C)的峰来自过氧化物,经乙酸乙酯萃取后,这些峰均消失了,表明酚类和过氧化物是BC11黏度较大的原因之一。
图6为生物原油及其在储存过程中的FT-IR光谱图,图中标记了各生物原油在储存过程中发生的峰值变化。在三步萃取制备的样品中,BC11的光谱曲线变化较小,在1 060 cm-1(C-N)和967 cm-1(C-O)处的峰变弱了,表明BC11的胺类化合物与酚类、醇类、酸类化合物发生反应转化为了酰胺类化合物。BC12在1 372 cm-1(O-H)处的峰降低,在1 238 cm-1(C-O)和1 045 cm-1(C-N)处的峰升高,表明醇类化合物通过酰化作用转化为大分子的胺类化合物,同时产生了中间体酸类化合物[35]。M1在1 371 cm-1(O-H)、1 238 cm-1(C-O)、1 045 cm-1(C-N)处的峰在第5天检测时就降低了,表明M1在储存过程中的性能不稳定,在储存过程中易发生酯化反应、酯缩合反应和聚合反应,导致分子量增加、支链变多,进而导致其发生固化,变成焦炭或生物炭,与GC-MS分析结果一致。在两步萃取制备的样品中,BC2的FT-IR光谱曲线在储存前4 d变化较小,7 d后在1 360 cm-1(O-H)和1 220 cm-1(C-O)处的峰发生了降低,表明BC2发生了酯化反应。在储存4 d后,M2在1 047 cm-1(C-N)处的峰显著增加,7 d之后又消失了,表明胺类化合物是M2在储存过程中产生的中间体,老化反应会随着时间继续发生。因水热液化生物原油含有较多的醇类和酸类化合物,酯化反应是生物原油在储存过程中比较广泛的老化反应,在水热液化过程中可通过使用甲醇或乙醇作为反应溶剂减少酸类化合物的生成,进而减缓生物原油的老化。
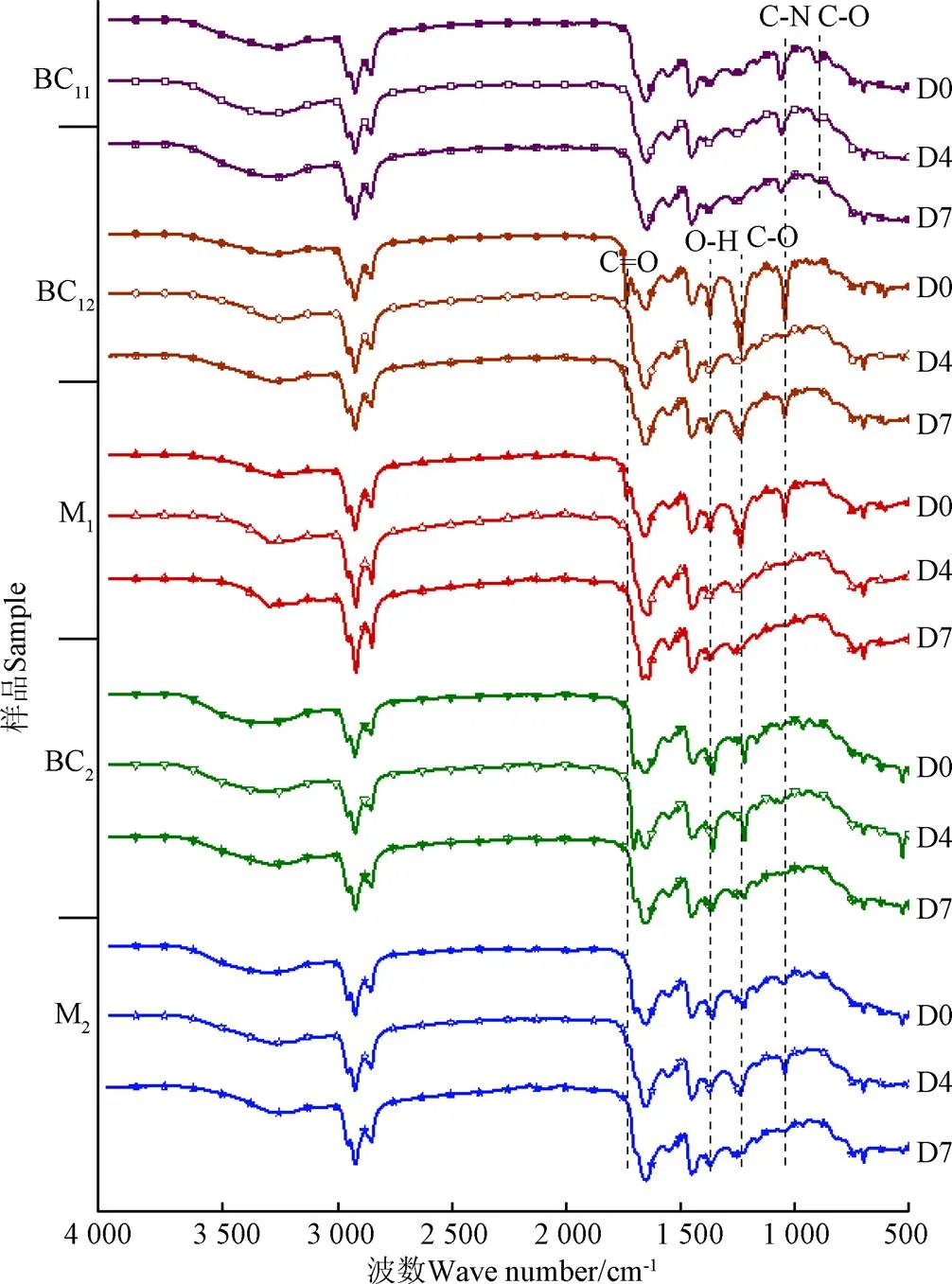
图6 生物原油在储存过程中的FT-IR分析
3 结 论
1)用乙酸乙酯萃取的生物原油,黏度较低,为316 mPa·s,流动性较好,在储存过程中的黏度变化较小,为78.6%,储存稳定性相对较好。
2)利用乙酸乙酸对BC11萃取过滤掉重油,黏度降低了74.1%,利用正己烷对BC2萃取过滤掉轻油,黏度升高了65.8%。重油中的大分子极性化合物会增加生物原油的黏度,轻油中的小分子非极性化合物的存在可显著降低生物原油的黏度,提高其流动性和储存稳定性。
3)生物原油所含的大分子极性化合物主要是含氮氧杂原子物质,约70%,这些物质易发生酯化反应和聚合反应导致生物原油稳定性变差。
4)经储存后生物原油的热值降低了0.4%~6.2%,利用乙酸乙酸对BC11萃取过滤掉重油,N含量降低了0.4%,热值变化率降低了3.7%,表明利用溶剂萃取的方法可以减少生物原油中的氮原子含量,提高燃油的清洁性。同时,为提高生物原油的储存稳定性,未来可耦合实沸点蒸馏和催化加氢技术,提高生物原油各方面的性能。
[1] 王芳,刘晓风,陈伦刚,等. 生物质资源能源化与高值利用研究现状及发展前景[J]. 农业工程学报,2021,37(18):219-231.
WANG Fang, LIU Xiaofeng, CHEN Lungang, et al. Research status and development prospect of energy and high value utilization of biomass resources[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(18): 219-231. (in Chinese with English abstract)
[2] AYUB H M U, AHMED A, LAM S S, et al. Sustainable valorization of algae biomass via thermochemical processing route: An overview[J]. Bioresource Technology, 2022, 344: 126399.
[3] ZHANG W, LI J, LIU T, et al. Machine learning prediction and optimization of bio-oil production from hydrothermal liquefaction of algae[J]. Bioresource Technology, 2021, 342: 126011.
[4] 申瑞霞,赵立欣,冯晶,等. 生物质水热液化产物特性与利用研究进展[J]. 农业工程学报,2020,36(2):266-274.
SHEN Ruixia, ZHAO Lixin, FENG Jing, et al. Research progress on characteristics and utilization of products from hydrothermal liquefaction of biomass[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(2): 266-274. (in Chinese with English abstract)
[5] LEE T H, YANG Z, ZHANG Y, et al. Investigation of combustion and spray of biowaste based fuel and diesel blends[J]. Fuel, 2020, 268: 117382.
[6] OBEID F, VAN T C, HORCHLER E J, et al. Engine performance and emissions of high nitrogen-containing fuels[J]. Fuel, 2020, 264: 1-11.
[7] 张冀翔,蒋宝辉,王东,等. 微藻水热液化生物油化学性质与表征方法综述[J]. 化工学报,2016(5):1644-1653.
ZHANG Jixiang, JIANG Baohui, WANG Dong, et al. Chemical properties and characterization methods for hydrothermal liquefaction bio-crude from microalgae: A review[J]. CIESC Journal, 2016(5):1644-1653. (in Chinese with English abstract)
[8] HUYEN N L, CECILIA M, AMAND L E, et al. Storage stability of bio-oils derived from the catalytic conversion of softwood kraft lignin in subcritical water[J]. Energy & Fuels, 2016, 30: 3097-3106.
[9] YANG Z, KUMAR A, HUHNKE R L. Review of recent developments to improve storage and transportation stability of bio-oil[J]. Renewable & Sustainable Energy Reviews, 2015, 50: 859-870.
[10] HU H, LUO Y, ZOU J, et al. Exploring aging kinetic mechanisms of bio-oil from biomass pyrolysis based on change in carbonyl content[J]. Renewable Energy, 2022, 199: 782-790.
[11] XU J, BRODU N, ABDELOUAHED L, et al. Investigation of the combination of fractional condensation and water extraction for improving the storage stability of pyrolysis bio-oil[J]. Fuel, 2022, 314: 123019.
[12] MOSTAFAZADEH K A, SOLOMATNIKOVA O, DROGUI P, et al. A review of recent research and developments in fast pyrolysis and bio-oil upgrading[J]. Biomass Conversion and Biorefinery, 2018, 8(3): 739-773.
[13] YANG X, LYU H, CHEN K, et al. Selective extraction of bio-oil from hydrothermal liquefaction of salix psammophila by organic solvents with different polarities through multistepextraction separation[J]. Bioresources, 2014, 9(3): 5219-5233.
[14] 耿风华,张睿,刘海燕,等. 生物油组分分离与化学品提取的研究进展[J]. 化工进展,2021, 40(12):1-21.
GENG Fenghua, ZHANG Rui, LIU Haiyan, et al. Progress in the separation of components and extraction of chemicals from bio-oils[J]. Chemical Industry and Engineering Progress, 2021, 40(12): 1-21. (in Chinese with English abstract)
[15] CHAND R, BORUGADDA V B, QIU M, et al. Evaluating the potential for bio-fuel upgrading: A comprehensive analysis of bio-crude and bio-residue from hydrothermal liquefaction of agricultural biomass[J]. Applied Energy, 2019, 254: 113679.
[16] 唐晓寒,杨晓奕. 微拟球藻油脂萃取及脱脂藻水热液化[J]. 化工学报,2019,70(11):4356-4362.
TANG Xiaohan, YANG Xiaoyi. Lipids extraction of Nannochloropsis and hydrothermal liquefaction of defatted Nannochloropsis[J]. CIESC Journal, 2019, 70(11): 4356-4362. (in Chinese with English abstract)
[17] WATSON J, LU J, SOUZA R, et al. Effects of the extraction solvents in hydrothermal liquefaction processes: Biocrude oil quality and energy conversion efficiency[J]. Energy, 2019, 167: 189-197.
[18] DJANDJA O S, WANG Z, CHEN L, et al. Progress in hydrothermal liquefaction of algal biomass and hydrothermal upgrading of the subsequent crude bio-oil: A mini review[J]. Energy & Fuels, 2020, 34(10): 11723-11751.
[19] LU J, LIU Z, ZHANG Y, et al. 110th Anniversary: Influence of solvents on biocrude from hydrothermal liquefaction of soybean oil, soy protein, cellulose, xylose, and lignin, and their quinary mixture[J]. Industrial & Engineering Chemistry Research, 2019, 58(31): 13971-13976.
[20] JIANG J, SAVAGE P E. Using solvents to reduce the metal content in crude bio-oil from hydrothermal liquefaction of microalgae[J]. Industrial & Engineering Chemistry Research, 2019, 58(50): 22488-22496.
[21] 王影娴,吴向阳,王猛,等. 厕所粪便与粗甘油共液化制备生物原油研究[J]. 农业工程学报,2019,35(22):181-186.
WANG Yingxian, WU Xiangyang, WANG Meng, et al. Biocrude oil production via co-liquefaction of toilet feces and crude glycerol[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(22): 181-186. (in Chinese with English abstract)
[22] TANG X, ZHANG C, LI Z, et al. Element and chemical compounds transfer in bio-crude from hydrothermal liquefaction of microalgae[J]. Bioresource Technology, 2016, 202: 8-14.
[23] OASMAA A, FONTS I, PELAEZ-SAMANIEGO M R, et al. Pyrolysis oil multiphase behavior and phase stability: A review[J]. Energy & Fuels, 2016, 30(8): 6179-6200.
[24] LU J, LIU Z, ZHANG Y, et al. Synergistic and antagonistic interactions during hydrothermal liquefaction of soybean oil, soy protein, cellulose, xylose, and lignin[J]. ACS Sustainable Chemistry & Engineering, 2018,6(11):14501-14509.
[25] WANG Y, ZHANG Y, LIU Z. Effect of aging in nitrogen and air on the properties of biocrude produced by hydrothermal liquefaction of[J]. Energy & Fuels, 2019, 33(10): 9870-9878.
[26] TAGHIPOUR A, HORNUNG U, RAMIREZ J A, et al. Fractional distillation of algae based hydrothermal liquefaction biocrude for co-processing: Changes in the properties, storage stability, and miscibility with diesel[J]. Energy Conversion and Management, 2021, 236: 114005.
[27] ABDUL JAMEEL A G, KHATEEB A, ELBAZ A M, et al. Characterization of deasphalted heavy fuel oil using APPI (+) FT-ICR mass spectrometry and NMR spectroscopy[J]. Fuel, 2019, 253: 950-963.
[28] SONG L, OUYANG Y, HUANG S, et al. Insight into liquefaction process of sawdust with hydrogen donor solvents[J]. Biomass and Bioenergy, 2022, 160: 106444.
[29] LIU G, DU H, SAILIKEBULI X, et al. Evaluation of storage stability for biocrude derived from hydrothermal liquefaction of microalgae[J]. Energy & Fuels, 2021, 35(13): 10623-10629.
[30] PALOMINO A, GODOY-SILVA R D, RAIKOVA S, et al. The storage stability of biocrude obtained by the hydrothermal liquefaction of microalgae[J]. Renewable Energy, 2020, 145: 1720-1729.
[31] WANG Y, ZHANG Y, YOSHIKAWA K, et al. Effect of biomass origins and composition on stability of hydrothermal biocrude oil[J]. Fuel, 2021, 302: 121138.
[32] JIA T, ZHANG X, LIU Y, et al. A comprehensive review of the thermal oxidation stability of jet fuels[J]. Chemical Engineering Science, 2021, 229: 116157.
[33] Ahmed Ayyash, Esin Apaydın Varol, Murat Kılıç, et al. Influence of aging on the rheological behavior and characteristics of bio-oil produced from olive pomace via slow pyrolysis[J/OL]. Biomass Conversion and Biorefinery, 2022-07-29. https://doi.org/10.1007/s13399-022-03096-7.
[34] JO H, VERMA D, KIM J. Excellent aging stability of upgraded fast pyrolysis bio-oil in supercritical ethanol[J]. Fuel, 2018, 232: 610-619.
[35] MOGHADDAM M J, CAMPO L D, KIRBY N, et al. Chelating DTPA amphiphiles:Ion-tunable self-assembly structures and gadolinium complexes[J]. Physical Chemistry Chemical Physics, 2012, 14(37): 12854.
[36] ISHCHENKO A, PENG L, ZINOVEV E, et al. Chemically stable lipids for membrane protein crystallization[J]. Crystal Growth & Design, 2017, 17(6): 3502-3511.
Effects of solvent extraction on the storage stability of bio crude produced by hydrothermal liquefaction of
WANG Yingxian1, CAO Maojiong2, ZHANG Yuanhui3, LIU Zhidan2※, LAN Weijuan1, YIN Dongxue1
(1,471000,; 2.,,100083,; 3.,,)
Hydrothermal liquefaction (HTL) can convert wet biomass into biocrude, particularly with a comparable energy content with petroleum. The biocrude can be refined as fuel oils in farming machinery, cars, trains, ships, or planes. However, the biocrude from HTL is a complex mixture of oxygen and nitrogen, including phenols, alcohols, acids, esters, ketones, and amines. The biocrude is too tricky to be used, due to its high viscosity and low stability during storage. The extraction solvent is one of the most influencing factors to affect the biocrude yield and oil properties. Also, solvent extraction can serve as an efficient way to separate the biocrude. In this study, the multistep extraction was proposed to separate the biocrude into some components with different polarities, and then to analyze the effects of different components on the storage stability of biocrude.was used as the feedstock for the HTL under the optimal reaction condition (reaction temperature: 260°C, retention time: 60 min, and total solid: 20%) from the previous study. Tetrahydrofuran, ethyl acetate, acetone, and n-hexane were used as the extraction solvents to separate the biocrude. Those solvents were chosen, depending on their polarity and ability to extract the biocrude yield. An accelerated aging test was carried out to investigate the effects of different extraction solvents on the storage stability of biocrude. The results showed that the multistep extraction performed the best to separate the biocrude into heavy, mild, and light oil. The BC12extracted from ethyl acetate presented the lowest viscosity (316 mPa·s), the best fluidity, the lowest viscosity change rate (78.6%), and the best stability during storage. Once the n-hexane was used to separate the BC12into M1and L1, the viscosity of M1was higher than that of BC12. There was a high viscosity change rate of M1, and then the fluidity was lost after four days of storage, even finally became the biochar was after seven days. The M2also showed a higher viscosity and lower fluidity than the BC2extracted by acetone. TG, GC-MS, and FT-IR analysis revealed that the solidification of M1was closely related to the esterification, polymerization, and physical condensation. The better storage stability of biocrude was achieved in the absence of the high polar and heavy components. The biocrude aging was attributed to the severe polymerization in the components of heavy oil, including many macromolecular compounds, such as phenols and nitrogenous compounds. Element analysis indicated that the heavy oils were likely to contain more N, where the light oils contained more H. The higher heating value (HHV) changing rate of biocrude increased with the increase of N content, where the HHV of biocrude decreased by 0.4%-6.2% after storage. The solvent extraction removed the macromolecular compounds, and reduced the heteroatomic content in the biocrude, leading to improve storage stability of the biocrude. The presence of small non-polar compounds significantly reduced the viscosity of biocrude for better fluidity and storage stability. From the perspective of the oil quality, the low polar and light components of biocrude shared better storage stability than the high polar and heavy components, which can be used as transportation fuels. The heavy component can be used as asphalt or boiler fuel. The biocrude can be separated by distillation to produce different products in future industrial production.
stability; viscosity; hydrothermal liquefaction; biocrude; solvent extraction
10.11975/j.issn.1002-6819.202301032
TK6
A
1002-6819(2023)-05-0175-09
王影娴,曹茂炅,张源辉,等. 溶剂萃取对螺旋藻水热液化生物原油储存稳定性的影响[J]. 农业工程学报,2023,39(5):175-183.doi:10.11975/j.issn.1002-6819.202301032 http://www.tcsae.org
WANG Yingxian, CAO Maojiong, ZHANG Yuanhui, et al. Effects of solvent extraction on the storage stability of bio crude produced by hydrothermal liquefaction of[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2023, 39(5): 175-183. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.202301032 http://www.tcsae.org
2023-01-10
2023-02-16
河南科技大学博士科研启动基金(13480041);国家自然科学基金(52261145701);中国农业大学2115人才培育发展计划
王影娴,博士,讲师,研究方向为生物质能源。Email:wyxian2021@163.com
刘志丹,博士,教授,博士生导师,研究方向为环境增值能源、生物质能源技术。Email:zdliu@cau.edu.cn
中国农业工程学会高级会员:刘志丹(E041200655S)
