血管内皮功能指标与子痫前期严重程度关系及对孕妇流产预测效能研究
2023-05-13朱俊美
崔 静,朱俊美,张 燕
(1.西安经开妇幼医院产科,陕西 西安 710018;2.陕西省康复医院妇产科,陕西 西安 710061;3.西安国际医学中心医院产二科,陕西 西安 710100)
子痫前期是妊娠中晚期最常见的并发症之一,以新发高血压、蛋白尿为主要特征,病情持续性进展,是导致孕妇流产的重要因素[1]。关于子痫前期的病因、发病机制均未确切,缺乏特别有效的治疗手段,临床主要根据子痫前期的严重程度,予以相应强度的治疗干预,目的是控制病情进展,改善妊娠结局。一直以来,临床主要依据尿蛋白检测、常规血液检查、肝肾功能测定等用于评估子痫前期严重程度,指导临床治疗,然而上述检查结果的影响因素较多,未能阐释子痫前期的病理机制[2]。越来越多学者更青睐于寻找与子痫前期发病机制密切相关的指标,旨在量化评价病情严重程度,更准确地预测流产发生,指导疾病的诊治。国内外最新研究[3-4]表明,子痫前期的发病很可能起源于胎盘的病理改变,进一步导致孕妇全身血管内皮功能损伤,触发血管痉挛,引起高血压、脏器损伤等一系列症状。可溶性细胞内皮因子(soluble endoglin,sEng)、可溶性血管内皮生长因子受体-1(soluble fms-like tyrosine kinase receptor-1,sFlt-1)、内皮素-1(Endothelin-1,ET-1)和血管内皮生长因子(Vascular endothelial growth factor,VEGF)均是反映血管内皮功能的核心指标,有理由认为,血管内皮功能指标(sEng、sFlt-1、ET-1和VEGF)独立于尿蛋白检测等传统指标,在子痫前期的病情及预后评估中具有广阔的应用前景[5]。本研究以sEng、sFlt-1、ET-1和VEGF评价血管内皮功能,旨在分析血管内皮功能指标与子痫前期严重程度的关系及对流产的预测效能。
1 资料与方法
1.1 一般资料 选择2020年1月至2022年1月我院收治的114例子痫前期孕妇为观察组,年龄22~46岁,平均(29.15±4.86)岁;产次0~3次,平均(1.89±0.65)次;孕前体重指数17~29 kg/m2,平均(23.85±1.27)kg/m2;孕周20~39周,平均(29.86±2.34)周;根据临床表现的严重程度,分为轻度子痫前期组(79例)和重度子痫前期组(35例)。另选同期在我院接受产检的正常孕妇为对照组,年龄21~45岁,平均(28.87±4.75)岁;产次0~4次,平均(1.91±0.58)次;孕前体重指数18~30 kg/m2,平均(23.96±1.34)kg/m2;孕周21~41周,平均(30.12±1.98)周;两组孕妇一般资料比较均无统计学差异(均P>0.05)。病例纳入标准:年龄20~50岁;单胎妊娠;子痫前期孕妇符合中华医学会妇产科学分会妊娠期高血压疾病学组颁布《妊娠期高血压疾病诊治指南(2020)》关于此病的诊断标准[6],对照组孕妇规律产检且结果正常;经医院伦理委员会审批同意,所有孕妇自愿参与入组,配合研究。排除标准:既往患有严重高血压者;合并严重的肝、肾、肺功能衰竭者;近期服用改善血管内皮功能的药物者;患有可影响血管内皮功能、尿蛋白水平的疾病者。
1.2 检测方法 对照组孕妇在入组24 h及观察组孕妇在确诊时及产后24周时,抽取空腹静脉血5 ml,离心处理15 min,转速为3000 r/min,分离提取血清,储存在-80 ℃冰箱中,待测。使用美国BIO-RAD伯乐-550型全自动酶标仪,通过酶联免疫吸附法检测血管内皮功能指标(sEng、sFlt-1、ET-1和VEGF)在血清中的表达水平,检测试剂盒均购自上海酶联生物科技有限公司(批号ml060112、ml038106、ml025100、ml064255)。在对照组孕妇在入组24 h及观察组孕妇在确诊时,采集24 h尿量,使用美国贝克曼AU2700全自动生化分析仪进行24 h尿蛋白定量检测。
1.3 观察指标 比较观察组与对照组、轻度子痫前期组与重度子痫前期组的血清sEng、sFlt-1、ET-1和VEGF水平,分析子痫前期孕妇确诊时及产后的血清sEng、sFlt-1、ET-1和VEGF水平变化情况,使用Pearson相关性分析子痫前期孕妇血管内皮功能指标与24 h尿蛋白水平的关系;随访观察子痫前期孕妇的流产发生情况,使用受试者工作特征(ROC)曲线分析血清sEng、sFlt-1、ET-1联合VEGF 对子痫前期孕妇发生流产的预测效能。
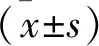
2 结 果
2.1 两组血管内皮功能指标比较 观察组血清sEng、sFlt-1、ET-1水平均高于对照组,VEGF水平低于对照组(均P<0.05),见表1。
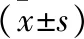
表1 两组血管内皮功能指标比较
2.2 轻度子痫前期组与重度子痫前期组血管内皮功能指标比较 重度子痫前期组确诊时血清sEng、sFlt-1、ET-1水平均高于轻度子痫前期组,VEGF水平低于轻度子痫前期组(均P<0.05),见表2。
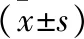
表2 轻度子痫前期组与重度子痫前期组血管内皮功能指标比较
2.3 观察组子痫前期孕妇确诊时与产后血管内皮功能指标比较 在观察组114例子痫前期孕妇中,产后24周获得随访并配合血管内皮功能指标检测共107例,占93.86%;观察组产后血清sEng、sFlt-1、ET-1水平较确诊时明显降低,VEGF水平较确诊时明显升高(均P<0.05),见表3。
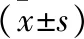
表3 观察组子痫前期孕妇确诊时与产后血管内皮功能指标比较
2.4 子痫前期孕妇血管内皮功能指标与24 h尿蛋白水平的相关性 观察组确诊时24 h尿蛋白水平为(2.46±0.92)g,大于对照组的(0.24±0.11)g(P<0.05);经Pearson相关性分析,观察组确诊时24 h尿蛋白水平与血清sEng、sFlt-1、ET-1水平呈正相关(r=0.287、0.316、0.347,均P<0.05),与VEGF水平呈负相关(r=-0.225,P<0.05)。
2.5 子痫前期孕妇血管内皮功能指标预测流产的ROC曲线 观察组114例子痫前期孕妇中,流产发生率为8.77%(10/114);经ROC曲线分析,血清sEng、sFlt-1、ET-1、VEGF预测子痫前期孕妇发生流产的AUC分别为0.624(敏感度为71.23%、特异度为74.61%,95%CI:0.327~0.920)、0.638(敏感度为69.42%、特异度为70.46%,95%CI:0.379~0.897)、0.629(敏感度为69.42%、特异度为71.24%,95%CI:0.331~0.926)、0.638(敏感度为65.64%、特异度为68.93%,95%CI:0.378~0.870),四者联合预测的AUC为0.943(敏感度为89.75%、特异度为91.37%,95%CI:0.000~1.000),大于单一指标的AUC,见图1。
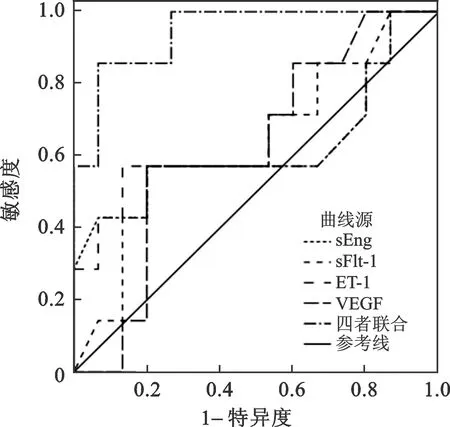
图1 血管内皮功能指标预测子痫前期孕妇流产ROC曲线
3 讨 论
子痫前期可导致母儿发生严重并发症,除终止妊娠外,尚缺乏特别有效的治疗方法,准确地评估病情及预后,选择最佳治疗方案和终止妊娠时机,对控制病情和延长孕周具有重要的临床意义。在子痫前期的发病过程中,伴随着全身小动脉痉挛,并且血管内皮功能损伤发生在子痫前期出现典型症状之前,国内外研究认为,血管内皮功能损伤累及全身血管,降低血管顺应性,可能是子痫前期发病的关键环节[7-8]。由此认为,血管内皮功能指标异常与子痫前期的病情演变密切相关。sEng、sFlt-1、ET-1均可促进血管收缩,抑制VEGF生成,阻碍血管内皮修复,均是无创反映血管内皮功能的重要指标[9-10],本研究以sEng、sFlt-1、ET-1和VEGF评价子痫前期孕妇的血管内皮功能作为切入点,并且与正常孕妇比较,结果显示:观察组确诊时血清sEng、sFlt-1、ET-1水平均高于对照组,VEGF水平低于对照组;与此同时,观察组产后血清sEng、sFlt-1、ET-1水平较确诊时明显降低,VEGF水平较确诊时明显升高;与Ives等[11]的研究结果相符,说明了子痫前期孕妇存在血管内皮功能受损,血清sEng、sFlt-1、ET-1和VEGF水平均与病情演变有关,这可能与子痫前期孕妇机体炎症免疫过度激活,来源于胎盘的炎性介质增多,导致血管内皮损伤有关。由此推测,血管内皮功能损伤导致孕妇血管舒张与收缩因子失衡,抑制子宫肌层螺旋小动脉重铸,导致螺旋动脉狭窄,胎盘血液灌注减少,可能是子痫前期的发病机制之一。
随着子痫前期的进展,发生严重并发症的风险随之增大,这可能与血管内皮功能持续损伤,血管痉挛收缩增强有关[12]。Cerdeira等[13]研究表明血管内皮功能损伤是促进子痫前期病情发展至子痫的机制。在本研究中,重度子痫前期组确诊时血清sEng、sFlt-1、ET-1水平均高于轻度子痫前期组,VEGF水平低于轻度子痫前期组,提示重度子痫前期孕妇血清sEng、sFlt-1、ET-1水平更高,VEGF水平更低,存在明显的血管内皮功能损伤,出现这种病理改变很可能与子痫前期孕妇机体蓄积的炎性反应和氧化应激,加重血管内皮细胞损伤[14]。值得注意的是,也有研究显示,重度子痫前期孕妇血管内皮功能并不必然低于轻度子痫前期[15],与本研究结果不同,究其原因,考虑在于轻度和重度子痫前期均只代表确诊时的状态。鉴于任何程度的子痫前期可能存在血管内皮功能损伤,且蛋白尿是判断病情严重的重要依据[16]。对此,本研究使用Pearson相关性分析,发现观察组确诊时24 h尿蛋白水平与血清sEng、sFlt-1、ET-1水平呈正相关,与VEGF水平呈负相关,进一步说明了血管内皮功能指标与子痫前期严重程度密切相关。分析原因,考虑在于子痫前期的病情进展依赖血管内皮功能损伤介导的血管痉挛,在血管内皮功能损伤加剧的同时,导致肾损伤更严重,24 h尿蛋白水平升高。由此可见,子痫前期与血管内皮功能损伤互为因果,相互促进病情进展,形成恶性循环,有必要监测子痫前期孕妇的血管内皮功能指标,根据血管内皮功能的变化情况,评估子痫前期严重程度,有助于为制定治疗方案提供依据。
尽管子痫前期孕妇的血压控制效果较佳,仍有较高的流产发生率,若提前准确地评估流产发生风险,具有重要的临床意义[17]。既往研究表明,发生流产的子痫前期孕妇往往存在胎盘血流不足、子宫螺旋动脉微血栓形成等病理改变,与血管内皮功能损伤导致血管通透性增大有关[18-19]。本研究初步验证了血管内皮功能指标与子痫前期严重程度的关系,预示着病情严重的子痫前期孕妇血管内皮功能指标异常明显时,孕妇发生流产的风险可能显著增大。通过ROC曲线分析结果显示:血清sEng、sFlt-1、ET-1联合VEGF预测子痫前期孕妇发生流产的AUC为0.943,大于单一指标的AUC;说明血清sEng、sFlt-1、ET-1达到明显升高和VEGF明显降低的程度后,子痫前期孕妇发生流产的风险较大,这可能与血管内皮功能损伤影响胎盘血管重铸,减少胎盘血流灌注,导致胎儿发育异常,介导流产发生有关。Brunt等[20]研究发现,血管内皮功能损伤引起血管舒张因子分泌减少,血管收缩因子分泌增加,增强全身血管收缩,可能是子痫前期孕妇发生流产的重要原因,亦佐证了本研究观点。基于本研究结果,结合笔者临床实践,认为在子痫前期的围产期管理中,应对孕妇的血管内皮功能指标持续保持关注,不断评估病情,时刻警惕流产发生,积极予以治疗。因此,在子痫前期的发病初期,改善孕妇的血管内皮功能,有望成为治疗子痫前期的新靶点,能否减少流产发生,需要日后深入研究予以验证。 本研究的局限性为样本量不多,未分析治疗方案对其血管内皮功能的影响;另外,产后随访时间不长,未观察子痫前期孕妇血管内皮功能与远期心脑血管疾病的关系,有待日后扩大研究规模,深入分析孕期触发遗传因素对孕妇血管内皮功能的影响,进一步明确子痫前期与血管重构的关系及其发生血管内皮功能损伤的机制。
综上所述,子痫前期孕妇存在血管内皮功能受损,血清sEng、sFlt-1、ET-1和VEGF对评估病情严重程度、联合预测流产发生均具有重要意义,且血管内皮功能指标的检测具有操作简便、无创、廉价等优点,适用于产检,为子痫前期的早期诊断、病情评估提供新途径。
