拉帕替尼治疗HER2阳性局部晚期乳腺癌临床疗效研究
2023-05-13张慧峰许淑娣
张慧峰,李 茉,许淑娣,白 跳
(西安市第九医院,陕西 西安 710054)
乳腺癌是女性高发的恶性肿瘤之一,约占全身恶性肿瘤的7%~10%[1-2]。近年来,乳腺癌的发病率迅速升高,年轻化趋势更加突出,对妇女的身心健康构成严重威胁[3]。流行病学调查[4]显示,每年新发的乳腺癌患者中3%~10%的妇女在确诊时已经有转移,复发转移是影响患者预后的重要因素。其治疗目的是延长患者生存时间、减轻症状、提高生命质量。目前治疗复发或晚期转移性乳腺癌的方式很多,但疗效不佳,且不良反应大,故相对不良反应小的分子靶向治疗成为热点。拉帕替尼为靶向药物,是一种双表皮生长因子酪氨酸激酶抑制剂,在2007年被美国FDA批准可用于HER-2阳性的复发或晚期转移性乳腺癌的治疗[5],近年来临床应用取得较好疗效。本研究对单病灶局部复发晚期乳腺癌患者采用化疗+双靶联合拉帕替尼治疗,取得一定疗效,现报告如下。
1 资料与方法
1.1 一般资料 收集我院2018年10月至2019年8月治疗的96例乳腺癌患者,均为女性。根据是否联合拉帕替尼治疗,将其分为联合组与对照组。联合组,年龄35~70(59.83±5.46)岁,体重指数21.45~30.12 kg/m2,平均(24.28±1.86)kg/m2,病程10~32个月,平均(24.16±3.52)个月;病理分型:浸润性导管癌38例(76.00%),浸润性小叶癌12例(24.00%);TNM分期:Ⅲa期20例,Ⅲb期16例,Ⅳ期14例;部位:左侧26例,右侧24例。对照组,年龄33~69(58.39±5.91)岁,体重指数22.05~30.57 kg/m2,平均(24.12±1.73)kg/m2,病程9.5~33个月,平均(24.76±3.43)个月;病理分型:浸润性导管癌35例(76.09%),浸润性小叶癌11例(23.91%);TNM分期:Ⅲa期18例,Ⅲb期15例,Ⅳ期13例;部位:左侧24例,右侧22例。两组患者一般资料比较差异无统计学意义(均P>0.05),具有可比性。本研究符合2013年修订的《赫尔辛基宣言》要求。病例纳入标准:年龄18~70岁;符合2013年《中国抗癌协会乳腺癌诊治指南与规范》[6]中诊断标准;免疫组化判定为HER2阳性,病理诊断为局部晚期乳腺癌患者;预期生存大于90 d;签署知情同意书。排除标准:合并重大器官病变者;特殊人群,如孕妇、哺乳期、精神病、认知障碍、病情危笃等患者;放化疗禁忌者。
1.2 治疗方法 两组患者均给予乳腺癌切除术治疗,两组患者均在手术后3周开始行曲妥珠单抗、帕妥珠单抗双靶联合表柔比星及环磷酰胺序贯多西他赛方案(EC-T)治疗,具体剂量如下:表柔比星(国药准字H20041211,5 ml∶10 mg )100 mg/m2;环磷酰胺(国药准字H20058600,规格0.1 g/支)500 mg/m2,均为第1 天静脉滴注,每3周重复,共4个周期;序贯多西他赛(国药准字H20113165,0.5 ml∶20 mg)100 mg/m2静脉滴注,第1 天,每3周重复,共4个周期;曲妥珠单抗首剂8 mg/kg,以后每次6 mg/kg;帕妥珠单抗首剂840 mg,以后每次420 mg,每3周重复,共4个周期。联合组同时给予口服拉帕替尼片(国药准字J20180011,0.25 g/片),1250 mg,1次/d,第1~21天服用,每3周重复。
1.3 观察指标 ①肿瘤标志物癌胚抗原(CEA)、糖类抗原15-3(CA15-3)、糖类抗原125(CA125)水平检测:于治疗前后抽取患者晨起空腹静脉血3 ml,离心留取上清液后应用双抗体夹心酶联免疫吸附试验(ELISA)法测定其治疗前、治疗后CEA、CA15-3、CA125表达水平,试剂盒均购于上海透景生命科技股份有限公司。②免疫功能检测:分别在治疗前、治疗后,抽取静脉血4 ml,送至检验科进行T淋巴细胞及亚群(CD3+、CD4+、CD8+、CD4+/CD8+)、NK细胞,体液免疫球蛋白(IgA、IgG、IgM)水平的测定;体液免疫球蛋白采用Array360免疫检测仪进行测定,T细胞亚群及NK细胞采用流式细胞仪进行测定。③生活质量:随访12个月,应用欧洲癌症治疗组织编制的生存质量问卷(QLQ-C30)第3版中文版评价本研究对象的生活质量;QLQ-C30量表包含总体健康状况、躯体功能、情感功能、社会功能、认知功能和角色功能等6个功能区,得分越高代表生活质量越好。
1.4 疗效判定标准 参照实体瘤的疗效评价标准(RECIST 1.0 )[7]进行制定。完全缓解(CR):所有肿瘤病灶全部消失;部分缓解(PR):肿瘤病灶缩小(以最大计算面积)≥50%,且未见新发病灶;稳定(NC):肿瘤病灶缩小<50%,或增大<25%;恶化(PD):肿瘤病灶增大>25%,或有新发病灶。总有效率=(CR+PR+NC)例数/总例数×100%。
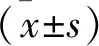
2 结 果
2.1 两组患者广谱肿瘤标志物水平比较 治疗后,两组CEA、CA125及CA15-3均较治疗前下降(均P<0.05),其中联合组各指标下降水平优于对照组(均P<0.05),见表1。
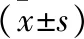
表1 两组患者广谱肿瘤标志物水平比较
2.2 两组患者免疫指标比较 治疗后,两组IgA、IgG、IgM水平均高于治疗前(均P<0.05),其中联合组各指标优于对照组(均P<0.05),见表2。治疗后,两组CD3+、CD4+、CD4+/CD8+、NK细胞比均高于治疗前(均P<0.05),CD8低于治疗前(P<0.05),其中联合组各指标优于对照组(均P<0.05),见表3。

表2 两组患者治疗前后IgA、IgG、IgM水平比较(g/L)
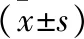
表3 两组患者治疗前后细胞免疫指标比较
2.3 两组患者临床疗效比较 联合组总有效率优于对照组(P<0.05),见表4。
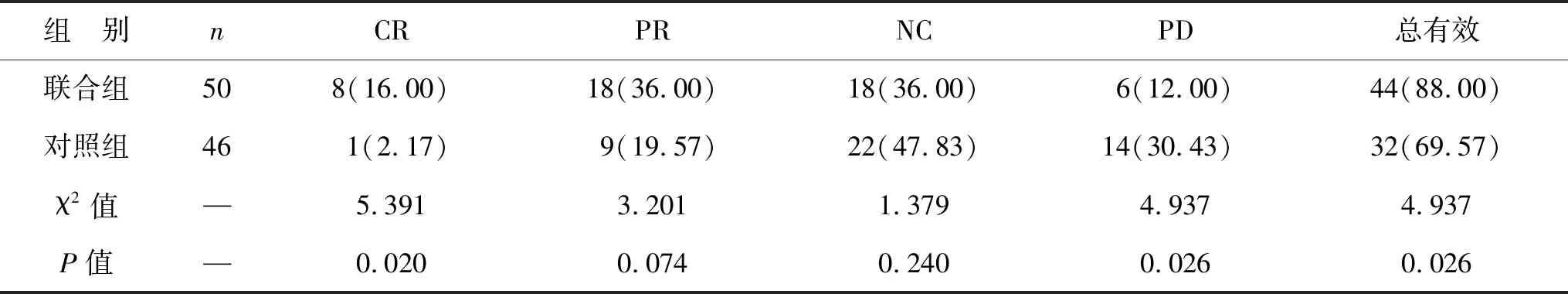
表4 两组患者临床疗效比较 [例(%)]
2.4 两组患者不良反应发生情况比较 联合组与对照组各不良反应发生率比较差异均无统计学意义(P<0.05),见表5。
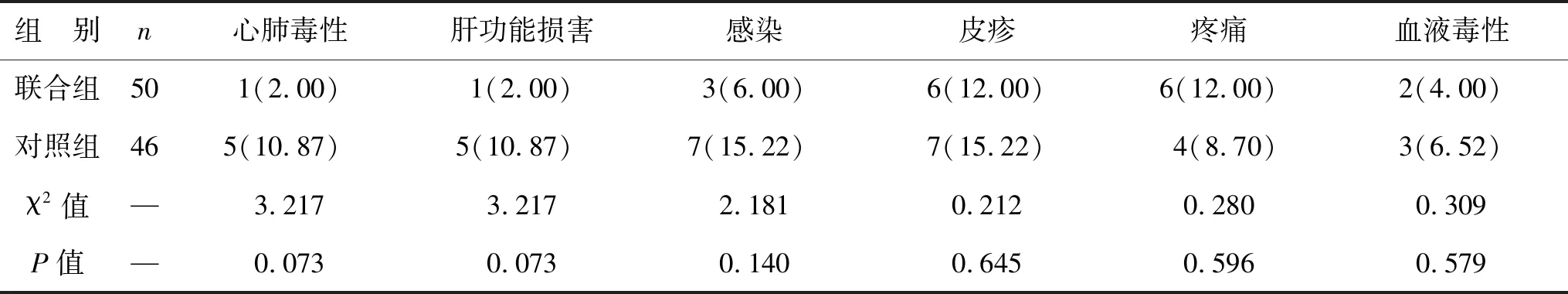
表5 两组患者不良反应发生情况比较[例(%)]
2.5 两组患者生活质量比较 治疗后,联合组躯体功能、情感功能、社会功能、认知功能、角色功能及总体健康状况得分均高于对照组(均P<0.05),见表6。
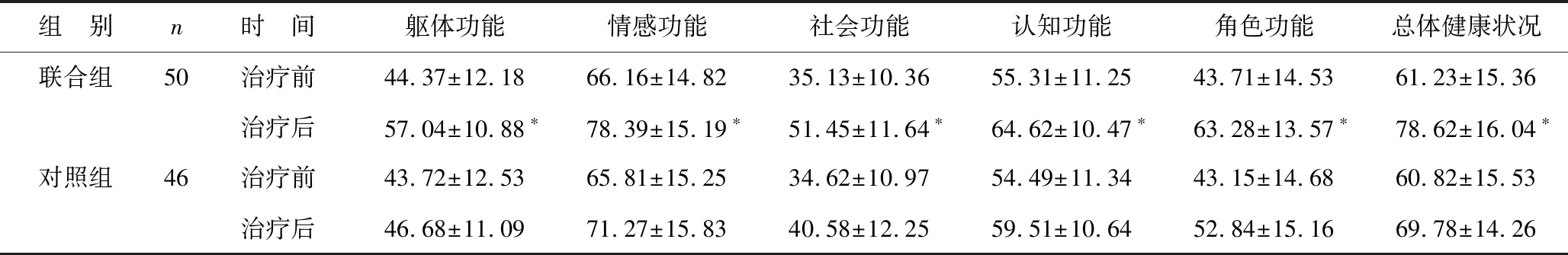
表6 两组患者生活质量比较(分)
3 讨 论
在全球范围内,中国乳腺癌发病相比较低,但呈逐年增高趋势且向年轻化发展,从流行病学趋势分析,未来较长一段时期内,乳腺癌的发病率和病死率还将继续升高[8-10]。目前临床对局部晚期乳腺癌患者通常采取手术联合术后放化疗的综合治疗模式。保乳术在临床中的应用虽然增加,但根治术仍是可以进行手术治疗的局部晚期乳腺癌患者的主要手术方式,术后以序贯化疗及放疗为主。目前针对HER2表达过度这一特别分子亚型的乳腺癌,靶向治疗起着关键的作用[11-14]。拉帕替尼是一种口服小分子酪氨酸激酶抑制剂,可同时对ErbB1和ErbB2酪氨酸激酶活性发挥抑制作用,还可通过二者的同质和异质二聚体阻断下调信号。临床报道显示拉帕替尼对曲妥珠单抗耐药的癌细胞可发挥较好的抑制作用[15]。对于HER2复发或转移性晚期乳腺癌亦有效。黄文发等[16]报道显示,拉帕替尼联合卡培他滨治疗HER-2阳性晚期乳腺癌临床获益率更高,中位疾病进展时间更长(8.1个月)。李娜妮等[17]采用拉帕替尼联合白蛋白结合型紫杉醇治疗曲妥珠单抗治疗失败的HER2阳性乳腺癌客观缓解率高,耐受性良好。
乳腺癌患者血清中的肿瘤标志物来自于持续增殖的癌细胞,而相关标志物是通过作用肿瘤细胞周期来调节细胞增殖的分子[18]。肿瘤增殖基因可加速肿瘤细胞的进展,促进细胞的生长和增殖[19]。本研究中,治疗后联合组广谱肿瘤标记物CEA、CA125、CA15-3均优于对照组,表明乳腺癌根治术辅助化疗联合拉帕替尼可明显提高患者的治疗效果,其机制可能与抑制癌细胞增殖基因有关。且表4显示联合组总有效率为88.00%,对照组为69.56%,联合组优于对照组。晚期乳腺癌患者免疫功能差,免疫功能低下可能是肿瘤发生及复发的内因,体液免疫球蛋和T淋巴细胞群水平可以反映免疫功能。本研究发现,联合组免疫指标均优于对照组。上述结果提示,乳腺癌根治术辅助化疗联合拉帕替尼可明显改善免疫功能,此结果与秦海运等[20]研究结果较为一致。但具体机制还有待研究。在不良反应方面,两组均有较低的不良反应发生率,表明联合拉帕替尼后未增加血液毒性、心肺毒性及皮疹等方面的不良反应。随访1年发现,联合组患者生活质量高于对照组,表明拉帕替尼辅助治疗可提高局部晚期乳腺癌患者的生活质量。
综上所述,乳腺癌根治术辅助化疗联合拉帕替尼能更好地改善单病灶局部晚期乳腺癌免疫功能以及降低广谱肿瘤标志物的作用,提高患者生活质量。但本研究也存在一定的不足,本研究中所纳入的样本数量有限,同时未进行长期随访,远期疗效如何未有研究,在后续的研究中希望增加样本量,对患者进行远期随访,以进一步探究拉帕替尼对单病灶局部晚期乳腺癌治疗的优越性。
