慢性阻塞性肺疾病急性加重期患者CT肺血管参数与肺功能及预后相关性分析
2023-05-13周璇,邹娟,谢莉,寇咏
周 璇,邹 娟,谢 莉,寇 咏
(四川大学华西医院呼吸综合科,四川 成都 610044)
慢性阻塞性肺病(Chronic obstructive pulmonary disease,COPD)是一种常见的进行性呼吸系统疾病,其临床特点为气流受限。慢性阻塞性肺疾病急性加重(Acute exacerbation of chronic obstructive pulmonary disease,AECOPD)指患者体征和症状突然恶化,出现痰液增多、咳嗽、喘息及呼吸困难等症状[1]。研究[2-3]表明,AECOPD主要由呼吸道病毒、细菌感染引起,其可导致气道炎症加重、气道壁结构重塑、动态肺过度充气、肺内气体陷闭等一系列变化,严重者可出现呼吸衰竭甚至死亡。据统计,AECOPD的病死率居全球前五位[4]。我国COPD患者每年约发生0.5~3.5次急性加重,其相关死亡占我国全部死因的11%[5]。因此,AECOPD的早期诊断和预后评估对改善AECOPD预后具有重要意义。目前,临床主要通过病情、症状体征、肺功能测定、急性加重史、呼吸困难评分(mMRC)等评估AECOPD患者的病情。但多项研究[6-7]指出,由于AECOPD患者发病初期症状隐匿,mMRC等评分易受主观因素影响,肺功能测定需患者的密切配合,AECOPD患者的病情评估存在一定难度。CT是诊断肺部疾病较为准确、有效的方法。相关研究显示,CT肺血管参数与COPD患者的肺血管血流灌注和病情严重程度均有一定的相关性[8]。本研究通过分析AECOPD患者CT肺血管参数与肺功能及预后的相关性,旨在为其预后评估提供参考,现报告如下。
1 资料与方法
1.1 一般资料 选取2019年1月至2022年9月收治的146例AECOPD患者作为AECOPD组,病例纳入标准:符合AECOPD诊断标准[9];患者知情并签署同意书;发病时间<24 h;年龄>18岁;耐受肺功能检查。排除标准:入院前服用过影响本研究结果的药物;血液、免疫系统疾病者;合并其他呼吸系统疾病患者;感染性疾病患者;既往肺部手术史;恶性肿瘤者;严重肝、肾部疾病者;严重意识障碍者。AECOPD组男85例,女61例;年龄42~79岁,平均(64.43±6.26)岁;病程3~6年,平均(2.85±0.52)年。选取同期健康体检者85例作为CR组,排除标准:呼吸系统疾病者;既往肺部手术史;入院前服用过影响本研究结果的药物;严重意识障碍者。CR组男40例,女45例;年龄38~76岁,平均(63.11±6.40)岁。两组性别、年龄比较差异无统计学意义(均P>0.05)。
1.2 研究方法 采用Philips Brilliance 64层螺旋CT,所有患者取仰卧位,吸气后屏气进而胸部扫描。扫描参数:管电压120 kV,管径120 mA,重建层厚1.0 mm。选择主动脉弓上缘1 cm、隆突下1 cm和右下肺静脉1 cm处3个层面图像用于测量肺小血管。每根肺小血管的横截面定义为<5 mm2,计算肺小血管面积百分比(%CSA)、肺动脉和主动脉直径比值(PA/A)。采用双盲法分析图像,取两次测量的平均值为最终结果。统计分析患者住院期间生存情况,将AECOPD组患者分为生存组(115例)和死亡组(31例)。
1.3 观察指标 ①统计分析两组CT肺血管参数和肺功能指标:包括%CSA、PA/A、用力肺活量(FVC)、第1秒用力呼气容积(FEV1)、第1秒用力呼气容积与用力肺活量的百分比(FEV1/FVC),采用肺功能检测仪S-980A I检测FVC、FEV1、FEV1/FVC水平。②统计分析CT肺血管参数与肺功能指标的相关性。③统计分析生存组和死亡组CT肺血管参数。④统计分析CT肺血管参数对AECOPD患者预后的预测价值。⑤统计分析AECOPD患者临床病例资料,包括性别、年龄、吸烟史、糖尿病、高血压、GOLD分级。⑥多因素Logistic回归分析AECOPD患者预后的影响因素。
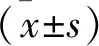
2 结 果
2.1 两组肺血管参数和肺功能指标比较 AECOPD组%CSA、FVC、FEV1、FEV1/FVC水平低于CR组,PA/A水平高于CR组,差异具有统计学意义(均P<0.05),见表1。
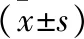
表1 两组肺血管参数和肺功能指标比较
2.2 CT肺血管参数与肺功能指标的相关性 Pearson相关性分析显示,%CSA与FVC、FEV1、FEV1/FVC呈正相关,PA/A与FVC、FEV1、FEV1/FVC呈负相关(均P<0.05),见表2。
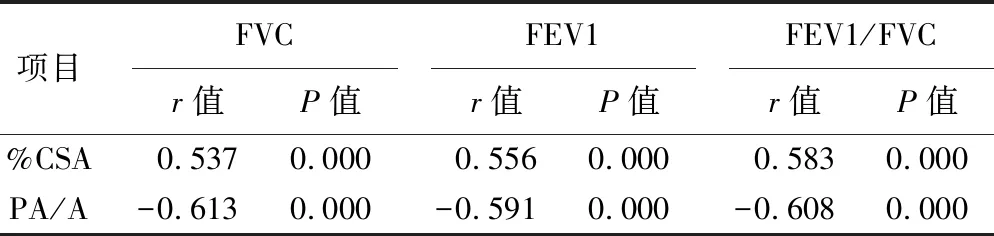
表2 CT肺血管参数与肺功能指标的相关性
2.3 生存组和死亡组CT肺血管参数比较 生存组%CSA水平高于死亡组,PA/A水平低于死亡组,差异具有统计学意义(均P<0.05),见表3。
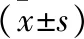
表3 生存组和死亡组CT肺血管参数比较
2.4 CT肺血管参数对AECOPD患者预后的预测价值 当约登指数最大值时取最佳截点值,ROC曲线分析显示,%CSA、PA/A联合预测AECOPD患者预后的AUC为0.871,高于%CSA的0.770,PA/A的0.784,且差异具有统计学意义(Z=2.533、2.743,P<0.05),见表4(图1)。
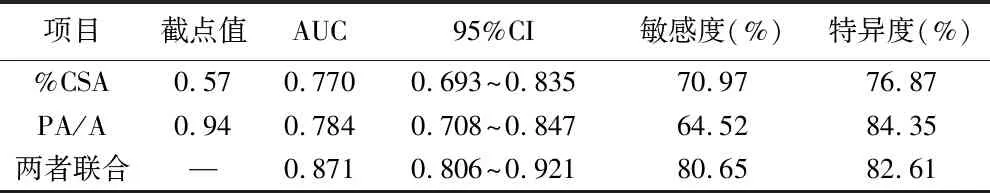
表4 CT肺血管参数对AECOPD患者预后的预测价值
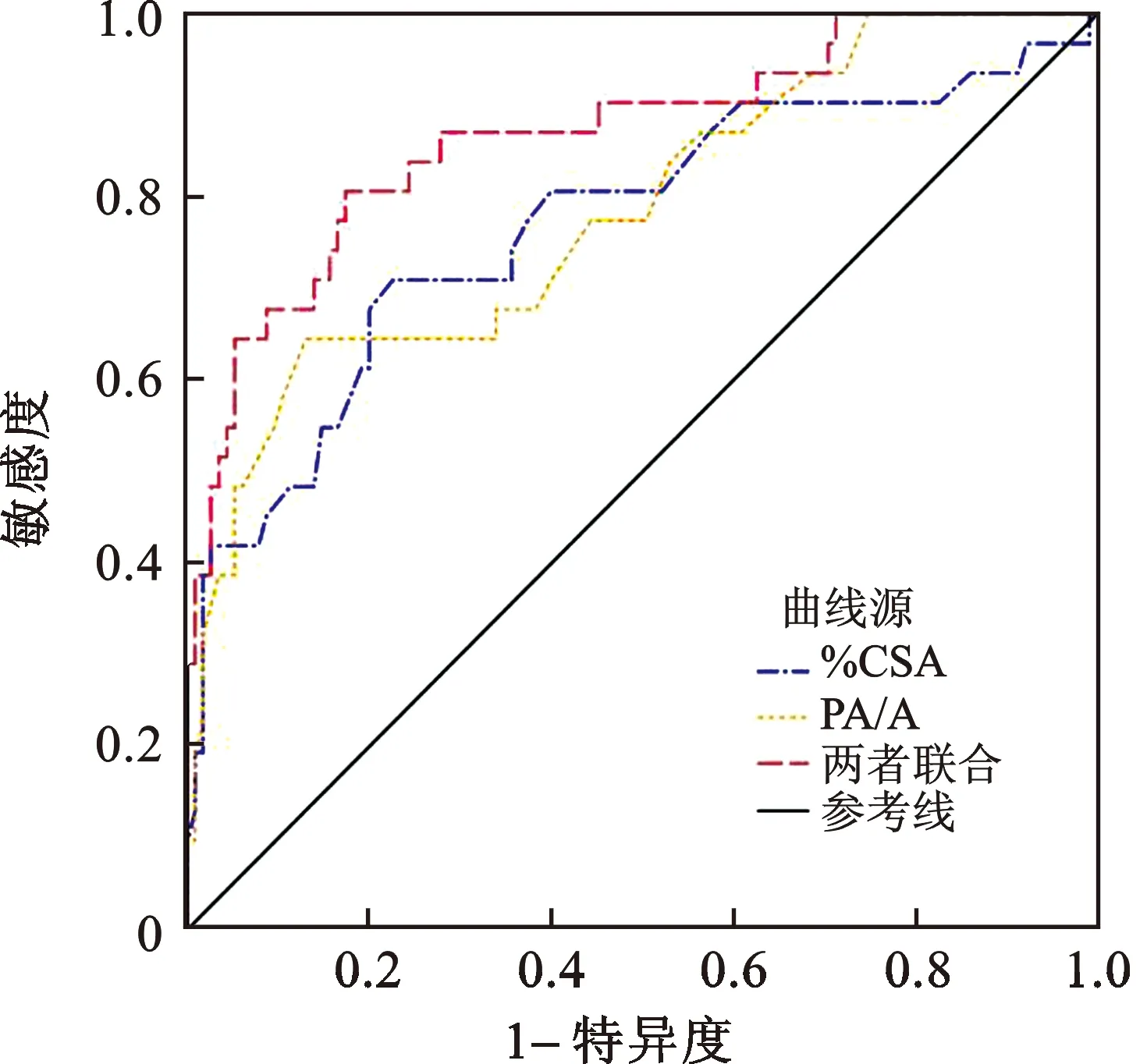
图1 CT肺血管参数诊断AECOPD患者预后ROC曲线
2.5 生存组和死亡组患者一般资料比较 生存组和死亡组患者在年龄、糖尿病、GOLD分级、%CSA、PA/A等方面比较差异具有统计学意义(均P<0.05),两组性别、吸烟史、高血压比较,差异无统计学意义(均P>0.05),见表5。
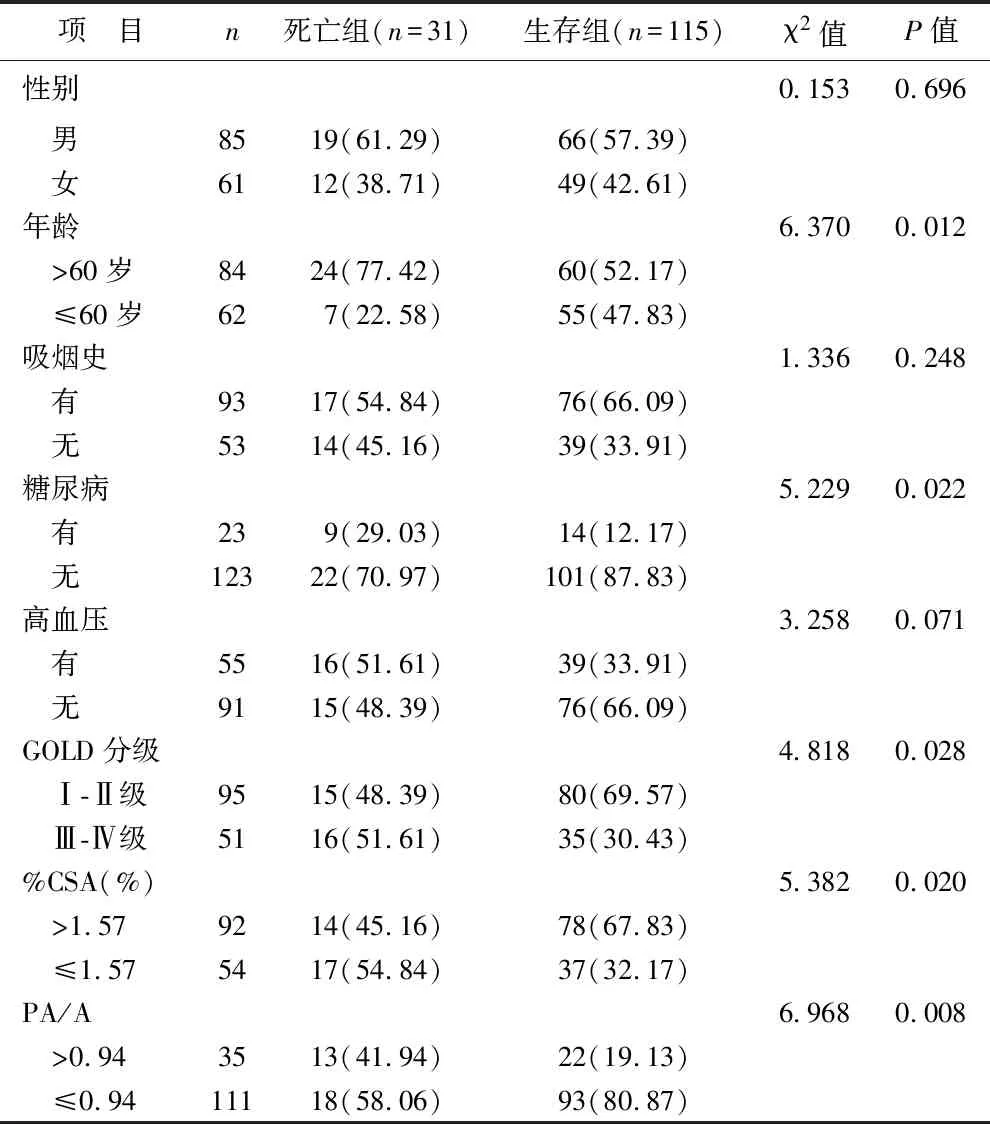
表5 生存组和死亡组患者一般资料比较 [例(%)]
2.6 多因素回归分析AECOPD患者预后的影响因素 将预后作为因变量,将表5中差异具有统计学意义的变量作为自变量,进行变量赋值,年龄(>60岁=1,≤60岁=0)、糖尿病(有=1,无=0)、GOLD分级(Ⅲ-Ⅱ级=1,Ⅰ-Ⅱ级=0)、%CSA(>1.57%=1,≤1.57%=0)、PA/A(>0.94=1,≤0.94=0)。采用二元Logistic回归分析,年龄>60岁(OR=4.181,P=0.003)、糖尿病(OR=4.412,P=0.010)、GOLD分级Ⅲ-Ⅳ级(OR=3.050,P=0.019)、%CSA≤1.57%(OR=2.965,P=0.020)、PA/A>0.94(OR=3.967,P=0.005)均为AECOPD患者预后的独立危险因素(均P<0.05),见表6。
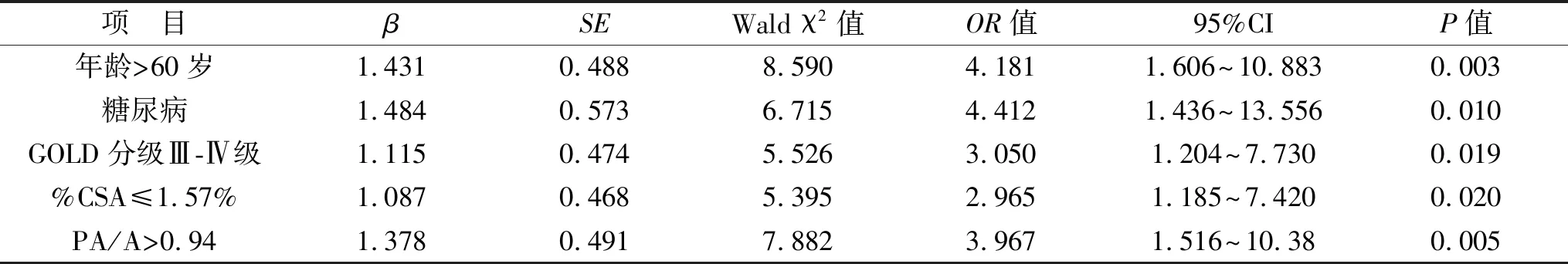
表6 多因素回归分析AECOPD患者预后的影响因素
3 讨 论
以往的研究指出,AECOPD与呼吸道感染、吸入刺激性气体、天气和环境均有一定的相关性[10-11]。相关统计发现,COPD的发病率呈逐年升高趋势,其已经成为全球主要医疗经济负担之一[2]。肺实质破坏和肺血管受累是AECOPD的重要病理机制。目前,临床通常采用CT测量肺动脉主干及周围分支的血管情况。本研究通过分析%CSA、PA/A与肺功能及预后的相关性,旨在为AECOPD的预后评估提供参考。
肺血管改变是COPD自然病程中的一个重要并发症,但目前对其病理生理机制的相关研究较少。内皮功能障碍是血管重塑和肺气肿的主要原因[12]。AECOPD可导致患者气道炎症加重、肺顺应性降低和肺功能下降[13]。%CSA、PA/A是一类新兴的肺血管评估指标,%CSA与平均肺动脉压正相关,而PA/A可反映肺部结构变化[14-15]。本研究中,AECOPD组%CSA、FVC、FEV1、FEV1/FVC水平低于CR组,PA/A水平高于CR组,这与以往的研究结果一致[16]。AECOPD可导致患者黏液高分泌、纤毛功能失调、肺实质被破坏和肺部长期缺氧,使平滑肌、蛋白多糖和胶原沉淀增多,进而导致肺动脉内膜增厚。此外,肺血管参数还可用于预测AECOPD及其病情的严重程度[17]。
Spearman相关性分析显示,%CSA与FVC、FEV1、FEV1/FVC呈正相关,PA/A与FVC、FEV1、FEV1/FVC呈负相关,说明AECOPD患者CT肺血管参数与肺功能相关。这种相关性的潜在机制归因于与肺实质破坏相关的小肺血管体积缩小,以及由于肺气肿、缺氧性血管收缩和内皮功能障碍的进展而导致的被动血管受压。由于%CSA指面积<5 mm2的肌性血管,其弹性小,一旦发生血管壁内膜增厚及狭窄时导致的肺功能下降时,该血管将发生缺血或坏死[18-19]。几项研究发现,肺血管的%CSA与COPD患者的症状、肺动脉压、肺功能、肺气肿的严重程度有关[20-21]。
本研究中,生存组%CSA水平高于死亡组,PA/A水平低于死亡组,说明AECOPD患者肺血管病理改变越明显,患者病情越严重,预后越差。相关研究证实,AECOPD患者的早期评估和治疗可显著改善肺小血管的形态,避免肺纤维化、肺功能下降等不可逆的损伤[22-23]。本研究采用二元回归分析,%CSA≤1.57%、PA/A>0.94均为AECOPD患者预后的危险因素,提示%CSA、PA/A可用于AECOPD患者预后评估。
综上所述,AECOPD患者CT肺血管参数(%CSA和PA/A)与肺功能及预后有相关性,临床可结合年龄>60岁、糖尿病、GOLD分级等进行预后评估。但本研究尚有不足之处,AECOPD患者预后受多种因素的影响,后续需通过多中心、大样本进行研究验证。
